响应面试验优化木瓜蛋白酶法脱马齿苋多糖蛋白工艺
2018-10-31胡庆娟吴光杰牛庆川白书瑜贺文杰李玉萍
胡庆娟,吴光杰,牛庆川,白书瑜,贺文杰,宋 皓,李玉萍*
(江西科技师范大学生命科学学院,江西 南昌 330013)
马齿苋(Portulaca oleracea L.)为药食两用的一年生草本植物,具有保护神经[1-2]、抗菌[3]、抗糖尿病[4-5]、抗氧化[6]、抗炎[7]、抗癌[8-10]等多种功效。研究表明马齿苋中含有生物碱、黄酮、多糖、多巴胺等多种生物活性成分[11-15]。其中,马齿苋多糖(polysaccharide from Portulaca oleracea L.,POP)是其主要活性成分之一,具有提高免疫力、抗病毒、降糖调脂、抗癌及抗衰老等生物活性[6,10,16-23]。
在提取POP的过程中,一般采用传统的Sevag法、三氯乙酸法和盐酸法脱除马齿苋多糖蛋白[24-25],尚鲜见木瓜蛋白酶法脱除马齿苋多糖蛋白的报道。以上几种脱除马齿苋多糖蛋白的方法需使用大量有机溶剂、步骤复杂、耗费大量时间,且存在大量多糖损失等问题[24-25]。酶促反应温和,可以水解较少的与多糖结合牢固的蛋白或被多糖包裹的蛋白,将糖释放出来,提升多糖得率。已有实验研究表明,相比于胰蛋白酶和中性蛋白酶,木瓜蛋白酶的脱蛋白效果更好[26]。响应面法能以最简单、高效的方式充分考虑各试验因素的交互作用,被广泛应用于分离提取的工艺优化和过程控制。
为此,本实验以POP损失率与POP溶液中蛋白去除率作为考察指标,探讨木瓜蛋白酶法脱除马齿苋多糖蛋白的效果,同时采用响应面法优化脱蛋白工艺,确定其最佳脱蛋白工艺;并对所获取的POP进行分离纯化以及高效液相色谱鉴定,确定POP所含的单糖种类,旨在为研究POP的进一步研究与开发提供参考。
1 材料与方法
1.1 材料与试剂
马齿苋购于江西省南昌市某蔬菜批发市场,经江西科技师范大学药学院药理学教研室鉴定,洗净烘干粉碎后备用。
牛血清白蛋白 杭州四季青生物工程材料有限公司;木瓜蛋白酶(≥3 U/mg)、1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)、三氟乙酸(trifluoroacetic acid,TFA) 美国Aladdin公司;考马斯亮蓝G-250 碧云天生物技术有限公司;葡萄糖、DEAE-52纤维素、Sephadex G-200 北京Solarbio公司;葡萄糖醛酸、半乳糖醛酸 美国Sigma公司;葡聚糖中国计量科学院;所用化学试剂均为国产分析纯。
1.2 仪器与设备
D-63505鼓风干燥箱 美国Thermo公司;FW-177粉碎机 天津泰斯特仪器有限公司;HH5电热恒温水浴锅上海博讯实业有限公司;UV-2600型紫外-可见分光光度计美国Unico公司;JJ500精密电子天平 美国双杰兄弟公司;Milli-Q超纯水系统 美国Millipore公司;PHS-29A数显酸度计 上海虹益仪器有限公司;1100型高效液相色谱仪 美国Aglient公司;BSZ-100B型自动部分收集器、DHL-A型电脑恒流泵 上海泸西分析仪器厂;真空冷冻干燥机 德国Labxonco公司;旋转蒸发仪 上海亚荣生化仪器厂;5804R型离心机 德国Eppendorf公司;F-2700荧光分光光度计 日本Corporation公司。
1.3 方法
1.3.1 POP的制备
将马齿苋粉末进行分组包装(20 g/个)放置在索氏提取器内,加入150 mL的石油醚,90 ℃回流2 h,溶剂挥干后,重新置于索氏提取器中,加80%乙醇溶液150 mL于圆底烧瓶中,90 ℃回流2 h,将处理好的马齿苋粉末在通风处挥干备用。按照水料比15∶1(mL/g)、提取温度90 ℃,提取时间分别按照90、60、30 min提取3 次,4 层滤布过滤,收集滤液,合并3 次滤液,4 000 r/min离心10 min[27],收集所有上清液。将所得上清液减压浓缩,然后用80%乙醇溶液醇沉[27],4 ℃过夜。离心,分别用无水乙醇、丙酮和乙醚洗涤沉淀,之后用适量水溶解。以大孔树脂用量60 g/L加入AB-8树脂、脱色时间3.5 h、脱色温度50 ℃进行脱色[28],过滤离心,80%乙醇溶液醇沉,4 ℃过夜,离心之后用适量水溶解沉淀,冷冻干燥,得到粗提POP。
1.3.2 标准曲线的制备
蛋白标准曲线建立:采用考马斯亮蓝G-250法[24]检测蛋白质含量。配制考马斯亮蓝G-250染液。配制1 mg/mL的牛血清蛋白标准液,分别移取0、0.01、0.02、0.04、0.06、0.08、0.1 mL标准液于具塞试管内,用蒸馏水补到1 mL,逐管加入5 mL考马斯亮蓝G-250染液,立刻涡旋混合,放置2 min后,在595 nm波长处测定吸光度。以牛血清白蛋白的质量浓度为X轴,吸光度为Y轴,作回归曲线,得回归方程:Y=0.825 7X+0.016 3,R2=0.998 4。
葡萄糖标准曲线建立:采用蒽酮-硫酸法[29]检测多糖含量。配制质量浓度为1 mg/mL的葡萄糖标准溶液,将标准溶液稀释成0、0.02、0.04、0.06、0.08、0.1 mg/mL的系列葡萄糖标准液,分别精确移取1.0 mL系列葡萄糖标准液于具塞试管内,用1.0 mL蒸馏水当作空白对照,逐管加入4.0 mL蒽酮-硫酸试液(0.3 mg/mL,现配)。迅速摇匀,将全部试管一起放在沸水浴中加热7 min,最后用流动的水冷却到室温。放置10 min之后,在580 nm波长测定吸光度。以葡萄糖系列标准溶液的质量浓度为X轴,吸光度为Y轴,作回归曲线,得回归方程Y=9.638 6X+0.017 6,R2=0.997。
1.3.3 POP损失率及蛋白去除率的测定
采用考马斯亮蓝G-250法,按照公式(1)计算蛋白去除率:
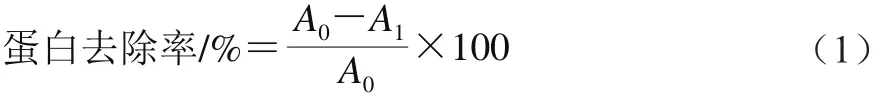
式中:A0表示脱蛋白前样品中蛋白含量;A1表示脱蛋白后样品中蛋白含量。
采用蒽酮-硫酸法,按照公式(2)计算多糖损失率:
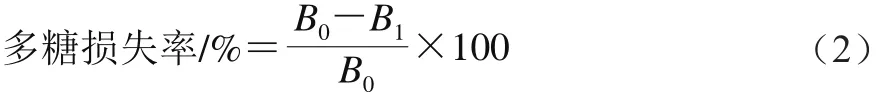
式中:B0表示脱蛋白前样品中多糖含量;B1表示脱蛋白后样品中多糖含量。
1.3.4 单因素试验
在酶解时间3 h、酶解温度60 ℃、pH 6.0的条件下,分别以0.05∶1、0.1∶1、0.15∶1、0.2∶1、0.25∶1、0.3∶1的酶液-样液体积比(酶液1 000 U/mL,样液10 mg/mL),进行酶法脱蛋白,之后在沸水浴中加热灭活10 min,4 000 r/min离心10 min,除去蛋白取上清液,用80%乙醇溶液醇沉4 ℃过夜,除去乙醇将多糖复溶,测得其多糖及蛋白质量浓度,根据1.3.3节的公式得出POP损失率及POP中蛋白去除率,考察酶液-样液体积比对木瓜蛋白酶法脱蛋白的影响。
在酶液-样液体积比0.2∶1、酶解温度60 ℃、pH 6.0的条件下,分别酶解1、1.5、2、2.5、3、3.5 h,考察酶解时间对木瓜蛋白酶法脱蛋白的影响。
以酶液-样液体积比0.2∶1、pH 6,分别在40、50、60、70、80 ℃温度条件下酶解3 h,考察酶解温度对木瓜蛋白酶法脱蛋白的影响。
以酶液-样液体积比0.2∶1、酶解温度60 ℃,分别在pH 3.5、4.5、5.5、6.0、6.5、7.5条件下酶解3 h,考察pH值对木瓜蛋白酶法脱蛋白的影响。
1.3.5 响应面试验
在上述单因素试验基础上,选取酶液-样液体积比(A)、酶解时间(B)、酶解温度(C)、pH值(D)为自变量,以POP中蛋白去除率与多糖损失率的比值为响应值(Y),应用Box-Behnken试验原理,采用4因素3水平响应面分析法进行试验设计,优化POP木瓜蛋白酶法脱蛋白工艺。响应面试验因素与水平见表1。
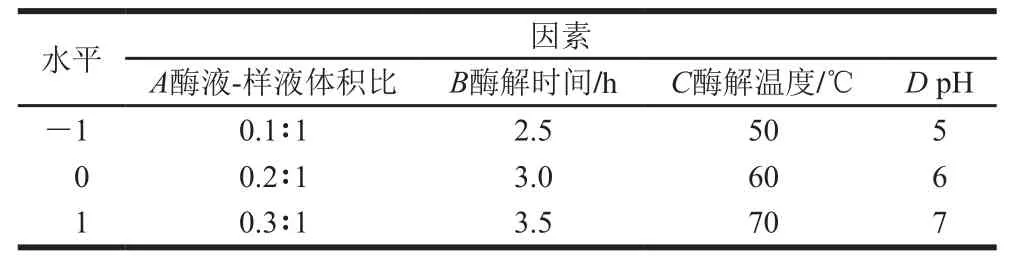
表1 Box-Behnken试验因素与水平设计Table 1 Coded levels and corresponding actual levels of the optimization parameters used in Box-Behnken experimental design
1.3.6 POP的分离纯化
称取350 mg粗提POP溶于蒸馏水中,终质量浓度为1 mg/mL,上样至纤维素DEAE-52阴离子交换层析柱(2.8 cm×60 cm)中,随后用0.1~0.4 mol/L NaCl溶液(流速1 mL/min,温度20~25 ℃)梯度洗脱,用数控计滴自动部分收集器收集洗脱液,每10 min收集一管(10 mL/管),并用蒽酮-硫酸法逐管检测多糖含量,收集主峰部分,得到2 个主要组分,依次命名为POP-A和POP-B。然后将收集液上Sephadex G-200凝胶柱(1.5 cm×60 cm)进一步纯化,0.05 mol/L NaCl溶液(流速0.5 mL/min)洗脱,每隔4 min收集一次(2 mL/管),蒽酮-硫酸法跟踪测定多糖含量,收集主峰的部分,蒸馏水透析24 h,然后减压浓缩,冷冻干燥得纯化POP样品。
色谱条件:Phenomenex-C18(250 mm×4.6 mm,5 μm)色谱柱;示差折光检测器;以乙腈-磷酸盐(pH 6.8)缓冲液(18∶82,V/V)为流动相;柱温:30 ℃;检测波长:250 nm;流速:1 mL/min;进样体积:20 μL。
标准单糖衍生化:取100 μL 10 种标准单糖(果糖、甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖,质量浓度均为0.5 g/L,等比例混合)的混合溶液加入到1 mL的具塞试管中,然后再加100 μL 0.6 mol/L氢氧化钠溶液,混匀。取50 μL的混合液于5 mL的具塞试管中,加入50 μL 0.5 mol/L PMP-甲醇溶液,振荡混匀,70 ℃水浴反应100 min,取出放置10 min冷却至室温,加0.3 mol/L的盐酸溶液50 μL中和,加水至1 mL,加入等体积氯仿,晃摇,静置,除去氯仿相,如此反复萃取3 次,0.45 μm水相微孔膜过滤后供高效液相色谱进样分析,参考文献[30]。
取100 μL含量较多的POP-A组分(5 g/L)溶液至5 mL的具塞试管内,加入100 μL的4 mol/L TFA,充N2封管,110 ℃烘箱中水解2 h,冷却后开盖,加入200 μL甲醇,之后用N2吹干,如此反复3 次,彻底除去TFA。然后加入50 μL 0.3 mol/L NaOH溶液,将残渣充分溶解,再加入50 μL 0.5 mol/L的PMP-甲醇溶液,振荡混匀,70 ℃水浴反应100 min,冷却之后用单糖衍生化法中和、萃取,并用微孔膜过滤后供高效液相色谱进样分析。
1.4 数据统计与分析
采用Design-Expert 8.0、Excel等分析软件对所得数据进行统计分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 酶液-样液体积比对多糖损失率和蛋白去除率的影响
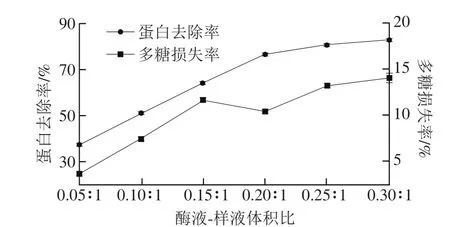
图1 酶液-样液体积比对脱蛋白效果的影响Fig. 1 Effect of enzyme to sample ratio on deproteinization efficiency
由图1可以看出,当溶液pH 6.0、60 ℃水浴中酶解3 h后,随着木瓜蛋白酶加入量的增大,蛋白去除率逐渐增大,在体积比为0.2∶1~0.3∶1范围内增长缓慢,分析其原因可能是随着酶液-样液体积比的增加,酶与底物反应更完全,蛋白去除率效果明显,但当溶液中的酶含量达到一定浓度时,蛋白去除率已趋于最大值。同时随着木瓜蛋白酶加入量的增大,多糖损失率先增加后降低之后,在体积比为0.25∶1~0.3∶1时,有稍微的平缓上升,但不明显。综合考虑蛋白去除率和多糖损失率,确定酶液-样液的较佳体积比为0.2∶1。
2.1.2 酶解时间对多糖损失率和蛋白去除率的影响
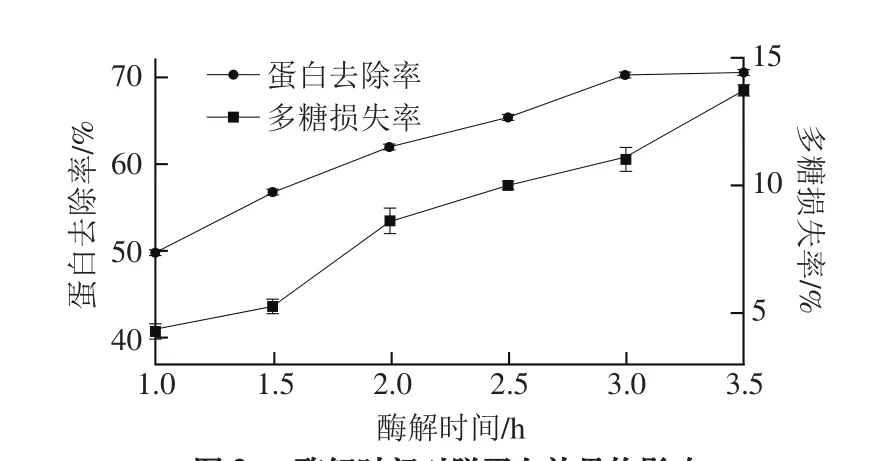
图2 酶解时间对脱蛋白效果的影响Fig. 2 Effect of hydrolysis time on deproteinization efficiency
由图2可看出,蛋白去除率随着酶解时间的延长而增大,但当酶解时间为3~3.5 h时,蛋白去除率变化不明显。多糖损失率则随时间的延长逐渐增加。因此,综合考虑蛋白去除率和多糖损失率,确定较佳酶解时间为3 h。
2.1.3 酶解温度对多糖损失率和蛋白去除率的影响
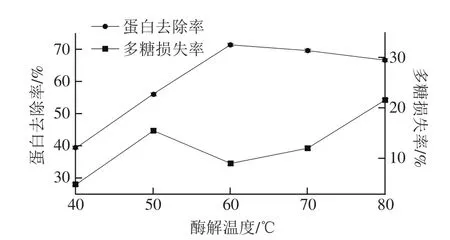
图3 酶解温度对脱蛋白效果的影响Fig. 3 Effect of hydrolysis temperature on deproteinization efficiency
由图3可以看出,随着酶解温度的升高,蛋白去除率先逐渐增加,在60 ℃时达到最大,随后随着温度的上升出现下降趋势。多糖损失率随着酶解温度的上升先增加后减少,但在60 ℃后又逐渐上升,可能是因为随着温度的上升,酶的活性降低,与底物反应的能力减弱。同时,多糖损失率在40~50 ℃迅速增加,50~60 ℃出现下降趋势,之后又出现上升趋势,可能原因是在温度偏低的条件下木瓜蛋白酶对多糖的降解作用会先于对蛋白的降解。当温度达到最佳时,木瓜蛋白酶对蛋白的降解作用加强,对多糖的作用减弱,随着温度的升高,温度又对多糖产生一定的降解作用。综合考虑蛋白去除率和多糖损失率,确定较佳酶解温度为60 ℃。
2.1.4 pH值对多糖损失率和蛋白去除率的影响
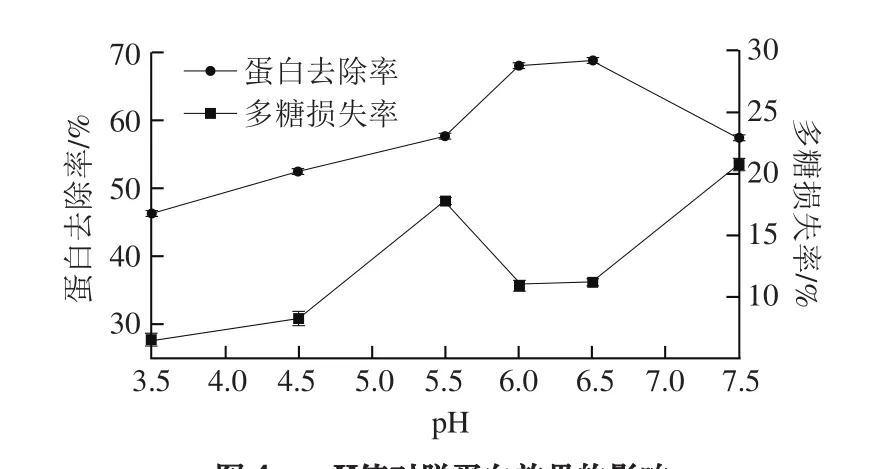
图4 pH值对脱蛋白效果的影响Fig. 4 Effect of pH value on deproteinization efficiency
由图4可知,蛋白去除率在pH 3.5~6.5之间逐渐增加,随后呈现下降趋势;多糖损失率随pH值的升高呈现波动状态。这是由于木瓜蛋白酶的化学本质是蛋白质,其在水解体系中的解离状态和行为要受溶液pH值的影响,同时,在微酸或者微碱的环境中会加剧多糖的降解,这也可能是多糖损失率呈现较大波动的原因。综合考虑蛋白去除率和多糖损失率,确定较佳pH值为6.0。
2.2 响应面试验结果
通过响应面法对酶液-样液体积比、酶解时间、酶解温度、pH值进行分析,以POP中蛋白去除率与多糖损失率的比值(蛋白去除率/多糖损失率)为响应值,得到试验方案及结果见表2。
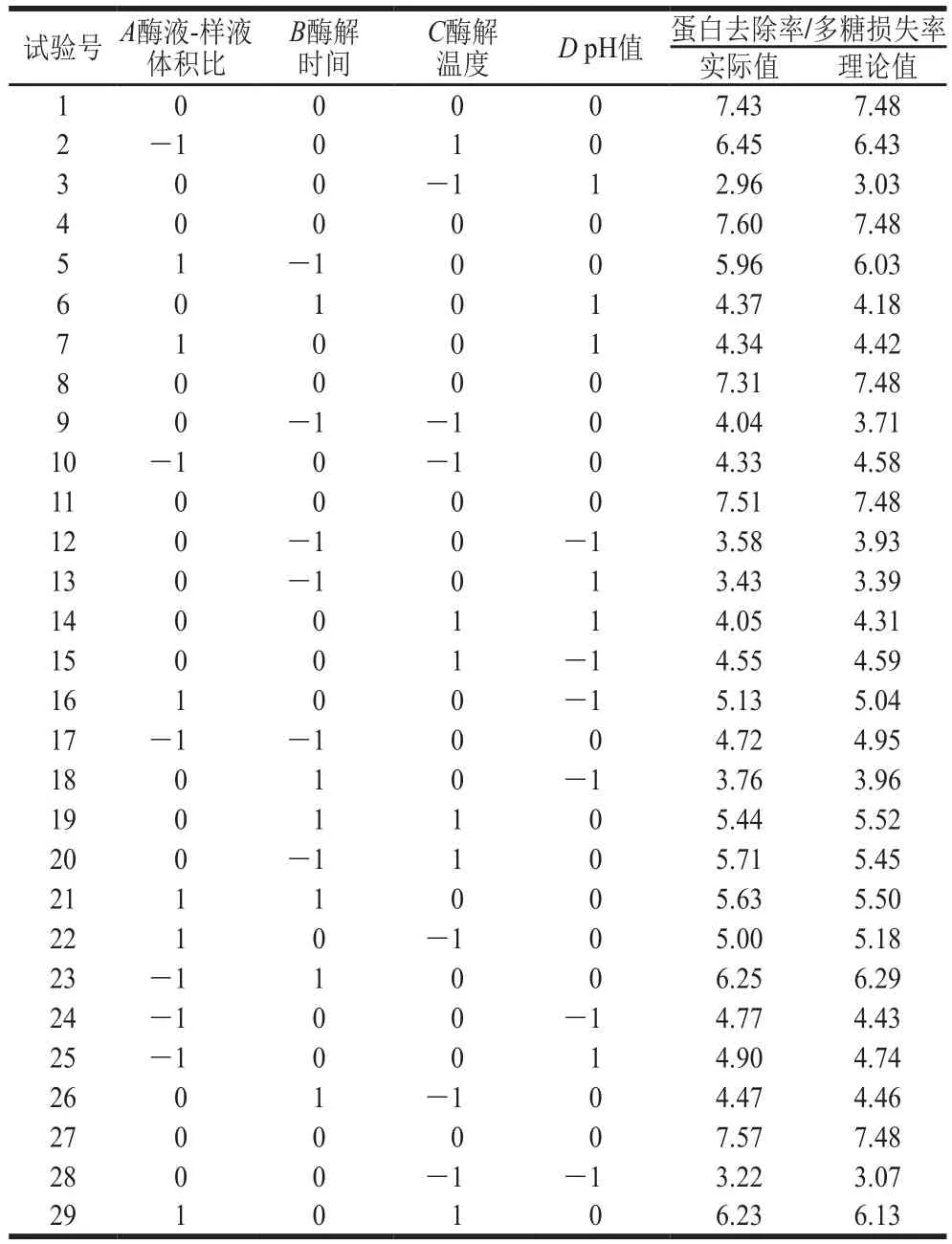
表2 响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
通过Design-Expert 8.0软件分析表2试验数据,拟合得到POP的蛋白去除率/多糖损失率(Y)和酶液-样液体积比(A)、酶解时间(B)、酶解温度(C)、pH值(D)的方程为Y=7.48+0.072A+0.21B+0.7C-0.081D-0.47AB-0.22AC-0.23AD-0.17BC+0.19BD-0.062CD-0.5A2-1.29B2-1.41C2-2.33D2。
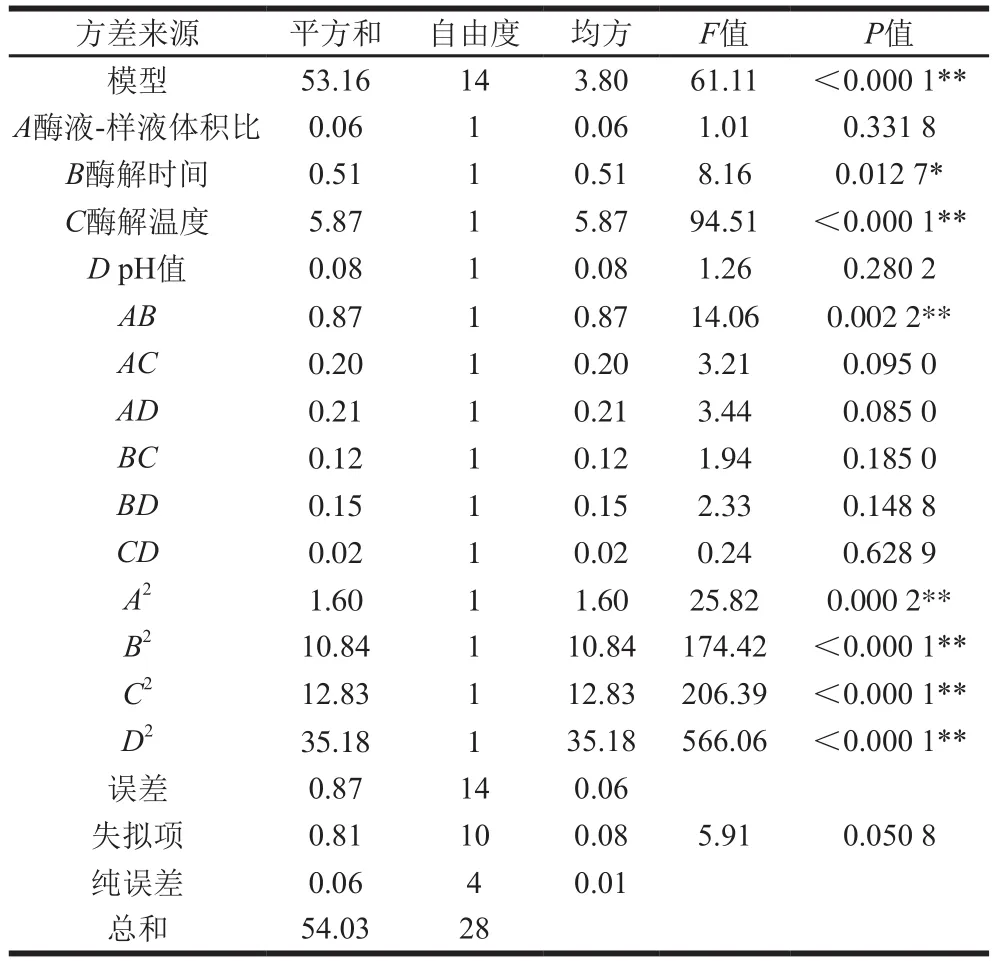
表3 回归方程方差分析Table 3 Analysis of variances for the developed regression equation
由表3可知,回归模型极显著,失拟项不显著,且R2为0.983 9,表明自变量与响应值之间的模型关系显著,即可用此模型分析和预测酶法除去POP中蛋白的结果。F值可以反映出各因素对试验响应值的影响大小,由表3可知,影响的主次顺序为酶解温度>酶解时间>pH值>酶液-样液体积比,其中,酶解温度对方程的影响极显著。对模型各项进行方差分析可知,模型中C、B、AB、A2、B2、C2、D2对响应值的变化起到不同程度的显著作用,且与Y的变化不是单一的线性变化。
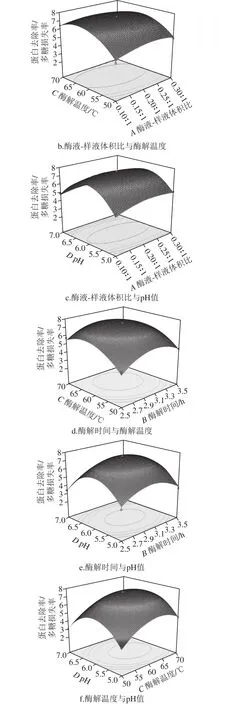
图5 各因素交互作用的响应面图Fig. 5 Response surface plots and corresponding contour plots showing the interaction effects of various parameters
由图5a可以看出,当酶解温度、pH值取固定值时,酶液-样液体积比与酶解时间对蛋白去除率/多糖损失率的交互作用明显。当酶液-样液体积比取不同值时,酶解时间对蛋白去除率/多糖损失率的影响表现出不同程度的变化;同理,当酶解时间取不同值时,酶液-样液体积比对蛋白去除率/多糖损失率的影响也表现出不同程度的变化。从单个因素对蛋白去除率/多糖损失率的影响看,酶解时间对蛋白去除率/多糖损失率影响的显著性大于酶液-样液体积比。由图5b可以看出,当酶解时间、pH值取固定值时,酶液-样液体积比与酶解温度对蛋白去除率/多糖损失率的交互作用不显著。但从单个因素对蛋白去除率/多糖损失率的影响看,酶解温度对蛋白去除率/多糖损失率影响的显著性大于酶液-样液体积比。由图5c可以看出,当酶解时间、酶解温度取固定值时,酶液-样液体积比与pH值对蛋白去除率/多糖损失率的交互作用不显著。从单个因素对蛋白去除率/多糖损失率的影响看,pH值对蛋白去除率/多糖损失率影响的显著性大于酶液-样液体积比。由图5d可以看出,当酶液-样液体积比、pH值取固定值时,酶解时间与酶解温度对蛋白去除率/多糖损失率的交互作用不显著。从单个因素对蛋白去除率/多糖损失率的影响看,酶解温度对蛋白去除率/多糖损失率影响的显著性大于酶解时间。由图5e可以看出,当酶液-样液体积比、酶解温度取固定值时,酶解时间与pH值对蛋白去除率/多糖损失率的交互作用不显著。从单个因素对蛋白去除率/多糖损失率的影响看,酶解时间对蛋白去除率/多糖损失率影响的显著性大于pH值。由图5f可以看出,当酶液-样液体积比、酶解时间取固定值时,酶解温度与pH值对蛋白去除率/多糖损失率的交互作用不显著。从单个因素对蛋白去除率/多糖损失率的影响看,酶解温度对蛋白去除率/多糖损失率影响的显著性大于pH值。
经软件分析计算得各因素水平最佳取值为酶液-样液体积比0.2∶1、酶解时间3.03 h、酶解温度62.45 ℃、pH 5.98。在此条件下的蛋白去除率为78.22%,多糖损失率为10.39%,蛋白去除率/多糖损失率比值为7.528。
2.3 POP分离纯化与鉴定结果
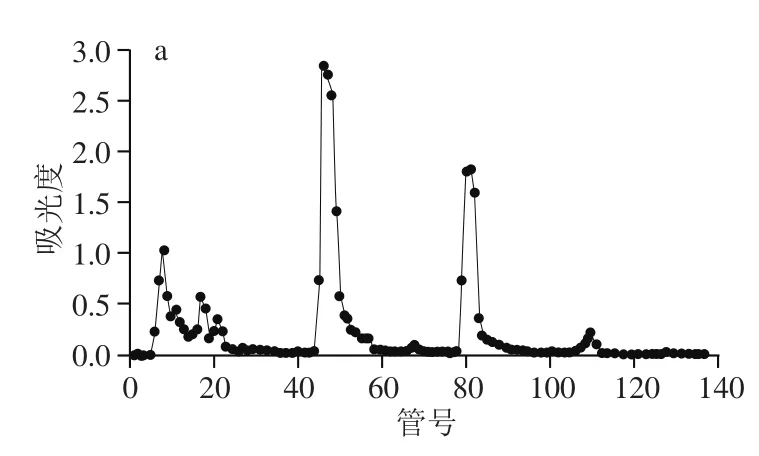
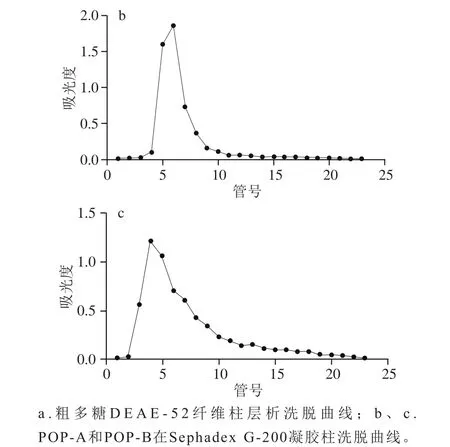
图6 POP分离纯化曲线Fig. 6 Isolation and purification of POPs
纤维素DEAE-52交换层析对粗提POP进行分级的洗脱曲线如图6a所示。0.2 mol/L NaCl溶液洗脱下来的多糖洗脱量最多,0.3 mol/L NaOH溶液洗脱下来的多糖次之,0.1 mol/L及0.4 mol/L NaCl溶液洗脱下来的多糖洗脱量较少。因此,得到了2个主要组分,依次命名为POP-A和POP-B,再用凝胶Sephadex G-200进行进一步纯化,收集分子质量较集中的组分,作为进一步研究的对象,见图6b和6c。
2.4 POP高效液相色谱分析
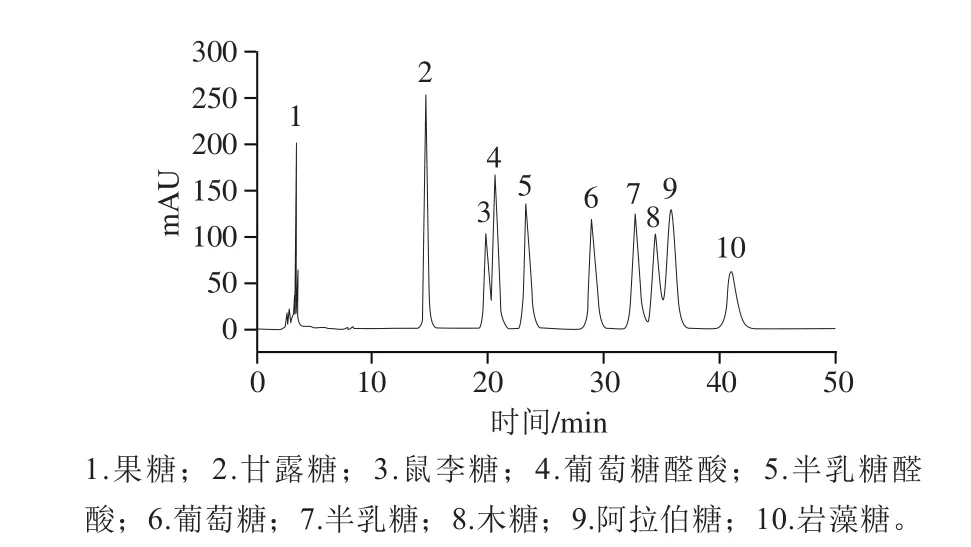
图7 标准单糖的高效液相色谱图Fig. 7 HPLC profiles of monosaccharide standards
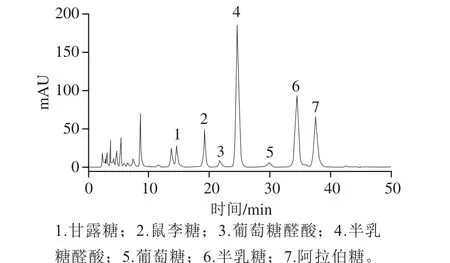
图8 POP的单糖高效液相色谱图Fig. 8 HPLC profiles of monosaccharides derived from POP
从图7和图8可知,POP-A单糖衍生化后得到了很好的分离。POP-A的单糖组成为甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖,其组成比例为5.3∶5.9∶1.3∶27.6∶1∶18.8∶14.6。
3 结 论
本实验采用木瓜蛋白酶法对POP溶液进行脱蛋白处理,以蛋白去除率和多糖损失率为评价指标,利用Design-Expert 8.0软件对实验结果进行分析,结果表明木瓜蛋白酶法脱马齿苋多糖蛋白的优化条件为酶液-样液体积比0.2∶1、酶解温度62.45 ℃、酶解时间3.03 h、pH 5.98,但考虑到实际条件,对上述优化条件进行修正,最终确定优化条件为酶液-样液的体积比0.2∶1、酶解温度60 ℃、酶解时间3 h、pH 6,在此条件下蛋白去除率为78.22%,多糖损失率为10.39%,蛋白去除率/多糖损失率比值为7.528。
粗提POP经过纤维素DEAE-52交换柱层析初步分级后得到主要组分,然后经Sephadex G-200柱层析进一步纯化后得到纯化多糖,冷冻干燥后为灰黄色棉花状固体粉末。利用高效液相色谱进一步分析表明,POP的单糖组成是甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖,其组成比例为5.3∶5.9∶1.3∶27.6∶1∶18.8∶14.6,为进一步开发和利用POP提供参考依据。
