表达外源谷氨酸脱羧酶基因对重组乳酸乳球菌胁迫抗性的影响
2018-10-31张亚敏傅瑞燕
陈 琪,张亚敏,赵 颖,梅 林,傅瑞燕
(1.安徽农业大学茶与食品科技学院,安徽 合肥 230036;2.茶树生物学与资源利用国家重点实验室,安徽 合肥 230036)
乳酸乳球菌(Lactobacillus lactis)不仅有助于提高食品的营养价值、改善食品风味,而且具有特殊的生理活性和营养功能,在调节机体胃肠道正常菌群的平衡、提高食物消化率和生物价、控制内毒素、抑制肠道内腐败菌生长繁殖和腐败产物的产生等方面发挥重要的作用[1-3],因此成为功能性食品开发的热点。但是,乳酸乳球菌在工业生产过程中会面临多种物理、化学方面的胁迫作用,包括酸胁迫、低温胁迫、氧胁迫、渗透胁迫等,从而抑制其生长,影响生产效率[4]。如何通过代谢工程的手段提升乳酸乳球菌对外源胁迫的抵御能力,进而改善其工业生产性能,是当前迫切需要解决的问题。
γ-氨基丁酸(gamma-aminobutyric acid,GABA)是一种普遍以自由态呈现的非蛋白质类氨基酸[5],对真核生物和原核生物多具有广泛的生理功能。GABA主要由L-谷氨酸经谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)脱羧产生。在大多数植物体内,当处于厌氧或者逆境条件下时,由于细胞内部的破坏,使得细胞质pH值下降,会激活GAD活性使得细胞通过脱羧反应将谷氨酸转变成碱性更强的GABA,消耗胞内H+,产生ATP,当细胞质pH值恢复正常后,GAD的活性又会下降[6-9]。因而GABA支路成为植物中一条重要的防止或减轻逆境引起的细胞酸中毒途径。
在乳酸乳球菌体内,由于糖类发酵过程中大量积累终产物有机酸,导致发酵体系的酸化,是其生长的本质特征[10],因而降低胞内pH值是其抗酸胁迫的一种主要方式。除了通过F1F0-ATPase向胞外运输H+以调控胞内pH值平衡之外,在酸性条件诱导下,还会启动GAD系统、柠檬酸代谢系统和精氨酸脱亚胺酶系统[11-13]等降低胞质酸化程度,从而减少酸胁迫[14]。
本研究基于植物GABA代谢调控机制的研究基础,利用食品级乳酸链球菌素(Nisin)控制的基因表达系统[15],将源自茶树的一条GAD基因与乳酸菌表达载体pNZ8148[16]连接后转入L. lactis NZ9000中,利用Nisin进行诱导表达,以调控GAD在乳酸乳球菌中的表达时机[17-18],研究高效表达GAD生产GABA的过程对于改良乳酸乳球菌菌株酸胁迫和冷冻胁迫抗性的影响,旨在为提高乳酸菌的抗胁迫能力及工业化生产GABA提供新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
L. lactis NZ9000、表达质粒载体pNZ8148 湖南长沙赢润生物技术有限公司;Escherichia coli DH5α菌株由本实验室保存。
1.1.2 试剂
Taq DNA聚合酶、PrimerSTAR®Max DNA Polymerase、pMD19-T Vector、dNTPs、DL 2 000 DNA Marker、T4 DNA连接酶、限制性内切酶HindIII、NcoI日本TaKaRa公司;Trans1-T1 Phage Resistant感受态细胞、TransStart®Fast Pfu Fly DNA Polymerase 北京全式金生物技术有限公司;质粒提取试剂盒、胶回收试剂盒美国Axygen公司;溶菌酶 北京Solarbio公司;Nisin 兰州伟日生物工程有限公司;GABA 美国Sigma公司;M17肉汤培养基 青海海博生物技术有限公司;MRS肉汤培养基 杭州微生物试剂有限公司;其他常用试剂均为国产分析纯。实验中聚合酶链式反应(polymerase chain reaction,PCR)产物的测序及所需引物的合成工作由美国Invirtrogen公司和上海生工生物工程有限公司完成。
1.1.3 培养基及溶液
GM17肉汤培养基:在M17肉汤培养基基础上添加质量浓度为5 g/L的葡萄糖溶液,即为GM17肉汤培养基;溶菌酶溶液:用TE缓冲液配制成20 mg/mL溶菌酶溶液,-20 ℃保存;Nisin的配制:用0.05%乙酸溶液配制成10 mg/mL的母液,使用时用超纯水稀释为终质量浓度为1 μg/mL溶液。
1.2 仪器与设备
C1000 PCR扩增仪、Gel Doc XR凝胶成像仪、Micro Pulser电穿孔仪 美国Bio-Rad公司;Centrifuge 5804R台式冷冻离心机 德国Eppendorf公司;600液相检测系统美国Waters公司;JY99-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;723可见分光光度计 上海佑科仪器仪表有限公司;垂直电泳槽 北京市六一仪器厂;DHP-916电热恒温培养箱 上海精宏设备有限公司;恒温水循环仪 上海锦华试验仪器厂。
1.3 方法
1.3.1 菌种活化
取-80 ℃冷冻保存于甘油的L. lactis NZ9000菌,解冻后接种于已灭菌的GM17肉汤液体培养基中,30 ℃静置过夜培养后,之后再次转接一次,培养至稳定期,即为活化种子培养液。
1.3.2 外源添加GABA对L. lactis NZ9000生长状态影响的测定
配制MRS肉汤液体培养基分装于15 mL的离心管中,每管10 mL,灭菌后备用。将活化后的种子液按照2%的接种量分别接种于新鲜的MRS肉汤液体培养基中,向培养基中加入不同浓度的GABA(0、2.5、5、10 mmol/L),每隔1 h在600 nm波长下测量菌液的细胞密度,以时间为横坐标,以细胞密度(OD600nm)为纵坐标,绘制生长曲线,同时以添加等量的茶氨酸(theanine,THEA)作为对比。根据乳酸菌代谢产生乳酸的特点,采用乳酸调节培养基pH 5.5,其余同上,观察生长曲线的变化。
1.3.3 外源添加GABA对L. lactis NZ9000抗冻能力影响的测定
取活化后的种子液依照2%的接种量分别接种于新鲜的MRS肉汤液体培养基中,并向培养基中加入不同浓度的GABA。根据生长曲线,分别培养至对数期中期、稳定期前期和稳定期中后期。取这3 个时期的发酵菌液,4℃、10 000 r/min离心5 min。菌泥经0.85 g/100 mL的生理盐水洗涤3 次后,用等体积的新鲜MRS培养基重悬,按每管1 mL分装后,分别置于4 ℃和-20 ℃进行冷冻胁迫。同样以添加等量的THEA作为对比。
每隔一段时间取出菌悬液解冻,4 ℃、10 000 r/min离心5 min后。用等体积生理盐水洗涤3 次并重悬,取10 μL重悬液,梯度稀释后点种于MRS培养基平板上,30 ℃静置过夜培养后测定菌落数,并进行3 次重复。
1.3.4 重组pNZ8148-CsGAD表达载体的构建
pNZ8148-CsGAD食品级表达载体的构建流程如图1所示。根据已经获得的茶树GAD序列,运用Primer 5.0软件在序列的5’和3’设计一对引物:CsGAD-up:CCGCCATGGATGGTTCTGTCAAAGACA,下划线处为N c o I酶切位点;C s G A D-d o w n:CCCAAGCTTTTAGCAAACACCATTAGT,下划线处为HindIII酶切位点。
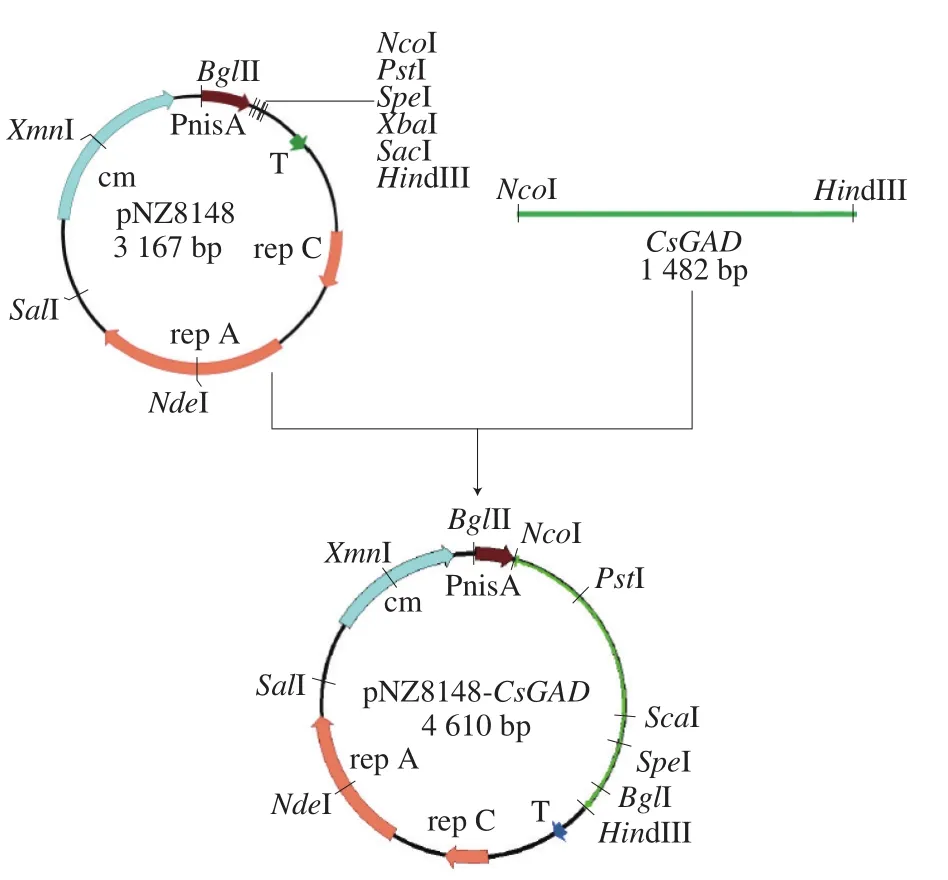
图1 重组质粒载体pNZ8148-CsGAD的构建Fig. 1 Construction of recombinant plasmid vector pNZ8148-CsGAD
利用高保真酶从提取的茶树叶片cDNA中进行PCR扩增,PCR扩增体系为总体积50 μL,Primer STAR Max Premix 25 μL,上下游引物各1 μL,DNA模板1 μL,ddH2O 22 μL。PCR扩增条件:95 ℃预变性3 min;98 ℃变性10 s,60 ℃退火15 s,72 ℃延伸90 s,共35 个循环;72 ℃延伸10 min。由于高保真酶扩增后产生平末端,因而扩增结束后可加入1 μL Taq酶72 ℃延伸30 min进行加尾反应,随后参照AxyPrep DNA凝胶回收试剂盒说明书进行PCR产物的纯化回收,并利用TA克隆与载体pMD19-T连接[19],构建pMD19-CsGAD质粒并转化入大肠杆菌Trans1-T1感受态细胞,氯霉素平板培养过夜后挑取阳性克隆测序。
确定测序结果与原始序列无误后,对提取的高浓度pMD19-CsGAD质粒和pNZ8148质粒分别进行NcoI和HindIII酶的双酶切。酶切体系:10×K Buffer 2 µL,NcoI 1 µL,HindIII 1 µL,质粒DNA(pNZ8148和pMD19-CsGAD分别进行酶切)约3 µL,牛血清白蛋白2 µL,ddH2O补充至20 μL,轻弹管壁混匀,37 ℃水浴3 h,将双酶切产物分别进行琼脂糖电泳后,进行凝胶回收。回收酶切产物用T4连接酶进行连接反应。连接体系:10×T4 DNA Ligase Buffer 1 μL,线性去磷酸化pNZ8148载体0.5 ng,酶切后的CsGAD 3 ng,T4 DNA连接酶0.5 μL,ddH2O补充至10 μL。16 ℃连接过夜后于65 ℃灭活15 min,利用DNA Clean-Up System将连接产物纯化回收获得重组的pNZ8148-CsGAD表达载体,再次转化入大肠杆菌Trans1-T1感受态细胞,培养过夜后挑菌测序。
确定结果无误后,摇菌提取pNZ8148-CsGAD质粒,利用电穿孔仪转入L. lactis NZ9000感受态细胞[20],30 ℃恢复培养2 h后涂布于含10 ng/mL氯霉素的GM17平板培养基上,30 ℃培养过夜,同时转入pNZ8148空载体作为对照。挑取阳性克隆进行菌落PCR和质粒双酶切的验证。电泳检测片段大小正确后表明获得重组乳酸菌L. lactis NZ9000/pNZ8148-CsGAD。
1.3.5 pNZ8148-CsGAD的诱导表达与十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)检测
将导入目的质粒pNZ8148-CsGAD的乳酸菌命名为重组菌,将导入pNZ8148空载体的乳酸菌命名为对照菌。对获得的重组菌L. lactis pNZ8148-CsGAD利用Nisin进行诱导表达后,利用SDS-PAGE对诱导表达蛋白进行检测,通过与对照菌总蛋白量进行对比,确定重组菌中GAD蛋白的表达。
活化重组菌L. lactis pNZ8148-CsGAD至5 mL GM17液体培养基中(10 ng/mL氯霉素),30 ℃静置培养过夜,随后按照5%接种量转接至GM17培养基,30 ℃静置培养至OD600nm为0.45~0.50[21],加入Nisin溶液使其最终质量浓度为2 ng/mL继续诱导培养8 h,最后用冷冻的石英砂碾磨提取菌体总蛋白进行SDS-PAGE,检测诱导表达目的蛋白[22],以转入pNZ8148空载体的乳酸菌作为对照菌同时进行处理。
1.3.6 高效液相色谱检测GABA含量
柱前衍生方法[23]:取样品1 mL置于10 mL棕色瓶中,加入0.5 mol/L碳酸氢钠(pH 9.0)溶液1 mL和1% 2,4-二硝基氟苯-乙腈溶液1 mL,混合均匀,置于60 ℃水浴中暗处反应1 h后取出冷却,加50 mmol/L氯霉素磷酸盐缓冲液(pH 7.2)至刻度。标准曲线的制作:取10 mg GABA标样,用超纯水配制成1 mg/mL的溶液。取1 mL标样按上述方法衍生后进行梯度稀释,过0.45 μm滤膜,进样。
色谱条件:Waters 600液相系统和Waters 2489紫外检测器,C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-水-磷酸盐缓冲液(pH 7.2)(20∶20∶60,V/V),检测波长360 nm,流速1 mL/min,柱温35 ℃,进样量5 μL。
取1.3.5节中加Nisin诱导后的重组菌与对照菌,4 ℃、10 000 r/min离心5 min。菌泥经0.85 g/100 mL生理盐水洗涤3 次后,用等体积50 mmol/L磷酸盐缓冲液(pH 7.2)重悬后超声破碎细胞,4 ℃、12 000 r/min离心5 min,取上清液过0.45 μm滤膜,测定GABA含量。
1.3.7 基因工程乳酸菌L. lactis pNZ8148-CsGAD抵御逆境能力的比较
1.3.7.1 抗酸能力的比较
配制GM17肉汤液体培养基,利用乳酸调节培养基pH 5.5和pH 4.0的酸性条件。每管15 mL分装灭菌,分别将重组菌和对照菌的活化种子液按照5%的接种量加入,并加入10 ng/mL的氯霉素,每隔2 h在600 nm波长下测定菌液的细胞密度,并绘制生长曲线。另外,因为质粒pNZ8148经Nisin诱导后会使蛋白大量产生,在接种的时候再加入2 ng/mL的Nisin诱导液,观察重组菌和对照菌生长曲线的变化。
1.3.7.2 抗冻能力的比较
将重组菌和对照菌的活化种子液按照5%的接种量分别接种于新鲜的GM17肉汤液体培养基(10 ng/mL氯霉素,2 ng/mL Nisin)中,培养及单位体积菌落数计算方法见1.3.3节,为避免两种菌培养过程中可能存在的起始数目差异,采用计算存活率的方式进行抗冻能力比较。
1.4 数据统计分析
所有数据利用GraphPad Prism 6.0软件ANOVA方法进行方差分析及t检验[24],并作图。
2 结果与分析
2.1 酸性条件下外源添加剂对L. lactis NZ9000生长曲线的影响
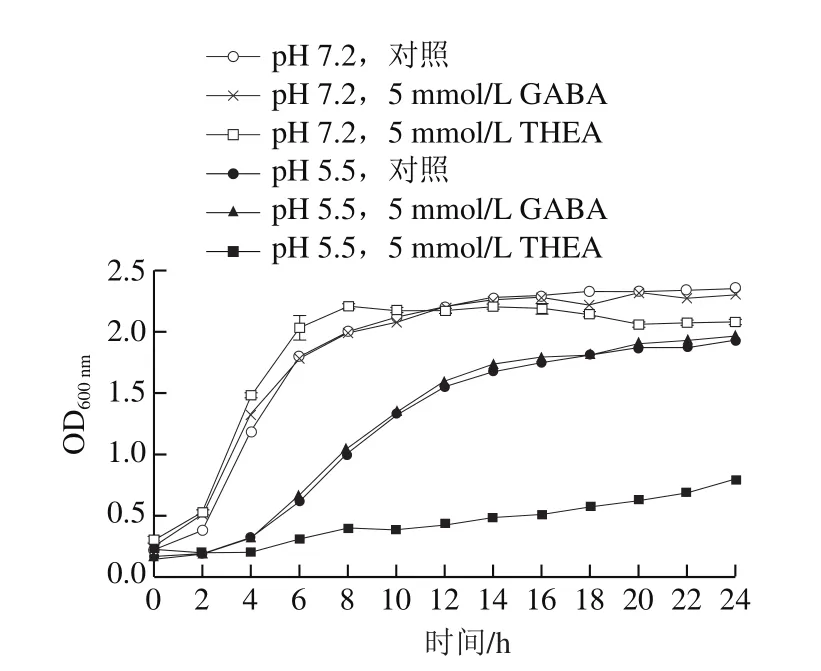
图2 不同培养条件对L. lactis NZ9000生长曲线的影响Fig. 2 Effect of different culture conditions on the growth of L. lactis NZ9000
预实验结果表明添加不同浓度的GABA对于乳酸菌的生长没有特别明显的影响,在添加5 mmol/L GABA时,乳酸菌培养至稳定期细菌的OD600nm最高,因而选择5 mmol/L GABA作为外源添加剂量进行后续的实验。考虑到额外添加氨基酸可能会有能量增加的影响,选择添加THEA作为外源氨基酸添加剂的参比,添加量同为5 mmol/L。由图2可知,在正常情况下(pH 7.2),外源添加GABA或THEA对L. lactis NZ9000的最大生物量(OD600nm)并无明显的影响。而在弱酸性培养环境下(pH 5.5),L. lactis NZ9000的生长速率明显受酸性胁迫影响而放缓,其到达稳定生长平台期的培养时间由正常条件下的8 h左右延长至14 h左右。同时,外源添加5 mmol/L GABA对于酸胁迫条件下L. lactis NZ9000的生长并无明显影响;但是另一方面,外源添加5 mmol/L THEA对于酸胁迫条件下L. lactis NZ9000的生长具有明显的抑制作用。这表明外源添加GABA并不能帮助乳酸菌抵御酸胁迫,而外源添加THEA对于酸性条件下培养的乳酸菌具有较强的抑制作用。
2.2 外源添加GABA对乳酸菌抗冻胁迫的影响
根据测得生长曲线,确定乳酸菌L. lactis NZ9000在正常培养条件下(pH 7.2)到达对数期中期、稳定期前期和稳定期后期的时间分别为4、8、20 h。随后对培养相应时间的乳酸菌分别进行低温胁迫处理。
由图3可以看出,对数生长期中期的菌置于4 ℃时,胁迫处理前期乳酸菌生长会有一个明显的增长趋势,但随着低温时间延长,菌体逐渐死亡,而在-20 ℃条件下,乳酸菌不能继续生长,存活数随着冻存时间逐渐下降。其他培养阶段的乳酸菌受到低温胁迫均会抑制其生长,随着处理时间延长,存活菌数显著下降。总体来说,低温胁迫前期会抑制乳酸菌的生长,并导致缓慢死亡,而后期(处理30 d以后)死亡数会明显增加,使得菌存活数目明显下降。处于4 ℃条件下的乳酸菌由于更容易产生冰晶使得存活率明显低于-20 ℃处理组。外源添加5 mmol/L GABA在大多数培养阶段并无作用,仅对处于稳定期中后期的乳酸菌表现出一定的帮助,而外源添加5 mmol/L THEA对于抗冷冻胁迫没有明显作用。因而可以排除GABA对乳酸菌抗逆胁迫起到一定作用的原因是由于培养基中能量物质增加所导致。基于此,设计外源表达载体向乳酸菌中导入一段茶树中的GAD序列,目的是经过Nisin诱导后,乳酸菌自身会大量合成GABA,进而观察高产GABA情况下乳酸菌抵御逆境的能力。
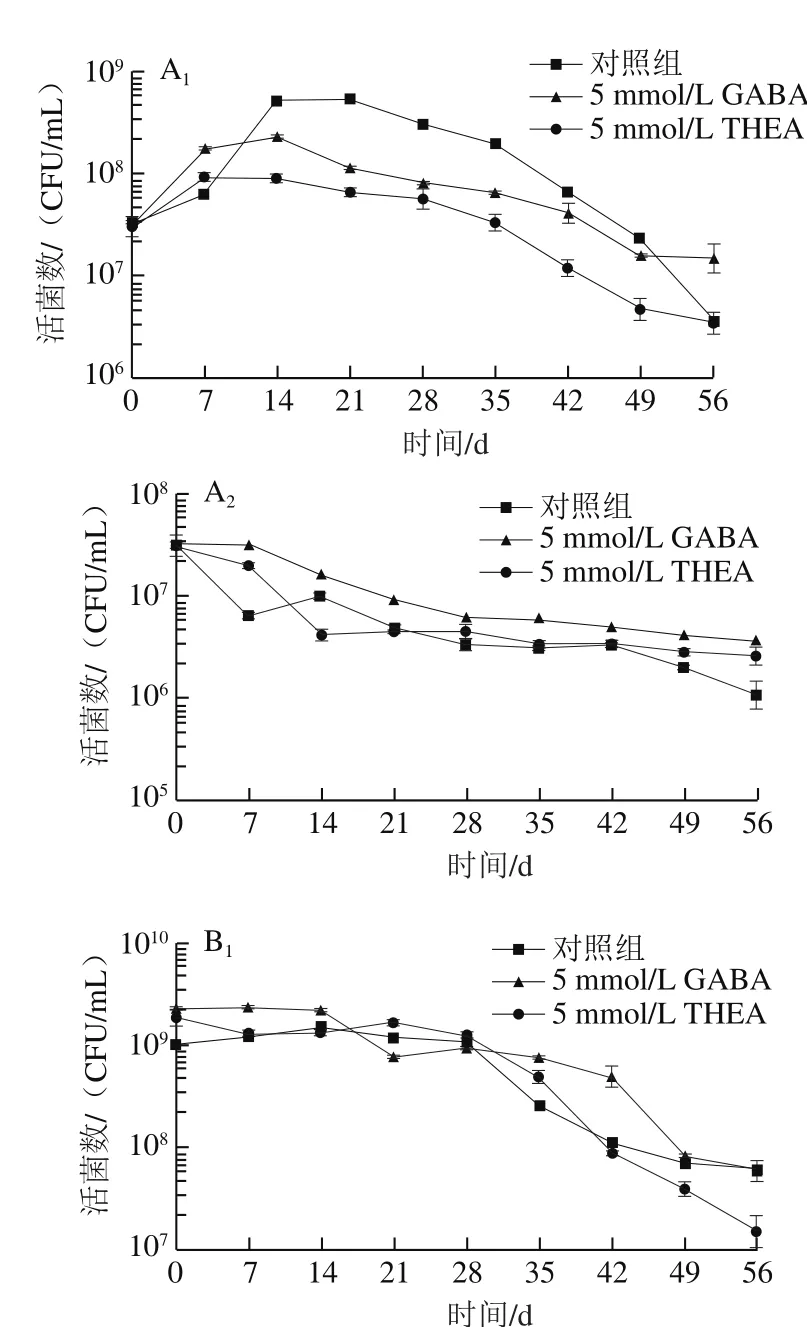
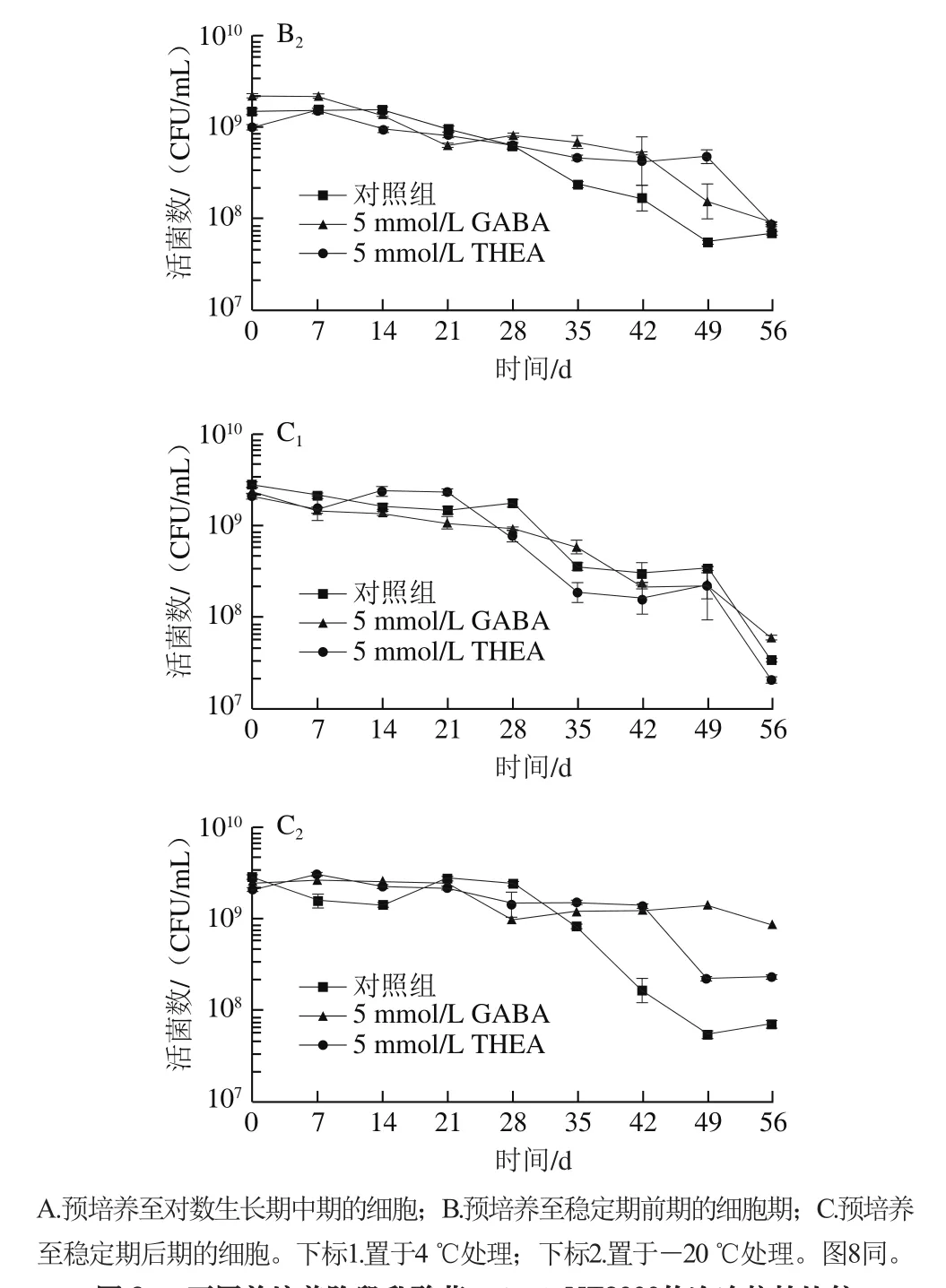
图3 不同前培养阶段乳酸菌L. lactis NZ9000的冷冻抗性比较Fig. 3 Comparison of anti-freeze ability of L. lactis NZ9000 cells at different growth phases
2.3 pNZ8148-CsGAD表达载体的构建结果
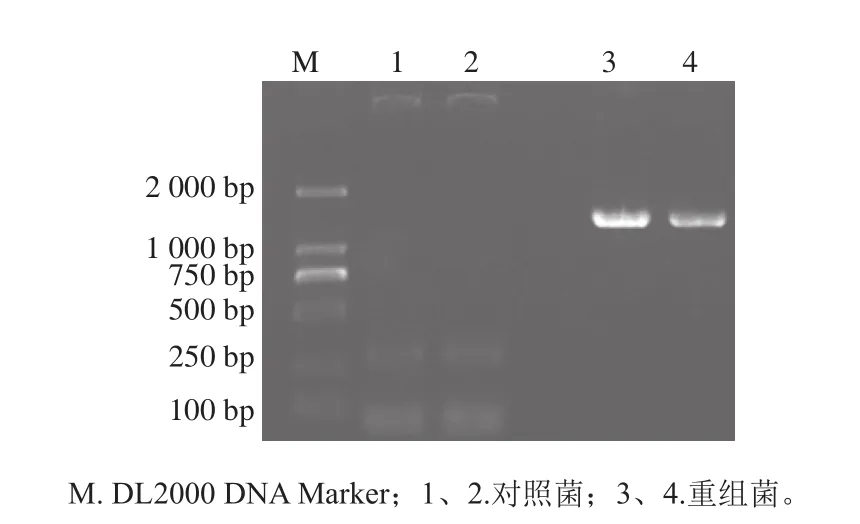
图4 菌落PCR检测的结果Fig. 4 PCR results of recombinant bacterial colonies
以改良CTAB法提取的茶树叶片mRNA为模板,反转录为cDNA后利用设计的GsGAD上下游引物进行扩增,得到大小约为1 500 bp的特异性条带。通过凝胶回收试剂盒回收纯化该PCR产物,通过TA克隆与PMD-19T载体连接并转入E. coli DH5α菌中,挑取阳性克隆测序,结果显示该序列长度为1 482 bp,与目标基因序列一致。将GsGAD与pNZ8148载体分别进行NcoI和HindIII的双酶切,然后利用DNA Ligase进行连接,热击转入大肠杆菌Trans1-T1感受态细胞中,通过蓝白斑抗性平板筛选阳性克隆,测序证明无误后,提取质粒pNZ8148-GsGAD电击转入L. lactis NZ9000中获得基因工程菌L. lactis NZ9000/pNZ8148-CsGAD。以转入空载体pNZ8148的L. lactis NZ9000作为对照菌,利用菌落PCR检测转化结果。由图4可知,重组菌中可扩增出大小约为1 500 bp的目的条带,而对照菌扩增无此条带。
2.4 CsGAD表达产物鉴定及其产GABA能力分析
收集2 ng/mL Nisin诱导8 h的重组菌L. lactis NZ9000/pNZ8148-CsGAD,利用SDS-PAGE分析总蛋白。根据CsGAD序列推算翻译后蛋白大小约为55.5 kDa。由图5可知,重组菌总蛋白添加Nisin后与对照菌相比在目的区域有明显的诱导条带,表明目的蛋白得到表达。经Nisin诱导表达CsGAD蛋白后,重组菌合成GABA的能力明显增强,由于L. lactis NZ9000菌株在pNZ8148受Nisin诱导过程中可以持续稳定合成GAD蛋白,保证了GABA的合成与积累,培养8 h后,重组菌中GABA的含量达到对照组的5 倍左右(图6)。
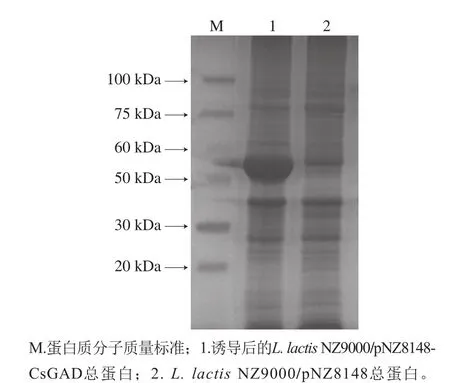
图5 SDS-PAGE检测目的蛋白Fig. 5 Identification of the target protein by SDS-PAGE
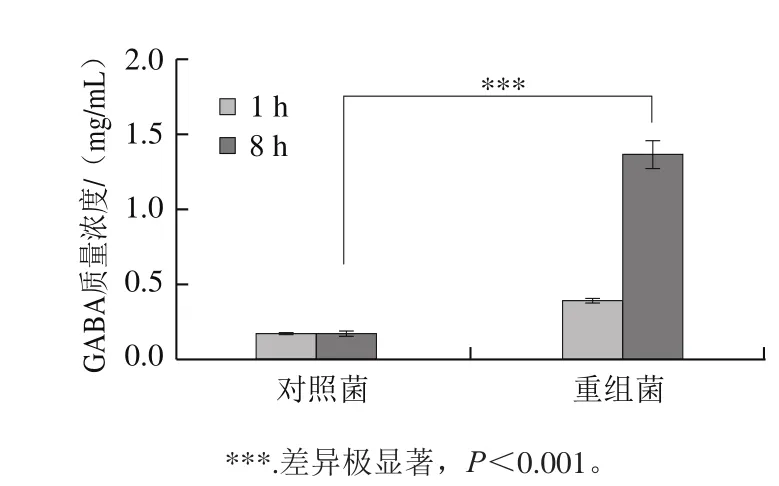
图6 HPLC测定乳酸菌中GABA含量Fig. 6 GABA content detected by HPLC
2.5 基因工程菌抗酸胁迫结果
在正常培养条件下添加Nisin对重组菌和对照菌进行培养,并测定生长曲线,由图7可以看出,重组菌与对照菌的生长曲线相比发生了明显的变化。其中对照菌大概在6 h达到了稳定期,而重组菌大约在10 h达到稳定期,但是重组菌到达稳定期的最大生物量大约是对照菌的1.5 倍,说明重组pNZ8148-CsGAD质粒在表达GAD的蛋白情况下大大提高了乳酸菌的生长活力。在弱酸性培养条件下(pH 5.5),重组菌与对照菌的生长均受到抑制,到达稳定期时间延长,而重组菌仍表现出一定的生长量优势;在pH 4.0的培养条件下,对照菌基本不生长,而重组菌表现出明显的酸胁迫耐受性。
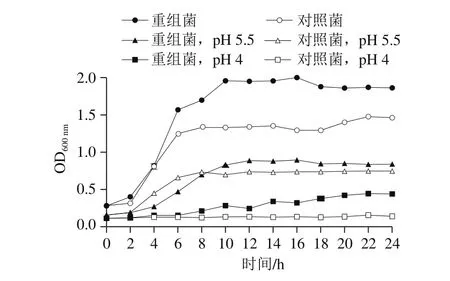
图7 酸性培养条件对L. lactispNZ8148-CsGAD生长的影响Fig. 7 Effect of acidic culture conditions on the growth of L. lactis pNZ8148-CsGAD
2.6 基因工程菌抗冷冻胁迫结果
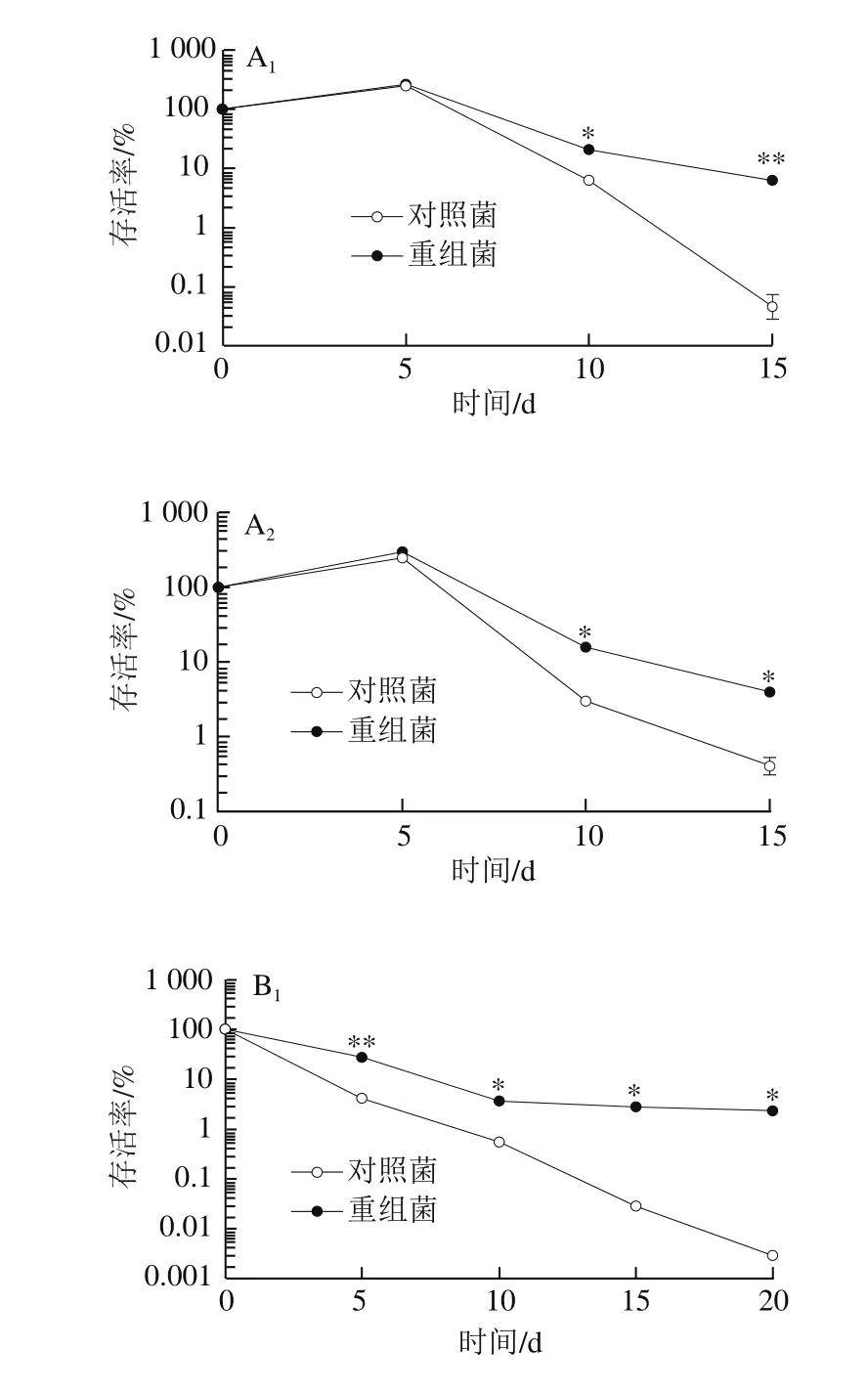
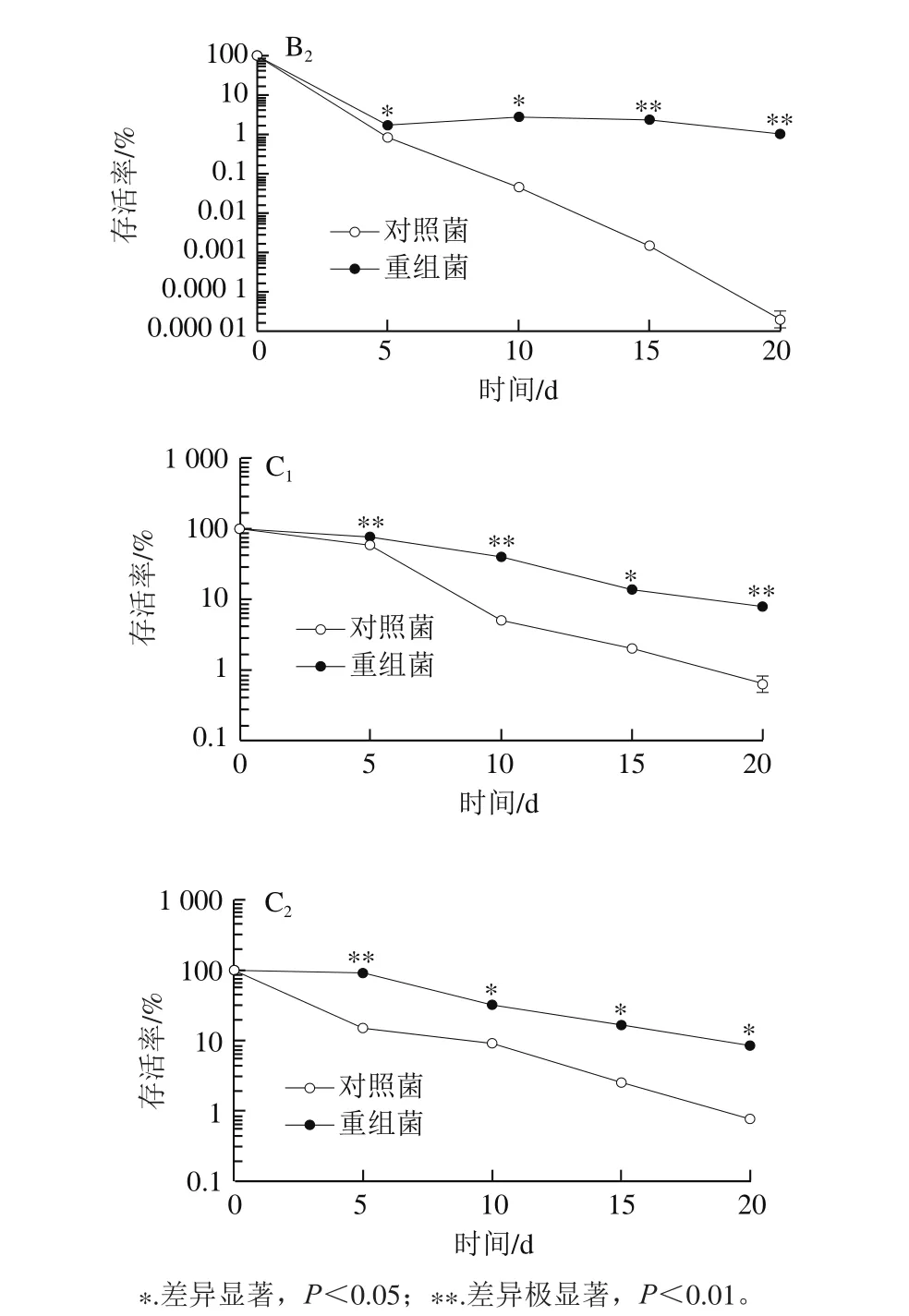
图8 不同前培养阶段的乳酸菌L. lactis pNZ8148-CsGAD的冷冻抗性比较Fig. 8 Comparison of anti-freeze ability of L. lactis pNZ8148-CsGAD cells at different growth phases
由图8可以看出,利用Nisin诱导表达CsGAD的重组菌在不同培养阶段对于低温胁迫的耐受性均明显高于对照菌,其中以预培养至稳定前期阶段的差异最为明显。总体来说,预培养至对数期中期和稳定前期的对照菌抵御冷冻的能力均很弱,当处理至15 d时,对照菌几乎都已死亡,重组菌存活率低于10%;培养至稳定期后期的重组菌抗冷冻能力明显增强,尽管对照菌的存活率有所上升,但仍能观察到重组菌的存活率明显高于对照菌,在4 ℃与-20 ℃胁迫条件下,培养15 d后存活率仍高于10%。表明利用Nisin诱导表达外源CsGAD基因后,高产GABA的乳酸菌相比于对照乳酸菌抗低温胁迫能力有了明显提高。
3 结 论
工业化生产时乳酸菌不可避免的遭受到各种逆境胁迫。本实验对比了外源添加GABA与体内合成GABA两种模式对于乳酸菌抗逆的影响,结果表明,正常培养条件和酸胁迫条件下,外源添加一定量的GABA对于L. lactis NZ9000的生长状态没有明显的影响。而低温胁迫情况下,乳酸菌在外源添加GABA相较于未添加物培养条件,表现出一定的生存优势。这可能是由于这些物质起到了一定的冷冻保护剂作用,抑制冷冻时细胞内冰晶的形成,减少冰晶对细胞膜的损伤,从而减少细菌的死亡[25]。当采用基因工程的方法将一段CsGAD基因导入L. lactis NZ9000,进而利用Nisin诱导GAD合成从而可以体内大量生成GABA时,再观察重组菌的生长情况发现,重组菌的生物增长量在进入稳定期后达到了对照菌的1.5 倍。在酸性培养条件下,尤其是pH 4的酸性条件下,重组菌的耐酸性明显高于对照菌,推测是因为重组菌在Nisin诱导后大量产生GAD,而当环境中的pH 4.0~5.5时,GAD就会通过脱羧反应消耗环境中的H+,同时会产生碱性较强的GABA中和H+[26-28]。
有研究表明,处在不同生长期的菌株对冷冻干燥的抗性有很大的差别[29]。一般来说,处在对数生长期末期和稳定期前期的菌体细胞其存活率较高,可能是对数生长期末期和稳定期前期的菌体细胞生长代谢最旺盛、活力也最强,与其他生长阶段的菌体细胞相比,耐受不良环境的能力也要强[30-31]。在本次低温胁迫实验中,同样发现普通L. lactis NZ9000在培养至稳定期前期时其抗冻能力要略优于对数期中期和稳定期后期2 个培养阶段,但是对于转入pNZ8148质粒的L. lactis NZ9000乳酸菌来说,处于稳定期后期的菌体冷冻耐受性表现较强,尤其是重组菌存活率明显高于其他2 个阶段,表明Nisin诱导重组菌表达CsGAD以促进GABA合成与积累的过程有助于提高乳酸菌的冷冻胁迫耐受性。综上所述,利用基因工程手段构建的L. lactis NZ9000/pNZ8148-CsGAD能明显提高乳酸菌抵御酸性和低温胁迫的能力,有利于乳酸菌的工业化生产。
