华莱士瓜采后丝状真菌的分离及rDNA ITS 区序列分析
2018-10-31王郅媛范雅为王友升
王郅媛,姚 婷,范雅为,张 燕,王友升,*
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048;2.北京科学仪器装备协作服务中心,北京 100035)
华莱士瓜(Cucumis melo cv. Hetau)属于葫芦科(Cutrbitaceae)甜瓜属(Cucumis)的厚皮甜瓜(C. melo L.),又称蜜瓜[1],产于内蒙古河套地区。华莱士瓜外表呈圆形或柠檬形,间有裂纹,分桔红、橙黄和青麻绿3 种皮色,瓜瓤呈纯白、绿白和翠绿色。其味独特,清爽芳香,且营养丰富,深受消费者喜爱。但因其含水量和含糖量高,生理代谢旺盛,易受病原菌侵染[1-2]。蒋贤权等[3]对甜瓜采后病原菌进行研究,甜瓜采后病害已发现20 余种。据报道,甜瓜病原真菌主要有链格孢菌(Alternaria)、镰刀菌(Fusarium)、青霉菌(Penicillium)等,比较常见的还有白地霉病菌(Geotrichum candidum)、茎点霉病菌(Phomopsis archerinom)和赤霉(Gibberella)等[4-7]。王志田等[8]发现引起哈密地区甜瓜软腐病、红粉病、白霉病、黑斑病和青霉病的病原菌分别是毛霉菌(Mucor mucedo)、红粉病菌(C. roseum)、镰刀菌、链格孢菌和青霉。然而,目前鲜见引起华莱士瓜采后病害病原真菌的相关报道。
利用rDNA基因内转录间隔区(internal transcribed spacer,ITS)的可变区分化程度高、变异性强的特点,可通过分析较短的rDNA ITS区序列信息,快速有效地从分子水平上解决真菌分类鉴定及进化水平上的差异性问题[9-12]。虽然对由真菌引起的甜瓜病害研究较多,但目前尚鲜见利用rDNA ITS区序列分析技术系统研究有关河套地区华莱士瓜病原真菌的报道,也少见引起甜瓜病害菌属内种间的分类报道。
本研究从采后贮藏期间的华莱士瓜上分离到12 株丝状真菌,结合形态学和rDNA ITS区序列分析结果,发现了引起华莱士瓜采后病害的新病原微生物,以期进一步丰富华莱士瓜采后病原微生物种类,为华莱士瓜采后病害的生物防治提供实验参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
从采后贮藏期间自然发病的“华莱士瓜”果实表面分离到12 株丝状真菌,经纯化后命名为菌株348#、351#、353#、357#、358#、360#、361#、362#、364#、378#、379#、380#。
1.1.2 培养基
麦芽浸粉(ME)培养基:琼脂18 g、麦芽浸粉20 g,调节pH值至5.5±0.2,在高温高压灭菌锅中121 ℃灭菌20 min。
马铃薯(PDA)培养基:称取200 g马铃薯切片,加入1 L无菌水,用电池炉煮沸30 min后,取滤液,向滤液中加入葡萄糖20 g、琼脂18 g,最后加水补足至1 L,在高温高压灭菌锅中121 ℃灭菌20 min。
1.1.3 试剂
通用引物ITS-4和ITS-5由美国英杰(Invitrogen)生命技术有限公司负责合成;DNA分子质量标准2×Taq PCR Mix、Marker VII、6×Loading Buffer(溴酚蓝)天根生化试剂公司;三羟甲基氨基甲烷、十二烷基硫酸钠、乙二胺四乙酸钠 美国Amersco公司;乙醇、盐酸均为国产分析纯。
1.2 仪器与设备
CJ100净化试验台 北京赛伯乐实验仪器有限公司;HQ45恒温摇床、MJX-250 II霉菌培养箱 广东省医疗器械厂;Imager 2200凝胶成像系统 美国Alpha公司;聚合酶链式反应(polymerase chain reaction,PCR)仪美国Bio-Rad公司;冷冻离心机 美国Sigma公司;Axio Image A1显微镜 德国Zeiss公司;生物安全柜 美国Thermo公司。
1.3 方法
1.3.1 菌种的分离、纯化与回接[13]
分离:取华莱士瓜果实的病害、健康交界处组织于PDA固体培养基平板上,25 ℃培养3 d。纯化:取分离菌边缘菌块,分别三点转接到PDA和ME培养基平板上,于25 ℃培养14 d,观察7 d和14 d菌落形态和个体形态特征。回接:挑选健康无损伤的华莱士瓜,75%乙醇溶液表面消毒,用无菌接种针刺孔,取纯化后的菌块接种至伤口处,观察果实接种处的病症。
1.3.2 形态学观察
将纯化得到生长于PDA培养基上的菌落,从菌落外沿取菌块,分别三点转接到PDA和ME培养基平板上,于25 ℃条件下培养14 d,分别观察菌落形态。于洁净载玻片上,滴1滴乳酸石炭酸棉蓝染色液[14],将插片培养的盖玻片置染色液中,然后盖上盖玻片,置于显微镜下观察产生分生孢子及分生孢子梗的形状、色泽和分生孢子隔膜等性状。
1.3.3 基因组DNA的提取及ITS区PCR扩增与测序
基因组DNA的提取:采用改良后十二烷基硫酸钠-氯化苄法提取待鉴定菌株的基因组DNA[11]作为PCR模板。
ITS区PCR扩增:以真菌rDNA ITS区的通用引物ITS-4和ITS-5作为PCR扩增引物,扩增12 株菌的ITS区序列。
1.4 数据分析
PCR产物由北京六合华大基因科技股份有限公司进行脱盐、纯化和双向测序,测序结果在CExpress软件中进行序列拼接,将拼接结果在网站https://blast.ncbi.nlm.nih.gov/Blast.cgi上进行核酸比对[9],根据比对结果在GenBank数据库中寻找目的菌株同源序列,通过MEGA6软件进行同源性分析,构建进化树。
2 结果与分析
2.1 菌株的分离与回接结果
从采后贮藏期间自然发病的华莱士瓜上分离到12 株丝状真菌(图1a~l),纯化后回接到健康无伤的相应品种华莱士瓜上,在接种部位均出现相同的病症(图1A~L),并能从该病害部位再次分离得到相应病原菌,因此,可确定上述12 种丝状真菌均为华莱士瓜致病菌。
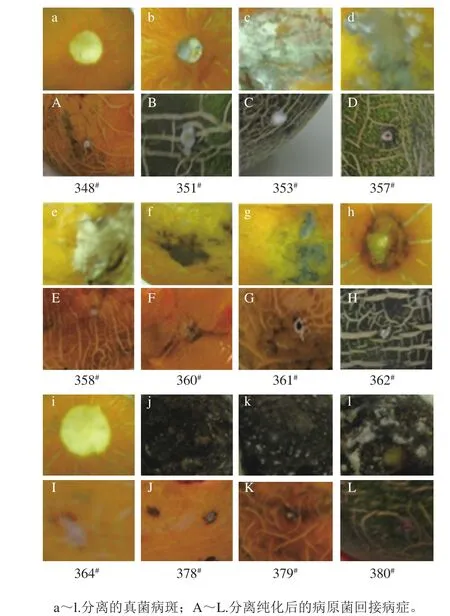
图1 12 株丝状真菌分离与回接病症Fig. 1 Symptoms of infected and reinoculated fruits with twelve strains of fi lamentous fungi
2.2 病原菌的形态观察
2.2.1 菌落形态
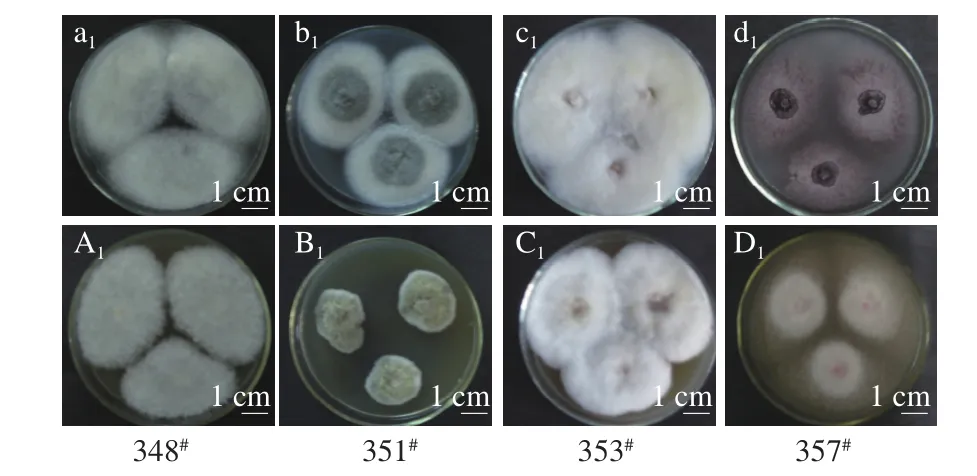
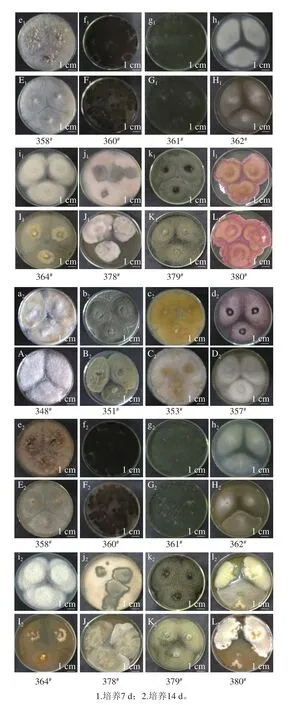
图2 12 株华莱士瓜采后丝状病原真菌分别在PDA(a~l)和ME培养基(A~L)上25 ℃培养7 d和14 d的菌落特征Fig. 2 Colony growth of twelve strains of fi lamentous fungi cultured on ME and PDA plates at 25 ℃ for 7 or 14 d
由图2可知,12 株丝状真菌在PDA培养基上长势均很旺盛,7 d时基本长满板。在ME培养基上351#和378#长势较其他10 株菌弱,14 d时还未长满板,而其他菌株7 d时基本铺满板。其中,菌株348#在PDA和ME培养基上培养7 d后的菌落形态一致,菌落质地紧密且菌丝较长呈白色绒毛状,培养14 d后菌丝变得更加紧密并分布在板上的面积增大(图2a1、A1和图2a2、A2);菌株351#在PDA培养基上7 d后近满板,菌落质地紧密且菌丝较短,圆心周围是绿色外延菌丝呈白色,而在ME培养基不到1/2板、浅绿色,14 d后分布在板上的面积均增大,在PDA培养基上菌丝颜色变为灰色,在ME培养基上菌丝绿色加深(图2b1、B1和图2b2、B2)。菌株353#在两种培养基上培养7 d后都接近长满板,但在PDA培养基生长较快,菌落质地紧密且菌丝较长呈雪白色,14 d后分布在板上的面积均增大、菌丝颜色变黄,但在PDA培养基上更明显的变为橙黄色(图2c1、C1和图2c2、C2);菌株357#在PDA和ME培养基培养7 d后菌落质地紧密且菌丝较长,呈天鹅绒状,PDA培养基上菌丝呈酒红褐色,而ME培养基上菌丝呈半透明的白色,14 d后菌丝颜色均加深并分布在板上的面积增大(图2d1、D1和图2d2、D2);菌株358#在PDA和ME培养基上培养7 d后,长满板,菌落形态一致,菌落质地紧密且菌丝较短,PDA培养基上菌丝略有黄色分泌物,14 d后,菌丝颜色均加深略有变黄并分布在板上的面积增大(图2e1、E1和图2e2、E2);菌株360#在PDA和ME培养基上培养7 d后近满板,菌落形态一致,菌落质地紧密且菌丝较短,整体呈黑色,但在PDA上生长较ME培养基上快且颜色更深,14 d后,菌丝颜色均加深并分布在板上的面积增大(图2f1、F1和图2f2、F2);菌株361#在PDA和ME培养基上培养7 d后,长满板,菌落形态一致,菌落质地紧密且菌丝较短,整体呈深绿色,14 d后,无明显变化(图2g1、G1和图2g2、G2);菌株362#在PDA和ME培养基上培养7 d后,近满板,菌落质地紧密且菌丝较长,在PDA板上呈乳白色而在ME板上呈半透明的白色,14 d后,无明显变化(图2h1、H1和图2h2、H2);菌株364#在PDA培养基培养7 d后,上菌落质地松散,外观干燥,不透明,呈绒毛状,而在ME培养基上的菌落直径较大质地紧密紧贴培养基表层,中心为白色丝状菌丝圈,14 d后菌落向培养基周围均匀伸展,ME培养基颜色加深(图2i1、I1和图2i2、I2);菌株378#培养7 d后,在PDA培养基上长满板且中间出现灰褐色凸起,边缘清晰,菌丝呈白色绒毛状;在ME培养基上长满2/3板,14 d后,在两种培养基上,菌丝颜色均加深并分布在板上的面积增大(图2j1、J1和图2j2、J2)。菌株379#培养7 d后,菌落圆形,质地紧密,外观干燥,不透明,呈绒毛状,菌丝渗透在培养基表面浅层,整体呈灰绿色,中央灰褐色,14 d后,菌落转为灰褐色,长满板(图2k1、K1和图2k2、K2)。菌株380#生长较慢,在PDA培养基和ME培养基上培养7 d后菌丝均长到2/3平板,PDA培养基上菌落呈粉红色绒毛状,ME培养基上菌落质地紧密白色绒毛状,而14 d后菌丝颜色均加深并分布在板上的面积增大(图2l1、L1和图2l2、L2)。
2.2.2 显微形态
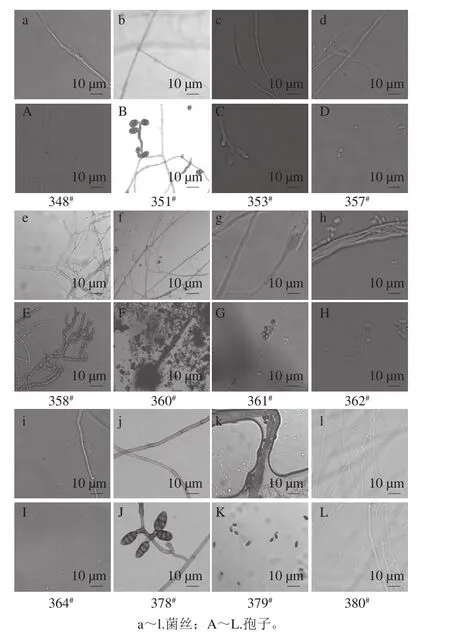
图3 12 株丝状真菌的显微形态观察Fig. 3 Morphological characteristics of twelve strains of fi lamentous fungi
由图3个体形态观察结果表明,在PDA培养基上25 ℃培养14 d,12 株菌的显微形态各异。菌株348#在PDA培养基上不产孢,菌丝着色较浅,分枝多且内部隔膜观察不明显(图3a、A)。菌株351#菌丝着色较深,分枝多且内部隔膜观察明显;分生孢子呈倒棒状,顶端延长呈喙状,淡褐色,有壁砖状分隔,暗褐色,成链生长,孢子的形态及大小规律(图3b、B)。菌株353#菌丝着色较浅,分枝多且内部隔膜观察不明显,分生孢子梗从菌丝垂直生出,顶端生排列成角状的间枝(图3c、C)。菌株357#在PDA培养基上不产孢,菌丝着色较浅,分枝多且内部隔膜观察明显(图3d、D)。菌株358#菌丝着色浅,有隔膜,分生孢子球形,呈串珠状,有瘤状凸起或有褶纹(图3e、E)。菌株360#菌丝着色较深,分枝多且内部隔膜观察明显,孢子梗直立,无隔,顶端膨大形成顶囊,分生孢子卵圆形,密生于顶囊之上(图3f、F)。菌株361#菌丝着色较浅,内部隔膜观察不明显,顶端生排列成帚状的间枝,分生孢子梗从菌丝垂直生出,有横隔,单个孢子球状、卵圆形或椭圆形(图3g、G)。菌株362#菌丝着色较浅,分枝多且内部隔膜观察明显,单个孢子椭球状(图3h、H)。菌株364#菌丝分枝较多且内部无隔膜,不产孢(图3i、I)。菌株378#菌丝着色较浅,分枝多且内部隔膜观察明显;分生孢子梗直立,分枝或不分枝,淡褐色至绿褐色,有屈曲,分生孢子形成孢子链,孢子有喙或无喙椭圆形表面光滑,淡榄褐色至深榄褐色,有横膈膜或纵横隔膜(图3j、J)。菌株379#菌丝着色较深,分生孢子单孢呈椭圆形(图3k、K)。菌株380#PDA培养基上不产孢,菌丝着色较浅,分枝多且内部隔膜观察明显(图3l、L)。
将上述12 株丝状真菌的菌落形态和显微形态的结果与文献[15]对丝状真菌菌落、菌丝和孢子的描述进行比较,菌株348#、353#、357#、364#和380#与镰刀属(Fusarium LK. ex Fr.)真菌形态一致,菌株351#和378#与链格孢属(Alternaria Nees ex Wallr.)真菌形态一致;菌株360#、362#和379#与曲霉属(Aspergillus Micheli ex Fr.)真菌形态一致,菌株358#与附球菌属(Epicoccum LK. Ex Wallr.)真菌形态一致,菌株361#与青霉属(Penicillium LK. ex Fries.)真菌形态一致。
2.3 构建ITS区rDNA系统进化树分析
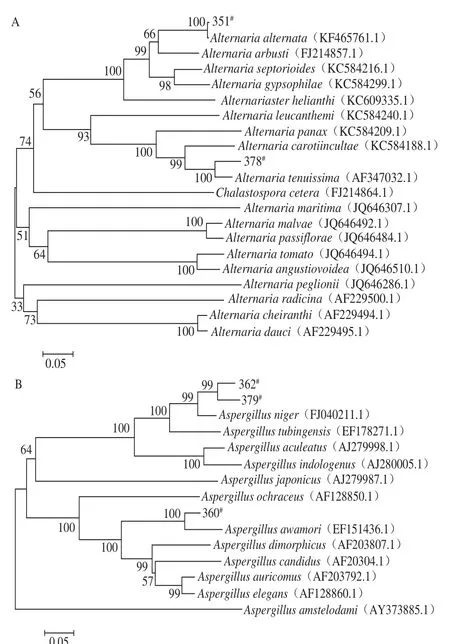
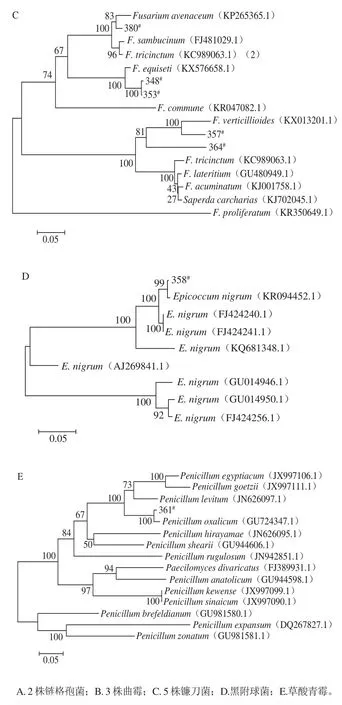
图4 以rDNA ITS基因序列为分子标记的华莱士瓜病原菌菌株的系统进化树Fig. 4 Positions of twelve strains in the phylogenetic tree built based on ITS rDNA sequence
将12 株华莱士瓜病原菌菌株的rDNA ITS测序结果在NCBI网站上进行比对,从GenBank数据库中搜索相似度达97%以上的同源序列,通过MEGA6软件Bootstraps功能计算目的菌株所在进化树各分枝的置信度,发现12 株病原真菌分别属于5 个不同的属,菌株348#、353#、357#、364#和380#为镰刀属真菌,其中348#和353#鉴定为木贼镰刀菌(F. equiseti),357#和364#鉴定为轮状镰刀菌(F. verticillioides),380#鉴定为燕麦镰刀菌(F. avenaceum);菌株351#和378#分别为链格孢属的互交链格孢菌(A. alternata)和细极链格孢菌(A. tenuissima);360#、362#和379#鉴定为曲霉属真菌,其中360#鉴定泡盛曲霉菌(A. awamori),362#和379#为黑曲霉菌(A. niger);而菌株358#和361#则分别为黑附球菌(E. nigrum)和草酸青霉菌(P. oxalicum)(图4)。
3 讨 论
微生物可分为细菌(原核生物)和真菌(包括酵母和霉菌,原核生物),不同微生物有不同的生存及繁殖方式;其中霉菌可以根据菌落形态,菌丝特征、是否产孢及孢子形态分为曲霉、灰霉和青霉等不同类别。而rDNA ITS区由于同时存在保守区和可变区,用于真菌鉴定既体现了进化过程中的遗传性的同时也体现了变异性,保守性强且变异有长度和序列的多态性,因此被广泛用于菌株鉴定。姚婷[16]和黄津津[17]等结合形态学和rDNA ITS区序列的结果,分别对樱桃果实上分离到的5 株病原菌和葡萄上分离到的10 株病原菌进行分类及鉴定。
本研究从华莱士瓜中分离的12 株病原菌大多数属于镰刀属、链格孢属和曲霉属的病原菌。据报道,粉红聚端孢霉(Cephalothecium roseum)和镰刀菌(Fusarium)是兰州甜瓜郁金香采后腐烂病的寄生性病原菌,而黑曲霉(A. nige)和青霉(Penicillium)是其腐生性病原菌[18]。梁宁等[19]从新疆哈密瓜上分离出Alternaria(50%)、Fusarium(20%)、Rhizopm(12%)、Colletotrichum(8%)、Trichothecium(5%)、Penicillium(1%~2%)、Botryt cinerea(1%~2%)7 个属病原真菌,其中链格孢菌(Alternaria)和镰刀菌(Fusarium)为哈密瓜采后优势致病菌,且易在高温下致病;娄恺等[20]也发现交链孢霉和镰刀菌是哈密瓜卡拉克赛的采后优势致腐病原菌。
本研究从采后贮藏期间华莱士瓜上分离到2 株链格孢属真菌,菌株351#为互交链格孢霉菌(A. alternata)与张辉等[21]报道一致,菌株378#为细极链格孢菌(A. tenuissima),该菌还可侵染枣、黑果梨和蓝莓[22-23]。类似的,本研究分离到的3 株曲霉属菌,该属真菌还可导致葡萄、石榴和苹果等果实腐烂[24-26],其中362#为黑曲霉菌(A. niger)这与李敏权等[3]报道一致,而菌株360#泡盛曲霉(A. awamori)为甜瓜上分离到曲霉属的新病原菌。国内外关于甜瓜镰刀菌侵染甜瓜的报道未作系统分类[27-29],而本研究从华莱士瓜上分离的5 株镰刀属菌,分别为348#和353#木贼镰刀菌(F. equiseti)、357#和364#轮状镰刀菌(F. verticillioides)、380#燕麦镰刀菌(F. avenaceum),均鲜见在甜瓜上分离到的报道。此外,从华莱士瓜上分离到的草酸青霉(P. oxalicum)是甜瓜上分离到青霉属的新种;黑附球菌(E. nigrum)可侵染采后脱水干瘪的葡萄果实[30],也可作为拮抗菌防治桃果实的褐腐病菌[31],但鲜见黑附球菌侵染华莱士瓜的相关报道。
4 结 论
从华莱士瓜上分离得到的12 株病原真菌,结合形态学特征及rDNA ITS区序列进化树分析鉴定为黑附球菌(E. nigrum)、草酸青霉(P. oxalicum)以及链格孢属(Alternaria Nees ex Wallr.)、曲霉属(Aspergillus Micheli ex Fr.)和镰刀菌属(Fusarium LK. ex Fr.)真菌。
首次关于细极链格孢菌(A. tenuissima)、泡盛曲霉(A. awamori)、木贼镰刀菌(F. equiseti)、轮状镰刀菌(F. verticillioides)、燕麦镰刀菌(F. avenaceum)和草酸青霉菌(P. oxalicum)在华莱士瓜上得到分离;黑附球菌(E. nigrum)为甜瓜采后贮藏期间首次分离到的病原真菌。
