麦胚降血糖肽的分离纯化及鉴定
2018-10-31江明珠朱胜虎聂旭东余永建张佳鑫贾俊强
颜 辉,张 琦,江明珠,朱胜虎,聂旭东,余永建,张佳鑫,贾俊强,熊 孟
(1.江苏科技大学生物技术学院,江苏 镇江 212018;2.江苏恒顺集团有限公司,江苏 镇江 212028)
小麦是世界范围内的主要粮食作物之一,2015年我国小麦的产量高达1.3亿 t[1]。小麦胚芽是面粉加工过程中的副产物,其中蛋白质质量分数为30%左右[2],具有很好的开发利用价值。近年来随着胚芽油产量的不断增加,如何高效利用的残留物“脱脂麦胚”成为亟待解决的难题[3]。
随着生活水平提高,人们摄入食物过多及运动减少,糖尿病的发生率逐渐增多。长期高血糖可导致心、脑、肾等重要器官的病变,重者威胁生命[4]。目前,临床上多为II型糖尿病,其中α-葡萄糖苷酶抑制剂是一类重要的降血糖药物,它能抑制小肠内多聚寡糖水解为单糖,导致单糖吸收量减少,从而实现降低血糖目的[5-6]。由于药物的副作用较大,因此寻找新型α-葡萄糖苷酶抑制剂已成为众多学者研究的热点。
近年来,多肽类α-葡萄糖苷酶抑制剂的研发引起了人们的重视[7-11],杂色蛤、山杏、丝素和蛋清蛋白经过酶解产生的多肽有抑制α-葡萄糖苷酶活性,起到辅助降低血糖的作用。但上述这些蛋白存在来源少、成本高等缺点,难以满足规模化工业生产需求。
前期研究发现,麦胚蛋白经胰蛋白酶酶解所得多肽具有抑制α-葡萄糖苷酶的作用,这为工业化生产具有降血糖作用的功能性多肽提供了思路。本实验以α-葡萄糖苷酶活性抑制率为评价指标,建立超滤、离子交换、凝胶阻排和反相高效液相色谱(reverse phasehigh performance liquid chromatography,RP-HPLC)分离纯化方法,并采用高效液相色谱-电喷雾-质谱(HPLC-electrospray ionization-mass spectrometry,HPLC-ESI-MS)鉴定出多肽的结构组成,阐明麦胚降血糖多肽发挥作用的物质基础,为开发麦胚降血糖肽提供理论基础。
1 材料与方法
1.1 材料与试剂
脱脂麦胚粉 河南省鲲华生物技术有限公司;对硝基苯酚-α-D-吡喃葡萄糖苷、4-氨基安替比林(均为分析纯),葡萄糖氧化酶(酶活力≥180 U/mg) 阿拉丁试剂(上海)有限公司;胰蛋白酶(1∶250,酶活力≥2 500 U/mg)、732型阳离子树脂、DA201-C大孔吸附树脂、711型阴离子交换树脂 国药集团(上海)化学试剂有限公司;葡聚糖凝胶(SephadexG-25和SephadexG-15型) 美国安玛西亚公司;乙腈、三氟乙酸(均为色谱纯) 美国Tedia天地试剂有限公司;ICR小鼠 江苏大学实验动物中心(合格证编号:NO.201600100)。
1.2 仪器与设备
LXQ型紫外检测器 上海康华生化仪器制造厂;HL-2B液相色谱离子阱-质谱联用仪 美国Thermo公司;Pellicon型小型超滤系统 美国Millipore公司。
1.3 方法
1.3.1 α-葡萄糖苷酶抑制率检测方法
参照Lee等[11]的方法检测,肽得率参照文献[12]方法。
1.3.2 麦胚蛋白的制备
采用酶法辅助的碱提酸沉提取麦胚蛋白[13]。100.0 g脱脂麦胚粉溶于1 000 mL蒸馏水中,1 mol/L Na2CO3溶液调pH 11,50 ℃间歇搅拌2 h,3 900 r/min离心15 min,取上清液,1 mol/L醋酸溶液调节pH 6.3,加α-淀粉酶(加酶量30 U/g),60 ℃水解1 h;1 mol/L醋酸溶液调pH 4.5,3 900 r/min离心15 min,取沉淀,冷冻干燥得麦胚蛋白。
1.3.3 麦胚降血糖多肽的制备
根据前期通过单因素和响应面试验获得的最佳条件制备麦胚降糖多肽。取50 mL 0.8%的麦胚蛋白,用功率60 W、频率65 kHz的超声波,48 ℃超声处理30 min,冷却至37 ℃,加胰蛋白酶(加酶量25 000 U/g)酶解,1 mol/L Na2CO3溶液维持pH 8左右,17 min后沸水浴10 min灭酶,待用。检测麦胚蛋白酶解前后对α-葡萄糖苷酶的抑制率。
1.3.4 麦胚降血糖肽对糖尿病模型小鼠血糖的影响
利用四氧嘧啶建立II型糖尿病高血糖模型小鼠,给予降血糖多肽干预,评估麦胚降多肽的降血糖效果[14]。
1.3.4.1 糖尿病小鼠模型的建立
ICR小鼠购自江苏大学实验动物中心,实验前小鼠适应环境1 周。分为4 组,每组6 只,雌雄各半,分别为正常组(A),模型组(B),正常+麦胚多肽干预组(C),模型+麦胚多肽干预组(D)。实验前禁食12 h(不禁水),B、D组尾静脉注射75 mg/kg 4%四氧嘧啶溶液(使用pH 4.5的0.1 mol/L柠檬酸缓冲液配制浓度,现用现配)[15],A、C组尾静脉注射等量生理盐水作为阴性对照。药物注射完毕,使用4%的葡萄糖溶液作为饮用水,防止小鼠低血糖。C、D组使用超滤后分子质量小于5 kDa多肽(3.24 mg/mL)灌胃给药,剂量48.6 mg/(kg•d)。A、B组灌胃等量的生理盐水,每间隔3 d取血检测血糖水平。
1.3.4.2 麦胚多肽降血糖效果的评价
以餐后血糖、体质量、采食量和饮水量作为指标,评价麦胚降血糖肽对糖尿病小鼠的效果。每隔1 周小鼠餐后1 h取血检测血糖,称体质量,并记录当天的采食量和饮水量,共2 周。
1.3.5 活性跟踪的分离纯化[16]
1.3.5.1 超滤
将酶解液8 000 r/min离心25 min,取上清液,0.45 μm滤膜(Whatman)初滤后进行超滤。设定温度为25 ℃,进口压力为20 psi,出口压力为10 psi,采用全回流的方式收集2 组分,分别为分子质量大于5 kDa的组分I和分子质量小于5 kDa的组分II。
1.3.5.2 离子交换吸附
选用DA201-C大孔吸附树脂、732阳离子交换树脂、711阴离子交换树脂进行离子交换吸附实验。
1)静态吸附:称取预处理过的树脂4.0 g于锥形瓶中,加入分子质量小于5 kDa的组分II(3.80 mg/mL)35 mL,室温振荡,每隔10 min取样分析多肽含量,直至达到交换平衡,计算麦胚降血糖肽的吸附率。2)动态吸附:准确称取已经预处理过的2 种树脂各2.0 g,装入交换柱中,取分子质量小于5 kDa的组分II(1.93 mg/mL),1.0 mL/min过柱,收集洗脱液,测定多肽浓度,计算不同时间内树脂对多肽的吸附率。3)吸附树脂解吸:将动态吸附实验结束的树脂,蒸馏水洗至中性,用乙醇洗脱DA201-C大孔树脂,用不同质量分数(0.5%、1.5%和2.5%)氨水洗脱732阳离子树脂,流速都为1.0 mL/min,计算解吸率。4)732型阳离子交换树脂纯化多肽:将处理好的732型阳离子树脂装入1 cm×40 cm玻璃柱,平衡后将超滤所得分子质量小于5 kDa的麦胚多肽II(1.93 mg/mL)上柱,流速1 mL/min,吸附完全后用蒸馏水1 mL/min冲洗,然后用最佳质量分数氨水洗脱,收集、浓缩洗脱峰,检测多肽浓度,测定对α-葡萄糖苷酶的抑制率。
1.3.5.3 凝胶分离纯化
首先用SephadexG-25凝胶分离麦胚降血糖肽。预处理凝胶,装柱(1 cm×40 cm),加入经离子交换后的多肽(20.0 mg/mL),上样量为凝胶床总体积的5%。蒸馏水洗脱,流速为1 mL/min,检测波长为220 nm,收集洗脱液。SephadexG-25分离后的高活性组分再用SephadexG-15凝胶分离纯化,实验方法与本方法相同。
1.3.5.4 RP-HPLC分离
SephadexG-15分离纯化所得到高活性部分进行RP-HPLC分离制备,并分峰收集。RP-HPLC条件:Agilent C18反相色谱分析柱(4.6 mm×250 mm,5 μm,孔径80 Å,比表面积:180 m²/g),流动相A 0.05%三氟乙酸(trifluoroacetic acid,TFA)溶液,流动相B乙腈(含有0.05% TFA),流动相A-流动相B(90∶10,V/V)。流速0.5 mL/min,进样体积10 μL(3.0 mg/mL)。多次重复,收集、合并分离峰,测定各峰的抑制活性,选取其中活性最高的组分进行HPLC-ESI-MS分析。
1.3.6 多肽结构鉴定
HPLC-ESI-MS进行多肽的结构鉴定。液相色谱条件:Thermo LXQ液相色谱离子阱质谱联用仪,Agilent C18反相色谱分析柱(4.6 mm×250 mm,5 μm),洗脱流速0.5 mL/min,进样体积10 μL(1.0 mg/mL),流动相A:超纯水(含有0.05% TFA),流动相B:乙腈(含有0.05% TFA),流动相A-流动相B(90∶10,V/V)。质谱条件: ESI正电荷模式,m/z范围50~2 000,MS/MS级数2 级,离子方式ESI+。
2 结果与分析
2.1 麦胚多肽的制备
麦胚蛋白对α-葡萄糖苷酶无抑制活性,经胰蛋白酶酶解,得到具有α-葡萄糖苷酶抑制活性的多肽,IC50为10.98 mg/mL。
2.2 麦胚降血糖肽实验高血糖模型小鼠的治疗效果
糖尿病动物血液中葡萄糖含量高,导致原尿渗透压升高,肾小管重吸收减小,尿液排出增加,同时伴随葡萄糖、无机盐、营养物质的排出,导致糖尿病动物的饮水量显著增加[17];糖尿病患者体内脂肪和蛋白质的分解增多,个体摄食量增加以补偿营养流失[18-19]。本实验中,造模组的实验小鼠出现明显的多尿、多饮、多食以及体质量下降的情况,此外还出现活动减少、精神萎靡、体毛松散等现象,表示造模成功。
2.2.1 麦胚多肽对糖尿病小鼠饮水量的影响

图1 麦胚多肽对糖尿病小鼠饮水量的影响Fig. 1 Effect of hypoglycemic peptides on water consumption in diabetic mice
如图1所示,造模后B、D组的小鼠饮水量和A组相比差异极显著(P<0.01),表明造模后小鼠饮水量急剧增加,糖尿病的多饮症状明显[20];灌胃麦胚多肽2 周后,D组与B组比较差异极显著(P<0.01),表明麦胚蛋白多肽可以缓解小鼠饮水量增多的症状,D组和A组比较有显著差异(P<0.01),提示麦胚蛋白治疗小鼠的多饮症状尚未恢复到正常水平。A组与C组比较无显著性差异,说明麦胚蛋白对正常小鼠的饮水量无影响作用。
2.2.2 麦胚多肽对糖尿病小鼠采食量的影响

图2 麦胚多肽对糖尿病小鼠采食量的影响Fig. 2 Effect of hypoglycemic peptides on feed intake in diabetic mice
如图2所示,造模后B、D组和A组比较,采食量差异极显著(P<0.01),表明造模后小鼠采食量大量增加。经麦胚治疗2 周后,D组采食量与B组差异极显著(P<0.01),提示麦胚多肽能够缓解小鼠采食量增多的症状;D组与A组比较有极显著差异(P<0.01),表明经麦胚多肽治疗的糖尿病小鼠的采食量尚未恢复到正常水平。C组和A组之间无显著差异(P>0.05),提示麦胚多肽对正常小鼠采食量无影响。
2.2.3 麦胚多肽对糖尿病小鼠体质量的影响
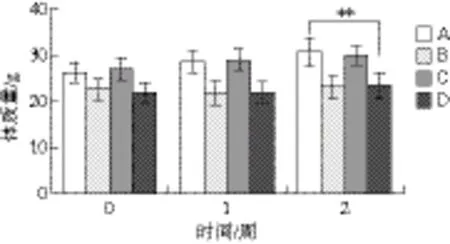
图3 麦胚多肽对糖尿病小鼠体质量的影响Fig. 3 Effect of hypoglycemic peptides on body mass in diabetic mice
如图3所示,造模后,小鼠体质量无显著性差异。随着时间的推移,正常小鼠(A、C组)体质量上升,B、D组小鼠体质量无增加。经麦胚治疗2 周后,D组小鼠体质量与正常组A比较有极显著差异(P<0.01),表明D组小鼠体质量未能够恢复到正常水平。A组与C组比较无显著性差异(P>0.05),提示麦胚多肽对正常小鼠的体质量无影响。B组与D组小鼠比较无显著性差异(P>0.05),表示经过15 d的麦胚多肽治疗,体质量未有明显变化。
2.2.4 麦胚多肽对糖尿病小鼠空腹血糖浓度的影响
如图4所示,B、D组与A组比较差异极显著(P<0.01),表明糖尿病模型小鼠的血糖高于正常小鼠,与Mckillop等[21]报道相近。经麦胚降血糖肽治疗2 周后,D组与B组比较有极显著差异(P<0.01),表明麦胚多肽对餐后血糖有明显降低作用;D组与A组比较有极显著性差异(P<0.01),表明尚未恢复到正常水平。A组与C组比较无显著性差异(P>0.05),提示麦胚多肽对正常小鼠的血糖无影响。
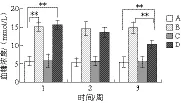
图4 麦胚多肽对糖尿病小鼠血糖的影响Fig. 4 Effect of hypoglycemic peptides on blood glucose in diabetic mice
通过以上的动物实验,表明麦胚多肽能够起到降低血糖的作用,治疗2 周内能够部分缓解多饮、多食和高血糖症状,对体质量无明显影响,长期效果需要更长时间的动物实验评价。
2.3 分离纯化
2.3.1 超滤
麦胚酶解多肽经过超滤后得到大于和小于5 kDa的两个组分,大于5 kDa的组分得率67.7%,IC50为14.33 mg/mL;小于5 kDa组分的多肽得率为32.3%,IC50为1.60 mg/mL。由此可见,活性成分主要在分子质量小于5 kDa组分中,对其进一步的分离。超滤后所得低分子质量组分的抑制率显著高于高分子质量组,原因在于对α-葡萄糖苷酶起抑制作用的主要物质是小分子多肽,这与文献[22-23]报道制备其他功能性多肽制备的结果相似。
2.3.2 离子交换吸附
2.3.2.1 静态吸附

图5 3 种树脂静态吸附曲线Fig. 5 Static adsorption curves of three resins for hypoglycemic peptides from wheat germ
分别使用732型阳离子交换树脂、DA201-C大孔吸附树脂和711型阴离子交换树脂对小于5 kDa的麦胚降血糖多肽进行静态吸附,如图5所示。随着时间的延长,711阴离子交换树脂吸附率几乎不变,且很低,表明对麦胚降血糖多肽的吸附作用很弱。732阳离子交换树脂的吸附率随着时间延长而增加,在60 min时达到最大值74.19%。DA201-C大孔吸附树脂在110 min时达到最大71.34%。因此732阳离子交换树脂达到最大值的速率较DA201-C大孔树脂快速,单就静态吸附率而言,732阳离子交换树脂与DA201-C大孔吸附树脂相似,因此采用这两种树脂进行后续实验。
2.3.2.2 动态吸附
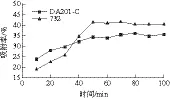
图6 2 种树脂对麦胚降血糖肽的动态吸附Fig. 6 Dynamic adsorption curves of two resins for hypoglycemic peptides from wheat germ
732型阳离子交换树脂和DA201-C大孔吸附树脂对小于5 kDa的麦胚降血糖多肽动态吸附实验结果如图6所示。在0~50 min之间吸附率不断上升,50~70 min趋于平衡,DA201-C大孔树脂最大吸附率为36.04%,732型阳离子树脂最大吸附率为41.25%,因此732阳离子交换树脂效果比较好,选用此树脂进行后续实验。
2.3.2.3 树脂解吸
在离子交换中,洗脱液中的pH值、离子强度会影响分离的效果。使用不同质量分数氨水洗脱动态吸附完全的732型阳离子交换树脂,以确定最佳的离子强度。随着氨水质量分数的增加,洗脱率显著上升,0.5%、1.5%和2.5%氨水的洗脱率分别为78.14%、86.81%和98.13%,表明2.5%氨水基本可将吸附的多肽完全洗脱,因此选择2.5%的氨水作为732型阳离子交换树脂洗脱剂。
2.3.2.4 732型阳离子交换树脂动态分离
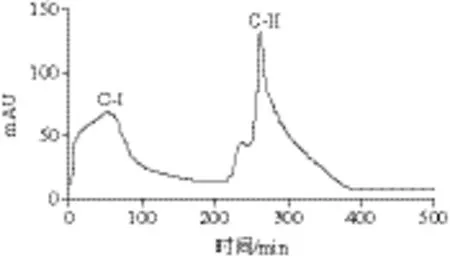
图7 离子交换洗脱图Fig. 7 Dynamic evaluation curve of 732 cation exchange resin
由图7可见,0~200 min是上样峰C-I,200~500 min是洗脱峰C-II。因此,经过732型阳离子交换树脂分离之后得到一个明显峰C-II,旋转蒸发浓缩后测IC50为0.30 mg/mL,对α-葡萄糖苷酶的活性比离子交换前(IC50为1.60 mg/mL)有显著提高,达到了纯化效果。Fang Yuwen等[24]报道丝胶水解多肽,过DEAE-纤维素柱,NaCl溶液洗脱收集的组分,抑制活性显著提高,IC50为41 μg/mL。
2.3.3 凝胶分离
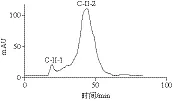
图8 SephadexG-25分离图谱Fig. 8 Separation chromatogram on SephadexG-25
如图8所示,分离得到2 个组分C-II-1、C-II-2,分别收集两个多肽峰,测其对α-葡萄糖苷酶的抑制率,C-II-2为高活性组分,IC50为0.16 mg/mL,因此,用葡聚糖凝胶SephadexG-15对组分C-II-2进一步纯化,结果见图9。C-II-2经SephadexG-15分离后得到2 个组分C-II-2.1和C-II-2.2。分别收集、浓缩,组分C-II-2.1为高活性组分,对α-葡萄糖苷酶的IC50为0.13 mg/mL。
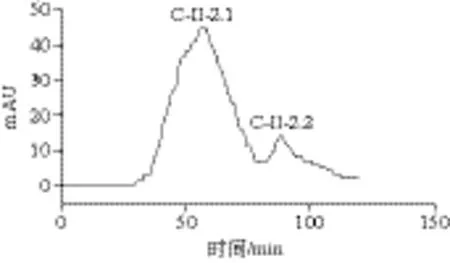
图9 SephadexG-15分离图谱Fig. 9 Separation chromatogram on SephadexG-15
2.3.4 RP-HPLC分离
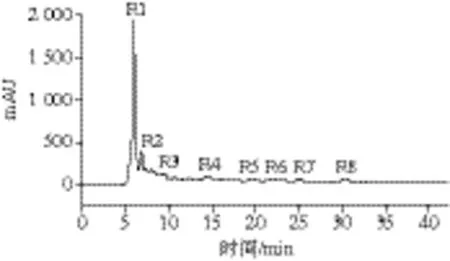
图10 C-II-2.1组分的RP-HPLC图Fig. 10 RP-HPLC chromatogram of C-II-2.1
C-II-2.1组分经RP-HPLC分析,结果如图10所示,色谱图中有8 个吸收峰,表示8 个(或组)多肽,命名为R1~R8,R1号峰所含多肽的IC50为0.098 mg/mL,其他组分测不出,由此可见R1号峰的活性最高;峰面积最大,提示组分含量也最大,因此,主要的降血糖肽在1号峰内。
2.4 多肽结构
质谱分析法是一种基于质荷比的分析方法,具有灵敏、准确和快速等优点。ESI-MS是一种鉴定微量多肽序列的有效工具[25],常与液相色谱、气相色谱等其他分离方法联用。本实验中多次重复收集RP-HPLC分离的1号峰,使用HPLC-ESI-MS对麦胚降血糖多肽的结构进行解析,结果如图11所示,出现1 个丰度较高的离子m/z 274.45,因此此离子对应的肽是最主要的物质,对此离子进行二级质谱解析。

图11 HPLC-ESI-MS联用的部分MS图谱Fig. 11 Mass spectrum
在ESI过程,分子因附加一个正电荷(H+)以离子[M+H]+的形式存在,通过磁场或电场根据m/z进行一级质谱(MS)鉴定,因此m/z为274.45的一级质谱片段,按照实际m/z为273.45片段值多肽组成序列进行分析。理论上多肽骨架断裂形成a1、b1、c1、a2、b2、c2、x1、y1、z1、x2、y2、z2等不同离子片段,在多肽序列分析中常用的片段为b1、y2、b2、y1等离子片段[26]。

图12 m/z 274.45的MS/MS二级质谱图Fig. 12 Tandem mass spectrum at m/z 274.45
如图12所示,Thr-Gly-Pro的计算值b1为102.18、y2为171.13、b2为114.08、y1为159.23,其中4 个离子均可以在图12中找到对应碎片,因此m/z 274.45的序列可能为Thr-Gly-Pro。Gly-Thr-Pro的计算值y2为215.16、b2为114.08、y1为159.23,除了b1的58.05因仪器质谱采集下限是65.00,因而无法判断,其余离子均可以在质谱图12中找到,因此其三肽序列可能为Gly-Thr-Pro。同理也可得到Ser-Pro-Ala、Pro-Ser-Ala、Ile-Ala-Ala、Leu-Ala-Ala为其可能的多肽序列。

表1 麦胚降血糖多肽的组成及结构Table 1 Structural identification of hypoglycemic peptides from wheat germ
不同的蛋白经酶解后,产生的具有α-葡萄糖苷酶抑制活性的多肽产物不同。Ren Yao等[27]从大麻种子蛋白酶解产物中分离鉴定出两种多肽有α-葡萄糖苷酶抑制活性,分别是二肽Leu-Arg(287.2 Da)和五肽Pro-Leu-Met-Leu-Pro(568.4 Da)。Lee等[11]从丝茧酶解产物中鉴定出两种具有α-葡萄糖苷酶抑制活性的三肽,分别为Gly-Glu-Tyr(mw367 Da) 和Gly-Tyr-Gly(mw295 Da)。Yu Zhipeng等[28]从白蛋白酶解产物中鉴定出一个五肽Lys-Leu-Pro-Gly-Phe(mw561.3 Da)。本实验中,通过HPLC-ESI-MS分析,麦胚降血糖多肽结果见表1,可能有7 种,其中二肽有1 种,三肽有6 种。虽然这7 种肽组成的混合有很高的α-葡萄糖苷酶抑制活性,但具体是哪一种发挥作用或哪几种共同起作用并不清楚,有待于进一步深入研究。此外,多肽除了可以抑制α-葡萄糖苷酶,还可能通过抑制氧化应激[29-30]、二肽基肽酶-IV[31]等发挥作用,多肽也可调节脂酯代谢,这对糖尿病的防治也起到积极作用[32]。因此,阐明多肽的作用机理,对于开发功能性降血糖多肽有重要的意义。本研究获得的酶解麦胚多肽在氨基酸组成与上述报道不同,因此是一种(或一组)新型的降血糖多肽。麦胚来源广泛,采用酶解方法可以很容易规模化制备功能性降血糖肽,对于促进麦胚的深加工、延长产业链有重要的促进作用,同时也给糖尿病患者提供新型功能性降血糖食品。
3 结 论
本研究结果表明,酶解麦胚多肽在体内外均有降血糖活性。通过分离纯化可以获得高活性的麦胚降血糖肽,具体的工艺流程是超滤、732型阳离子交换树脂进行离子交换吸附、葡萄糖凝胶SephadexG-25和SephadexG-15分离。采用HPLC-ESI-MS进行结构分析,鉴定出7 种多肽,其中二肽有1 种,三肽有6 种。起降血糖作用的是一种多肽或复合多肽,需要进一步深入研究。
本研究研究了高活性麦胚降血糖肽的制备工艺,鉴定了发挥功效的物质基础,对于促进麦胚资源的高效利用有重要意义,同时也给糖尿病患者带来福音。
