新型牛乳铁蛋白衍生肽KW-WK 的生物活性及其稳定性
2018-10-31王海梅李盈盈侯俊财姜成刚李东飞卢佳音赵悦含逄诗玥
王海梅,李盈盈,侯俊财,*,姜成刚,李东飞,卢佳音,赵悦含,逄诗玥
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150001)
抗生素的发现和应用为治疗感染性疾病提供了非常有效的途径,也促进了畜牧业快速发展。尽管目前抗生素治疗仍然是应对人类及动物微生物感染的首选方法,但是,由于人类长期滥用抗生素,导致其耐药性和药物残留等问题日益严重[1]。因此,研发出广谱高效、不易产生耐药性、低残留的新型抗菌剂成为目前的研究重点[2],而抗菌肽是最有可能的选择之一。抗菌肽是一类生物体中普遍存在并具有广谱抗微生物活性的小分子肽(10~50 个氨基酸),是天然免疫系统的重要组成部分,具有广谱抗菌性[3-4]。抗菌肽通过膜裂解机制抑杀细菌,不易产生耐药性,且组成它们的氨基酸经过新陈代谢被吸收利用,不易残留。但是,大多数天然抗菌肽体外活性不高,生产成本较高,对真核细胞有一定的毒性。为解决上述问题,对天然抗菌肽进行改造或人工设计无疑是最佳的选择。
牛乳铁蛋白肽(L f c i n B)来源于牛乳铁蛋白,是一种由2 5 个氨基酸残基(FKCRRWQWRMKKLGAPSITCVRRAF-NH2)组成的含有一个二硫键的环形抗菌肽。虽然LfcinB的抑菌性显著优于其他来源的乳铁蛋白肽,但是,与抗生素相比LfcinB的抑菌性还是不够理想。LfcinB的片段LfcinB18-28(KCRRWQWRMKK-NH2)仅含有11 个氨基酸残基,不仅保留其抑菌性,而且无溶血性,是抗菌肽分子设计的理想模板。因此,本研究借鉴小分子阳离子抗菌肽的设计理念,以LfcinB18-28为母肽,在保留其高电荷、高疏水性优点的基础上,依据对称结构的设计理念,引入氨基酸精氨酸(R)和色氨酸(W)替换,设计出同样含11 个氨基酸残基的新型牛乳铁蛋白衍生肽KWRRWQWRRWK-NH2(KW-WK),以期提高LfcinB18-28的抑菌性和稳定性、减少其毒性和溶血性,从而得到更有指导性的设计方法和更具有应用潜力的新型抗菌肽。
1 材料与方法
1.1 材料与试剂
抗菌肽KW-WK和LFcinB18-28均由上海吉尔(GL)生化有限公司合成,合成后经反向高效液相色谱仪纯化和电喷雾质谱仪鉴定,合成的肽用无菌蒸馏水溶解,使其浓度为2.56 mmol/L,-20 ℃保存备用。实验所用菌株大肠杆菌(Escherichia coli ATCC 25922)、大肠杆菌(E. coli UB1005)、金黄色葡萄球菌(Staphylococcus aureus ATCC 29213)、金黄色葡萄球菌(S. aureus ATCC 25923)、表皮葡萄球菌(S. epidermidis ATCC 12228)、单核细胞性李斯特菌(Listeria monocytogenes CMCC 54004)、鼠伤寒沙门菌(Salmonella typhimurium C 7 7-3 1)、鼠伤寒沙门菌(S. t y p h i m u r i u m ATCC14028)、鸡白痢沙门菌(S. typhimurium C79-13)、沙门菌(S. enterica subsp. enterica CMCC 50071),均为中国农业科学院哈尔滨兽医研究所保存。实验所用人肾上皮293细胞由中国农业科学院哈尔滨兽医研究所保存。胃蛋白酶、木瓜蛋白酶、胰蛋白酶、蛋白酶K美国Sigma公司;噻唑蓝(thiazolylblue,MTT)、三氟乙醇(trifluoroethanol,TFE)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 美国Biosharp公司。
1.2 仪器与设备
VD-1320型超净工作台 北京东联哈尔仪器制造有限公司;721型可见分光光度计 上海元析仪器有限公司;ZHWY-211D摇床振荡培养箱 上海智城分析仪器制造有限公司;XMTD-4000电热恒温水浴锅 北京市永元明医疗仪器厂。
1.3 方法
1.3.1 分子特性的预测
抗菌肽的理论分子质量和净电荷通过http://web.expasy.org/compute_pi/预测,疏水性和疏水力矩通过http://heliquest.ipmc.cnrs.fr/预测。
1.3.2 二级结构的测定
抗菌肽KW-WK和LFcinB18-28的二级结构采用圆二色谱法进行测定[5]。将肽溶解在10 mmol/L磷酸盐缓冲溶液(phosphate buffer saline,PBS)、50% TFE溶液、30 mmol/L SDS溶液中,使其终浓度为60 μmol/L,分别模拟水环境、生物膜的疏水环境、带负电荷的原核细胞膜环境,然后用圆二色谱仪对样品溶液进行测定。
1.3.3 菌种的培养
将冻存于-20 ℃的待测菌株活化两代后,划线接种于琼脂培养基中,37 ℃培养18~20 h,挑取单菌落,接种于20 mL无菌肉汤培养基中,过夜培养后,按2%接种量接于10 mL新鲜肉汤培养基中,培养2~4 h,至菌体处于对数生长期,调整菌体浓度为1×105CFU/mL,备用。
1.3.4 抑菌活性的测定
参考Libardo等[6]的方法。在96 孔板中,采用2 倍系列梯度法用牛血清蛋白(albumin from bovine serum,BSA)溶液倍比稀释抗菌肽溶液,第1号孔中加10 μL待测肽溶液,90 μL BSA溶液,倍比稀释到第10号孔,并接入50 μL的菌液。第11号孔加菌液不加肽为阳性对照,第12号孔不加肽和菌液为阴性对照。37 ℃培养18~24 h,无肉眼可见菌体生长的最低浓度即为该肽的最小抑菌浓度(minimal inhibitory concentration,MIC)。
1.3.5 溶血活性的测定
参考Stark等[7]的方法。取1 mL人的新鲜血液,1 000×g离心10 min后,收集红细胞,用PBS洗涤3 次,然后用10 mL PBS重悬细胞。在96 孔板的前10 个孔中,用PBS将肽分别稀释为1.3.4节所述的浓度,并加入50 μL红细胞悬液。第11号孔加入50 μL红细胞悬液和50 μL 0.01% Triton X-100作为阳性对照,第12号孔加入50 μL的红细胞悬液和50 μL PBS作为阴性对照。37 ℃培养1 h后取出,4 ℃、1 000×g离心10 min,再将上清液转移到干净的96 孔板对应的孔中,用酶标仪于波长570 nm处测吸光度。按下式计算溶血率:
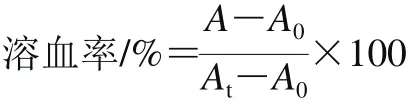
式中:A为抗菌肽样品处理组的吸光度;At为阳性对照组的吸光度;A0为阴性对照组的吸光度。
1.3.6 细胞毒性的测定
采用MTT法,MTT溶液和肾上皮293悬液的制备按照Schmidtchen等[8]的方法。按照1.3.4节方法稀释肽。第11号孔加细胞不加肽为阳性对照,第12号孔不加细胞和肽为阴性对照。37 ℃培养24 h,每孔加40 μL MTT溶液,培养4 h,加150 μL的二甲亚砜溶液,低速振荡10 min,用酶标仪测波长492 nm处的吸光度。
1.3.7 稳定性的测定
抗菌肽的稳定性测定主要包括热稳定性、盐稳定性、酶稳定性等。选取大肠杆菌ATCC 25922为实验菌株,未经高温、盐离子、蛋白酶等处理的抗菌肽为对照组。
1.3.7.1 热稳定性的测定
抗菌肽在100 ℃加热1 h,然后测定MIC。
1.3.7.2 盐稳定性的测定
分别配制7 种含不同盐离子(NaCl、KCl、NH4Cl、MgCl2、ZnCl2、CaCl2、FeCl3)浓度的MHB培养基,待高温灭菌后用该含盐培养基调整菌体浓度为1×105CFU/mL。然后,按照1.3.4节方法稀释抗菌肽,加入该含盐菌液,并使96 孔板中7 种盐离子的终浓度分别为NaCl 150 mmol/L、KCl 4.5 mmol/L、NH4Cl 6 μmol/L、MgCl21 mmol/L、ZnCl28 mmol/L、CaCl22.5 mmol/L、FeCl34 mmol/L,测定抗菌肽的MIC。
1.3.7.3 酶稳定性的测定
在37 ℃水浴条件下,用反应终质量浓度为1 mg/mL的胃蛋白酶、胰蛋白酶、木瓜蛋白酶、蛋白酶K溶液分别处理抗菌肽1 h,然后测定其MIC。
1.4 数据处理
每个待测样品均重复3 次,用Excel软件对原始数据进行处理,之后采用SPSS 17.0软件进行显著性分析,P<0.05,差异显著。
2 结果与分析
2.1 KW-WK和LFcinB18-28的分子特性

表1 KW-WK抗菌肽和LFcinB18-28的分子特性Table 1 Characterization of KW-WK peptide and LFcinB18-28
如表1所示,KW-WK和LFcinB18-28的实际分子质量(分别为1 171.13、1 605.2 Da)与理论分子质量(分别为1 172.1、1 605.9 Da)很接近,表明合成肽是所需要的目标肽。KW-WK较LFcinB18-28的净电荷和疏水性相差不大,但疏水力矩有了较大的提高,表明KW-WK的两亲性有了较大的增强。
2.2 KW-WK和LFcinB18-28的二级结构测定结果

图1 KW-WK(A)和LFcinB18-28(B)在10 mmol/L的PBS、50% TFE和30 mmol/L SDS溶液中的圆二色谱图Fig. 1 CD spectra of KW-WK (A) and LFcinB18-28 in (B) 10 mmol/L in sodium phosphate buffer, 50% TFE, or 30 mmol/L SDS
由图1可知,在PBS(模拟水环境)中,2 条肽在波长200 nm附近都呈现一个负的特征峰,这是蛋白质和多肽无规卷曲的典型特征[9]。在SDS溶液中,KW-WK在波长195 nm附近呈现出正的特征峰,在波长208 nm和222 nm处呈现出2 个负的特征峰,表明KW-WK在模拟细胞膜环境中,以α-螺旋结构存在[10-11]。LFcinB18-28在波长200 nm处有一个明显的负峰,说明其在SDS溶液中为无规卷曲结构;在TFE溶液中,LFcinB18-28在波长195~198 nm处出现了正的特征谱带,在波长217~218 nm处出现了一个负的特征肩峰谱带,这是β-折叠构象的典型图谱特征[3]。
2.3 抑菌活性测定结果

表2 KW-WK抗菌肽和LFcinB18-28的MICTable 2 MIC of KW-WK peptide and LFcinB18-28
由表2可知,KW-WK的MIC范围为4~128 μmol/L,GM为28.00 μmol/L。其对大肠杆菌ATCC 25922的抑菌性最强,M I C为4 μ m o l/L,而对沙门菌CMCC 50071的抑菌性最弱,MIC为128 μmol/L。母肽LFcinB18-28的抑菌效果较差,除了对大肠杆菌ATCC 25922的抑菌效果强之外,对其余8 株致病菌的MIC均大于64 µmol/L,GM为200.89 µmol/L。
2.4 溶血活性测定结果
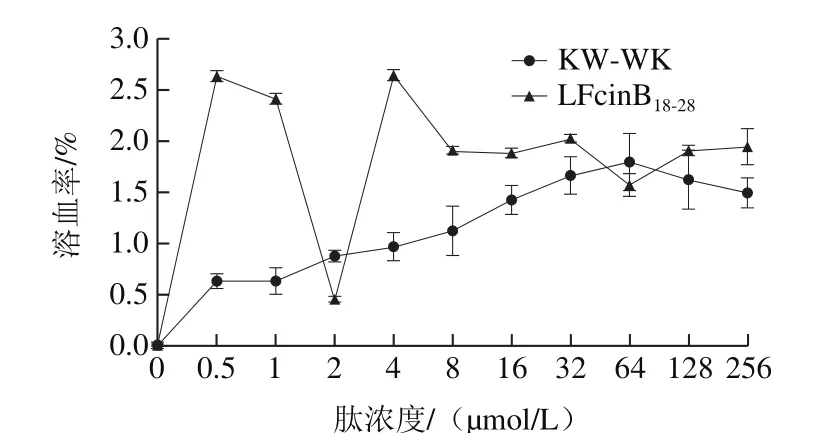
图2 KW-WK和LFcinB18-28的溶血活性Fig. 2 Hemolytic activities of KW-WK and LFcinB18-28
由图2可知,随着肽浓度的增加,KW-WK的溶血率呈先上升后下降的趋势,说明受试肽对红细胞的溶血率呈浓度依赖性。当肽浓度在1~256 µmol/L时,2 条肽对红细胞的溶血率始终都在5%以下,说明2 条肽的溶血性都很弱。
2.5 细胞毒性测定结果
由图3可知,当肽浓度在0.5~256 µmol/L之间时,KW-WK和LFcinB18-28对细胞存活率影响无显著差异(P>0.05)。当LFcinB18-28的浓度在1~64 µmol/L之间时,细胞的存活率在95%以上,当KW-WK的浓度在1~128 µmol/L之间时,细胞的存活率依然在95%以上,表明KW-WK和LFcinB18-28的细胞毒性都很小。
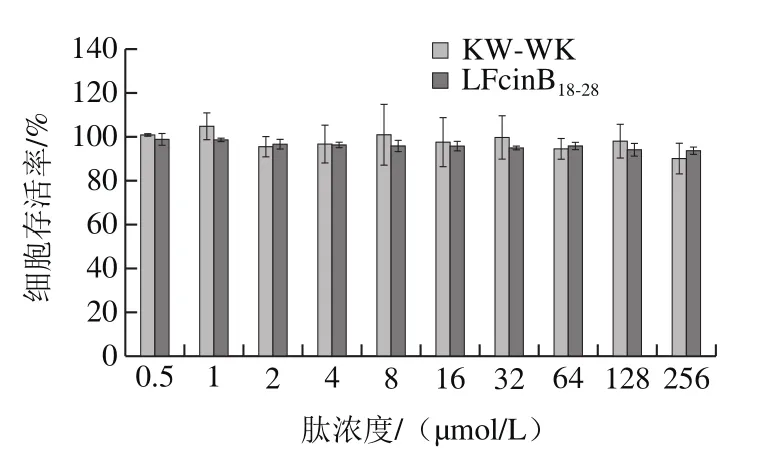
图3 KW-WK和LFcinB18-28的细胞毒性Fig. 3 Cytotoxicity of KW-WK and LFcinB18-28
2.6 稳定性测定结果
2.6.1 热稳定性

表3 热处理后KW-WK和LFcinB18-28的MICTable 3 MIC of KW-WK and LFcinB18-28 after heat treatment
由表3可知,KW-WK和LFcinB18-28经100 ℃处理1 h,MIC仍为4 μmol/L和16 μmol/L,说明2 条肽的稳定性不受高温影响。
2.6.2 盐稳定性

表4 盐溶液处理后KW-WK和LFcinB18-28的MICTable 4 MIC of KW-WK and LFcinB18-28 in the presence of salts
由表4可知,K+、Fe3+对KW-WK的抑菌活性没有影响,MIC仍为4 μmol/L;其他5种阳离子处理后的MIC为8 μmol/L,虽然比对照组的4 μmol/L略高,但依然保持较高的抑菌活性。Zn2+、Fe3+、NH4+能增强LFcinB18-28的抑菌活性,MIC从16 μmol/L降低到8 μmol/L或4 μmol/L,其他阳离子不影响LFcinB18-28的抑菌活性,MIC不变。从结果可以看出,2 条肽均具有较好的阳离子稳定性。
2.6.3 酶稳定性

表5 蛋白酶溶液处理后KW-WK和LFcinB18-28的MICTable 5 MIC of KW-WK and LFcinB18-28 after treatment with proteases
由表5可知,KW-WK经胰蛋白酶处理后,MIC由4 μmol/L增加为128 μmol/L以上,完全失活。经胃蛋白酶、木瓜蛋白酶和蛋白K酶处理后MIC分别为16、8 μmol/L和8 μmol/L,虽然有所升高但依然有较好的抑菌活性。4 种蛋白酶对LFcinB18-28的抑菌活性影响很大,处理后的LFcinB18-28的MIC均大于128 μmol/L,完全失活。
3 讨 论
大量研究表明,正电荷、疏水性和两亲性是决定抗菌肽生物活性的重要因素[12-13],母肽LFcinB18-28具有较高的电荷数(+6)和较强的疏水性(0.420),但两亲性相对较弱。精氨酸和色氨酸是高效抗菌肽的重要组成部分[14-15],精氨酸带有正电荷,能够有效地与细菌中带负电荷的成分(脂多糖、磷脂等)相互作用,从而能够较为牢靠的黏附在细菌细胞膜的表面[16];色氨酸侧链同时具有极性和疏水性,这使得色氨酸较易分布在亲疏水的界面处,有助于将抗菌肽锚定在细胞膜的表面[16]。一些研究表明,对称结构能显著提高抗菌肽的生物活性[17]。所以,本研究在LFcinB18-28高电荷、强疏水性的基础上,依据对称结构的设计理念,引入氨基酸(精氨酸、色氨酸)替换,增强了两亲性,成功设计出新型抗菌肽KW-WK。
大量研究表明,高效抗菌肽的二级结构,以α-螺旋最多[18-20]。本实验中2 条肽在PBS中都为无规卷曲结构;在SDS溶液中KW-WK呈α-螺旋结构,LFcinB18-28依然为无规卷曲结构;在TFE溶液中LFcinB18-28为β-折叠构象。这说明设计改造的抗菌肽KW-WK,在模拟细胞膜环境(SDS溶液)中会从无规卷曲转变成α-螺旋结构。α-螺旋中的亲水侧链和疏水侧链分别处于螺旋的两侧,这一特殊结构会促进生物膜和多肽片段相互作用。当抗菌肽与细菌的细胞膜结合时,α-螺旋会相互聚集,在细胞膜表面形成孔洞,造成细胞内容物外流,细胞死亡。所以,α-螺旋结构对抗菌肽的抑菌活性有积极的影响[21]。抑菌活性的实验结果表明KW-WK的抑菌活性远大于LFcinB18-28,这也在一定程度上证明α-螺旋结构能够增强抗菌肽的抑菌活性。LFcinB18-28为β-折叠抗菌肽,可能是因为氨基酸序列中含有一个半胱氨酸,半胱氨酸是形成β-折叠的必须氨基酸[22]
TI越大,表明抗菌剂的抗菌特异性越强,细胞选择性越好[23]。一般认为TI大于2.00为有效低毒,TI大于3.00有临床试用意义[24],常用抗生素S632A、诺西肽、利巴韦林的TI分别13.61、4.8、9.35[25-27]。由抑菌活性、溶血活性和细胞毒性的结果可知,KW-WK的TI(9.14)远大于LFcinB18-28的TI(1.28),说明KW-WK的细胞选择性较强,更适合作为抗生素替代品、食品防腐剂和饲料添加剂等。
抗菌肽应用于生产,要受到多种不稳定因素的影响,例如高温环境,人和动物口腔、胃、肠道内的蛋白酶,各种阳离子等方面[28]。因此,本实验从高温、盐离子、蛋白酶这3 个方面研究KW-WK和LFcinB18-28的稳定性。2 条肽经加热后的抑菌活性依然很高,这与之前报道的大部分抗菌肽具有良好的热稳定性相一致[11]。2 条肽对不同盐离子的稳定性不同,但整体的盐离子稳定性较好,Na+、Mg2+、Ca2+等会降低KW-WK的抑菌性,这可能是因为阳离子的结合位点是革兰阴性菌细胞膜上带负电荷的脂多糖,而阳离子抗菌肽也是通过静电作用与细菌细胞膜结合,两者是竞争关系[29]。因此,增强溶液中阳离子的浓度会抑制抗菌肽与细胞膜作用,从而使抑菌性降低。KW-WK经胰蛋白酶处理后的抑菌活性大大降低,受胃蛋白酶、木瓜蛋白酶、蛋白酶K的影响较小,这可能是由不同蛋白酶的酶切位点不同造成的。研究表明,胃蛋白酶的酶切位点是疏水性氨基酸或芳香族氨基酸[30]。木瓜蛋白酶属于巯基蛋白酶,作用位点是精氨酸、赖氨酸和甘氨酸结合的肽键[30]。蛋白酶K的酶切位点具有广泛特异性,倾向裂解脂肪族氨基酸残基[31]。蛋白酶的酶切位点是赖氨酸和精氨酸羧基端形成的肽键[32-33]。KW-WK含有赖氨酸和精氨酸,因此会被胰蛋白酶切断失活。LFcinB18-28经4 种蛋白酶处理后抑菌活性均丧失,说明LFcinB18-28具有4 种蛋白酶的酶切位点。
4 结 论
本研究在LFcinB18-28的高电荷、强疏水性的基础上,依据对称结构的设计理念成功设计出新型抗菌肽KWWK,结果表明,新型抗菌肽KW-WK比母肽具有更高的细胞选择性,抑菌性好,溶血性和细胞毒性低,热稳定性好,抗蛋白酶酶解的能力强。证明通过氨基酸替换、增强两亲性和对称结构等设计理念能明显改善抗菌肽
LFcinB18-28的生物活性,新型抗菌肽KW-WK具有作为抗生素替代品、食品防腐剂、饲料添加剂的巨大潜力。
