花青素对大豆蛋白体外胃消化结构的影响
2018-10-31江连洲李佳妮邹晓霜贾子璇王中江齐宝坤隋晓楠
江连洲,李佳妮,邹晓霜,胡 淼,贾子璇,王中江,齐宝坤,李 杨,隋晓楠*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
大豆蛋白是一种优质植物蛋白,属全价蛋白,富含近20 种氨基酸,是人类生存不可或缺的重要蛋白来源[1],8 种必需氨基酸含量高于联合国粮食及农业组织及世界卫生组织推荐比例,不含胆固醇,消化率及功效比近乎等同于动物蛋白[2-3]。大豆蛋白主要由β-伴大豆球蛋白及大豆球蛋白构成[3],β-伴球蛋白即7S球蛋白(180~210 kDa),主成分为α、α’及β亚基[4]。免疫印迹实验表明,7S球蛋白中α-亚基为引起机体过敏的主要致敏原,极易被过敏性皮炎病患的血清IgE抗体识别[5]。大豆球蛋白即11S球蛋白(340~375 kDa),主要由酸性及碱性亚基通过二硫键连接而成。其中,由于大豆分离蛋白(soybean protein isolates,SPI)具有蛋白含量高、功能特性突出等优点而成为食品工业生产中应用最多的一种大豆蛋白。SPI为氨基酸间相联结形成的具特定空间结构的生物大分子,分子构造较紧密,对酶解作用也有较强抗力[6]。
花青素为植物次生代谢产物,属类黄酮化合物,其基本结构为3,5,7-羟基-2-苯基苯并吡喃,大多数花青素在花色基元的3,5,7-碳位上有取代羟基[7]。花青素具有与蛋白质选择性结合的能力,包括氢键作用、疏水作用及静电吸附等。氢键的形成主要是通过花青素结构中的氢原子与蛋白质中的电负性离子结合;同时花青素中含疏水性基团,蛋白中存在疏水性氨基酸,因而两者也可通过疏水作用结合,花青素对蛋白的结合作用能够在一定程度改变蛋白结构功能及消化性等[8-9]。花青素在生理学中扮演重要角色,有助于预防多种疾病:包括癌症[10-11]、心脏病、关节炎和心血管疾病[12]等,同时具有抗炎与增强免疫力等高效生物活性[13]。
日常饮食中,大豆蛋白会同某些食物组分发生相互作用,从而影响蛋白的结构、营养、功能及消化特性等。经研究积累,现已对部分食用蛋白的酶降解情况、生物利用率有了较充分的认知,但对其在机体消化道环境中的消化情况却知之甚少,对蛋白在多食物组分体系影响下的消化特性研究更为匮乏。蛋白质对机体生命活动意义重大,其被消化吸收的程度,是衡量其营养价值的重要前提,因此从营养及经济学角度而言,明晰蛋白同其他食物组分互作对蛋白消化特性的影响具有重要意义[14]。
本实验将SPI与花青素以不同质量配比,采用体外消化模型模拟蛋白体外消化过程,通过研究各样品中蛋白水解率、结构、亚基组成及分子质量分布差异,阐明花青素添加量对蛋白消化特性及体外消化结构的影响。本实验通过深入探究机体在多食物组分下对蛋白消化、吸收的程度,全面深入评价及建立大豆蛋白营养消化模式,旨在为食品生产加工领域制备易消化、高吸收、低致敏的优质蛋白产品及营养膳食搭配方式提供理论指导,进而促进大豆蛋白产业发展。
1 材料与方法
1.1 材料与试剂
大豆 市售;黑米提取物 中国山西天之润生物科技有限公司;胃蛋白酶(3 250 U/mg) 美国Sigma公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒 中国Solarbio公司;甲酸、乙腈(均为色谱纯) 美国Sigma-Aldrich公司;正己烷、氢氧化钠、盐酸、甲醇、乙酸乙酯、磷酸氢二钠、磷酸二氢钠、氯化钾、磷酸二氢钾、碳酸氢钠、氯化钠、六水氯化镁、碳酸铵、氯化钙、三氯乙酸(trichloroacetic acid,TCA) 科密欧化学试剂有限公司。
1.2 仪器与设备
GL-25MS超速高速冷冻离心机 上海盛析仪器设备有限公司;FD5-3型冷冻干燥机 美国SIM公司;固相萃取装置 上海兴纳生物科技有限公司;旋转蒸发仪 上海恬恒仪器有限公司;WAT023635高效液相色谱仪、C18反向色谱柱(250 mm×4.6 mm,Sunfire)美国Waters公司;排阻色谱柱(300 mm×4.6 mm,Wilmington) 美国安捷伦科技有限公司;恒温水浴振荡摇床 常州恩培仪器制造有限公司;GelDoc XR System凝胶成像系统 美国伯乐公司;J-810圆二色谱仪 日本Jasco公司;F-4500型荧光光谱仪 日本Hitachi公司;PHS-25型酸度计 上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 SPI制备
参照Petruccelli等[15]的方法。大豆去皮粉碎,过60 目筛网后与正己烷1∶3(g/mL)比例混合脱脂,重复3 次,即得脱脂豆粉。将脱脂豆粉与水以1∶20(g/mL)比例混合,用2 mol/L NaOH溶液调pH 8.0,室温下充分搅拌2 h。搅拌后悬浊液于4 ℃、14 000×g离心20 min取上清液。用2 mol/L HCl溶液调节上清液pH 4.5,静置溶液2 h后以6 000×g离心20 min,取离心后沉淀用蒸馏水充分水洗3 次后,用2 mol/L NaOH溶液调节pH 7.0,样品-40 ℃预冻24 h后冷冻干燥,研磨即得SPI。
1.3.2 固相萃取提纯花青素
固相萃取提纯黑米提取物中花青素步骤参照Rodriguez-Saona等[16]的方法。将黑米提取物溶于去离子水后,减压抽滤。随后将滤液通过固相萃取柱使花青素被完全吸附,用5 倍柱体积0.01% HCl溶液洗脱样品中不溶性成分,如糖、酸等,随后用3 倍柱体积的乙酸乙酯溶液洗脱样品中除花青素外的多酚类杂质,如酚酸、黄酮等,最后用4 倍柱体积甲醇溶液洗脱吸附于柱上的花青素。采用旋转蒸发去除甲醇得到花青素提纯样品,溶于酸性水溶液中冷冻保存,采用高效液相色谱法确定纯化后花青素质量浓度及纯度。
1.3.3 花青素定量分析标准曲线绘制
准确量取矢车菊素-3-葡萄糖苷标品,将其溶解至1%盐酸甲醇溶液内,并经不同比例稀释成质量浓度分别为0.000 1、0.001、0.025、0.05、0.1 mg/mL的标液,将各质量浓度标液过0.45 μm滤膜,采用高效液相色谱进样分析,以各标液质量浓度为纵坐标,对应的峰面积为横坐标绘制标准曲线:y=1.32×10-8x-5.414×10-4,R2=0.997 8。线性回归分析表明,质量浓度与峰面积在0.000 1~0.1 mg/mL内有良好线性关系[17]。
1.3.4 高效液相色谱法定量花青素质量浓度
取纯化的花青素提取物过0.45 µm滤膜,利用C18色谱柱及高效液相色谱设备进行分析。流速1 mL/min,柱箱温度25 ℃,流动相A为5%甲酸,流动相B为100%乙腈。梯度洗脱:0~5 min 100% A; 20 min 90% A;40 min 87% A;44 min 80% A;50 min 75% A;55 min 0% A。进样量50 µL,检测器波长520 nm[18]。
1.3.5 SPI-花青素复合体系制备
依照Nagy等[19]研究方法稍作修改。将SPI充分溶解至0.01 mol/L磷酸缓冲液中(pH 7.4)配制成50 mg/mL SPI溶液,并将花青素按一定比例溶解于SPI溶液中,使花青素最终质量浓度分别为0.5、1 mg/mL和2.5 mg/mL。按一定质量比溶解于SPI溶液并于室温下混合搅拌2 h制成SPI-花青素复合体系。
1.3.6 体外模拟消化
体外模拟消化参考Minekus等[20]方法并稍作修改。将50 mL待消化样品混于37.5 mL模拟胃环境的电解质溶液中(含6.9 mmol/L KCl、0.9 mmol/L KH2PO4、25 mmol/L NaHCO3、47.2 mmol/L NaCl、0.1 mmol/L MgCl2(H2O)6、0.5 mmol/L (NH4)2CO3),并于电解液中加入25 μL 0.3 mol/L CaCl2溶液,精密量取一定体积1 mol/L HCl溶液调节混合液pH 2.3,并记录盐酸用量V(HCl),随后加入(4.475-V(HCl))mL蒸馏水,最后加入8 mL胃蛋白酶(25 000 U/mL),使最终消化液中蛋白酶达2 000 U/mL,上述样品及试剂在混合前均需在37 ℃条件下预热30 min。将配制好的混合液置于37 ℃水浴振荡摇床中进行胃部消化反应1.5 h,并实时监控pH值恒定。体外消化过程中,分别于第0、5、15、30、45、60、90分钟处进行抽样检测以探究消化产物的结构特征及蛋白解离机制,各消化终点处采用0.5 mol/L NaHCO3将消化液pH 7.0终止反应。消化液高速离心去除不溶性蛋白沉淀,取上清液,冷冻干燥,备用。
1.3.7 蛋白水解度测定
采用TCA沉淀法测定蛋白水解度。TCA属于典型蛋白沉淀剂之一,能够使大分子蛋白及较大肽段沉淀。随消化进行,蛋白的肽链被蛋白酶水解成大小不等的片段,此时在TCA中溶解指数增大。针对特定反应底物而言,TCA能够定性反映出蛋白水解程度,其溶解指数越大,代表被水解生成的短肽链越多。本实验以TCA可溶解性氮含量表征蛋白水解度,在各消化取样点处取消化液适量,随后立即与等体积10% TCA溶液混合以沉淀未消化的大分子质量蛋白。混合液静置10 min后于8 000×g离心15 min。采用微量凯氏定氮(N×6.25)测定沉淀及其他蛋白样品对应的氮含量。蛋白质水解度计算公式如下[21]:
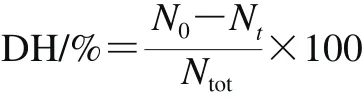
式中:DH为水解度/%;N0为消化前蛋白样品中TCA-沉淀氮含量/mg;Nt为消化t min后TCA-沉淀氮含量/mg;Ntot为蛋白样品中总氮含量/mg。
1.3.8 蛋白质亚基组成的测定
参考Laemmli等[22]的方法并稍加修改。将20 μL样品稀释后置于含β-巯基乙醇的2×上样缓冲液中,并于95 ℃加热90 s做变性处理。分别配制15%分离胶与5%浓缩胶,上样量为10 μL,电泳过程电压恒定,浓缩胶电压60 V,分离胶电压120 V。染色剂为0.25 g/L考马斯亮蓝R-250(0.25 g考马斯亮蓝R-250,400 mL甲醇、70 mL冰乙酸定容至1 L),电极液为14.41 g甘氨酸、3.03 g Tris、1.0 g SDS定容至1 L,脱色液A为甲醇-冰乙酸-水(40∶7∶53,V/V),脱色液B为甲醇-冰乙酸-水(5∶7∶88,V/V)。电泳胶片采用GelDoc XR System凝胶成像系统进行拍照分析。
1.3.9 体外模拟消化产物分子质量分布分析
利用体积排阻色谱-高效液相色谱法测定水解蛋白肽的分子质量分布。将经胃蛋白酶水解的蛋白离心分离取上清液,稀释后过0.45 μm滤膜。排阻色谱柱(300 mm×4.6 mm,2.7 µm);流动相:150 mmol/L磷酸盐缓冲液,pH 7.0;样品进样量10 μL,流动相流速0.3 mL/min,紫外检测波长220 nm,柱温25 ℃,运行样品30 min。相对分子质量校正曲线所用标准品:牛血清白蛋白(67 000 Da)、鸡白蛋白(44 000 Da)、核糖核酸酶(13 700 Da)、胰岛素(5 500 Da)、VB12(1 350 Da)。
1.3.10 蛋白空间构象测定
1.3.10.1 圆二色谱分析
以圆二色谱法测定样品中蛋白二级结构变化,将样品溶于0.01 mol/L磷酸缓冲液(pH 7.4)中稀释,使蛋白质量浓度为0.5 mg/mL。25 ℃、以100 nm/min扫描速率在190~260 nm范围内扫描,样品池光程1 mm,分辨率0.1 nm。采用“CDPro”曲线拟合软件对数据处理分析求得二级结构含量,每组样品重复测定3 次。
1.3.10.2 荧光光谱分析
参考江连洲等[23]方法并稍作修改。待测样品用0.01 mol/L磷酸盐缓冲液(pH 7.4)稀释,使样品蛋白质量浓度达到0.25 mg/mL[24]。荧光发射光谱分析时采用蛋白分子内色氨酸荧光基团作探针,激发波长290 nm,测定波长范围为300~450 nm,扫描速率240 nm/s,激发条带宽度10 nm,激发和发射狭缝均10 nm,每组样品重复测定3 次。
1.4 数据统计与分析
每组实验均重复3 次,结果表示为 ±s,使用Statistics 8进行ANOVA差异显著性分析(P<0.05为显著性差异)。采用Origin 8.5等软件对数据、图表进行处理分析。
2 结果与分析
2.1 纯化花青素质量浓度确定
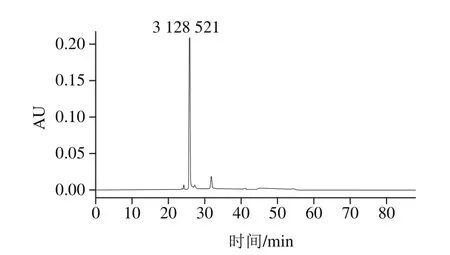
图1 纯化花青素色谱图Fig. 1 Chromatogram of purified anthocyanin
如图1所示,黑米提取物中花青素主成分为矢车菊素-3-葡萄糖苷,为方便计算,将矢车菊素-3-葡萄糖苷质量浓度视为花青素质量浓度做近似处理。根据标准曲线计算最终花青素纯度为(91.23±0.02)%,可认为纯品,相对分子质量按449.38计算。矢车菊素-3-葡萄糖苷峰[25]的保留时间为25.799 min,将该峰面积3 128 521代入标曲求得纯化后花青素质量浓度约为50 mg/mL。
2.2 SPI体外消化水解度
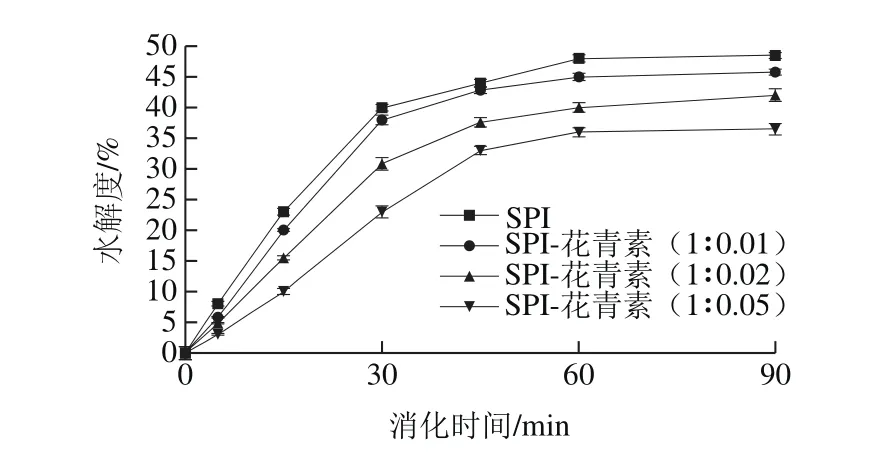
图2 添加不同质量花青素后SPI体外消化水解度Fig. 2 Change in TCA solbule nitrogen content during in vitro digestion of SPI with different concentrations of anthocyanin added
模拟胃液消化过程中,蛋白多肽被逐渐水解,蛋白水解程度显著,说明蛋白对胃蛋白酶较敏感。由图2可知,随消化时间延长,蛋白水解度逐渐增加,且在最初消化的30 min内水解度增加尤为显著,消化60 min后水解趋于稳定,这是样品底物质量浓度及酶活随反应进行而降低,复合物经初始阶段积累达到稳态,并趋于恒定等原因造成的[26]。研究表明,随样品中花青素质量增加,蛋白质消化率呈下降趋势,且花青素质量配比越大,蛋白水解受到的影响越大。空白组蛋白在经90 min消化后,水解度高达48.5%;SPI与花青素质量比为1∶0.01时蛋白最终水解度为45.8%,水解度降低不明显;质量比为1∶0.02时水解度为42%,但增加至1∶0.05的质量比时蛋白的水解度显著降低,仅有36.5%。这表明花青素的添加对蛋白消化具有一定不利影响,推测是由于SPI与花青素发生结合并使自身空间结构发生部分程度变化导致的。同时,花青素等多酚类物质还具有一定程度沉淀蛋白质的特性[27],由于SPI主要由球蛋白组成,这种蛋白质分子极性基团朝向外部,可以与极性水分子相互作用,添加花青素后,可能由于SPI的侧链氨基酸极性基团与花青素的酚羟基结合,导致蛋白质分子体系极性下降,溶解度降低。而蛋白质的溶解性又与其功能、加工及消化特性等息息相关,因此花青素对蛋白的沉淀性也是对蛋白水解度产生影响的因素之一。酚类化合物络合对蛋白水解度的影响与酚类化合物及蛋白种类和性质等多因素有关,两者互作对各自的影响也是一个相对复杂的过程。
2.3 SPI及其消化产物亚基组成分析
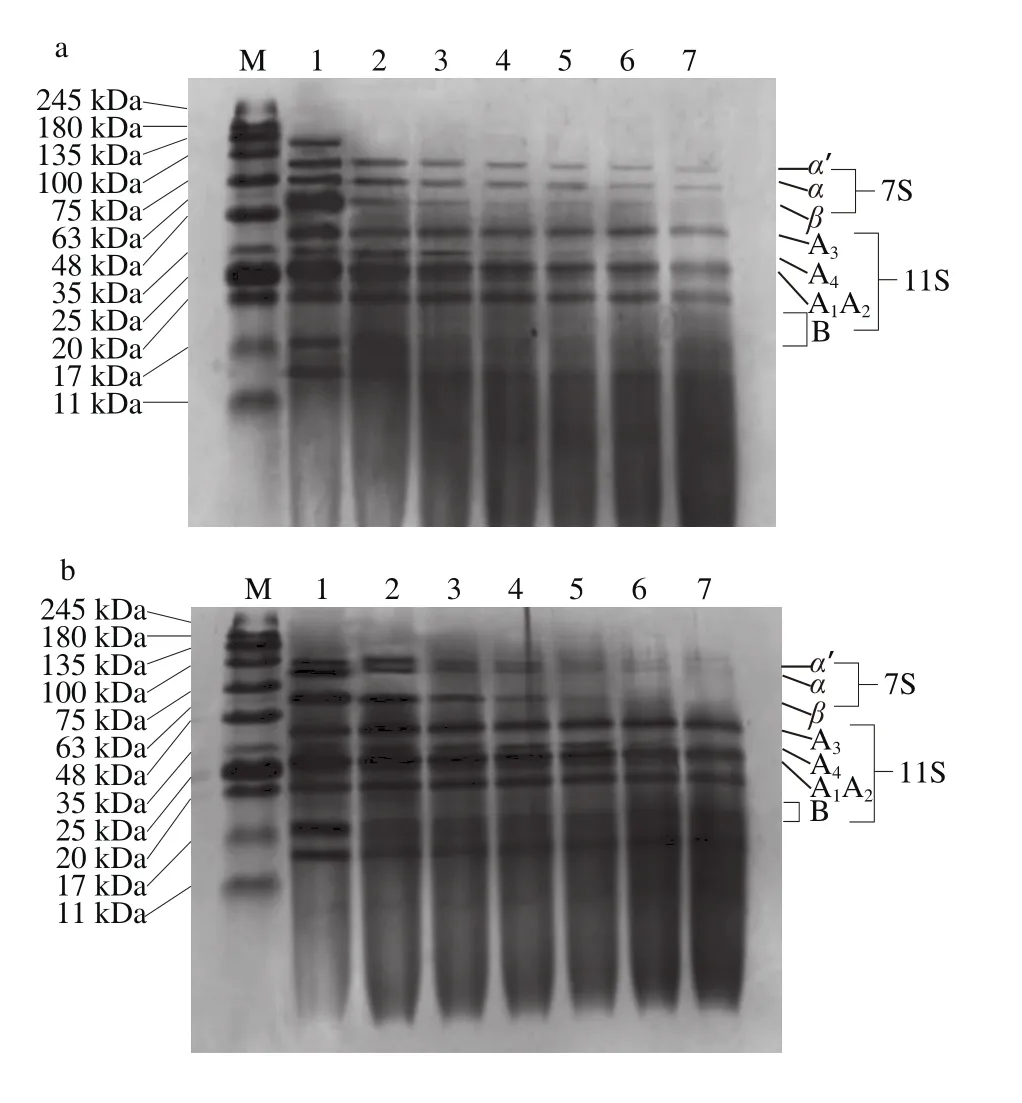

图3 SPI及SPI-花青素复合物中蛋白体外消化SDS-PAGE图谱Fig. 3 SDS-PAGE analysis of in vitro pepsin digests of SPI and SPI-anthocyanins complexs
如图3所示,添加不同质量花青素的蛋白样品中各组分受胃蛋白酶的降解情况有显著差别。4 组样品中的β-伴大豆球蛋白相较于大豆球蛋白更易于被胃蛋白酶酶解,且大豆球蛋白在经过连续90 min的消化后也仅有部分被酶解。除图3a样品外,其余样品经胃蛋白酶酶解60 min后,α’-亚基及α-亚基的电泳条带对应组分完全被消化降解,图3a样品在经过连续消化90 min后该处组分仍有部分未能被降解。针对大豆球蛋白而言,相对不易被消化,降解程度也较小,其A1~A4亚基及B亚基仅在图3a样品中有稍明显水解,从而降解为相对分子质量小于17 kDa的蛋白肽。而对另外3 组样品而言,大豆球蛋白的消化皆不明显。
SDS-PAGE显示,添加不同质量花青素的样品中蛋白消化程度具有较显著区别。对照组图3a中蛋白消化水解相对彻底,随着花青素添加量的增多,蛋白质整体消化程度逐渐降低,具体表现为花青素的添加促进了以α-亚基条带组分为代表的β-伴大豆球蛋白亚基的消化,但却显著抑制了大豆球蛋白中各亚基组分消化,且尤以图3d中花青素添加量为最大时对蛋白消化影响最为显著,这与图2中蛋白质水解度的测定结果相吻合。胃蛋白酶对不同蛋白组分的消化情形与其空间结构紧密相关,花青素的添加部分程度改变了蛋白质的二级、三级结构,最终使其添加对蛋白的水解消化产生了一定不利影响。
然而,即使花青素的添加部分程度的降低了蛋白水解度,但由图3可看出,花青素以上述任何比例添加进蛋白样品时,都能够有效促进7S球蛋白中α-亚基的水解,而据相关研究表明,α-亚基为大豆蛋白致使机体产生免疫反应的主致敏原之一[28],且经蛋白酶体外酶解可以部分去除该亚基组分[29],因而推测花青素对7S球蛋白消化的促进作用能够降低大豆蛋白致敏性,该结论对大豆蛋白相关产品的生产加工具有一定的积极作用。
2.4 SPI及其消化产物分子质量分布分析
因体积排阻色谱柱的填料凝胶含大量微孔,所以样品在经过体积排阻色谱柱时,仅其中分子质量较小的组分及缓冲溶液得以通过,进而使较大分子质量组分被阻挡于外部,因此样品在填料间隙内流动时较大分子质量组分首先被洗脱,小分子质量组分随后被洗脱[30]。
根据最小二乘法计算出该蛋白标曲回归方程:y=-2.002 6x+17.620,其中x为蛋白质分子质量对数,y为洗脱时间。利用该式即可根据蛋白样品的分子质量估算出对应组分的洗脱时间。各蛋白样品及消化产物分子质量分布如表1所示。
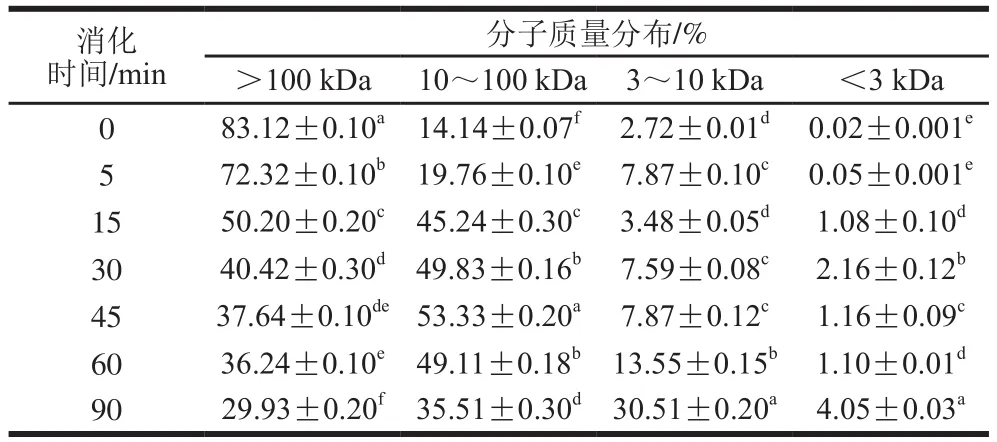
表1 未添加花青素的SPI消化产物分子质量分布Table 1 Molecular mas distribution of SPI hydrolysates
SPI主要是由7S和11S两种球蛋白组成,7S的分子质量范围在150~200 kDa,由3 个亚基组成,亚基的分子质量范围在42~83 kDa之间;11S的分子质量范围在300~380 kDa之间,由6 个亚基组成,每个亚基由一个酸性多肽和一个碱性多肽组成,多肽的分子质量范围在10~35 kDa之间。蛋白体外模拟消化进程中,分子质量变化是一个动态过程,蛋白由际水解为胨,最后被彻底水解为小分子肽。由表1可知,未水解的大豆蛋白分子质量主要集中在10 kDa以上,特别以分子质量高于100 kDa蛋白居多,比例高达83.12%。而此时,分子质量在3~10 kDa之间的小肽含量微乎其微。随消化进行,分子质量100 kDa以上蛋白比例逐渐减小,在消化至15~30 min时其含量大幅度降低,并于消化终点时比例降至29.93%。同时,分子质量分布为10~100 kDa的蛋白肽含量呈现出先增加后降低的趋势,这可能由于在消化初期,分子质量100 kDa以上蛋白逐渐被消化,致使分布为10~100 kDa的蛋白肽含量有所增加,随着消化反应进行,分布在10~100 kDa的蛋白肽也进一步被水解成更小的肽片段,而大于100 kDa以上蛋白随后水解的更为彻底造成的,这也使得3~10 kDa及小于3 kDa的蛋白肽含量有较为明显的上升。最终,蛋白消化产物的分子质量主要集中在3~100 kDa之间,这与SDS的分析结果一致。
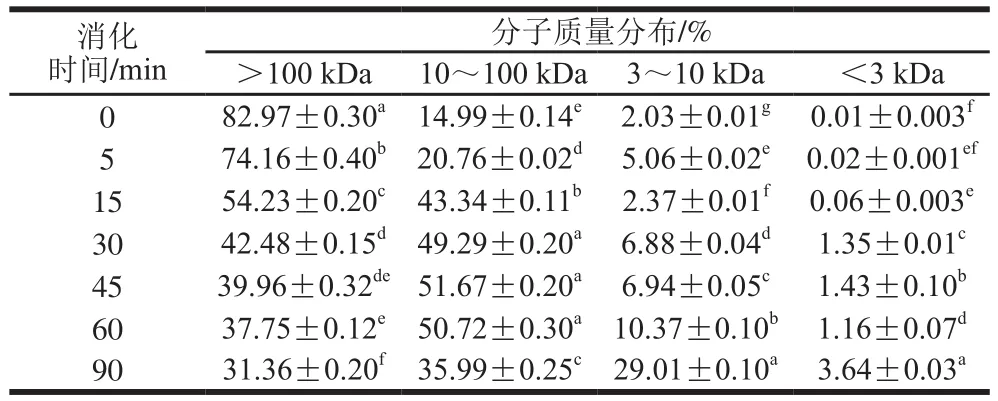
表2 SPI-花青素(1∶0.01)消化产物分子质量分布Table 2 Molecular mass distribution of hydrolysates of SPI-anthocyanin (1:0.01) complex
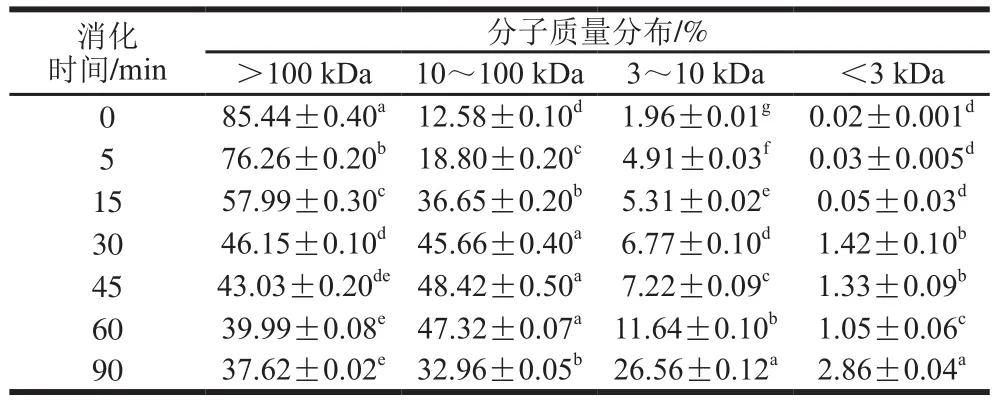
表3 SPI-花青素(1∶0.02)消化产物分子质量分布Table 3 Molecular mass distribution of hydrolysates of SPI-anthocyanin (1:0.02) complex
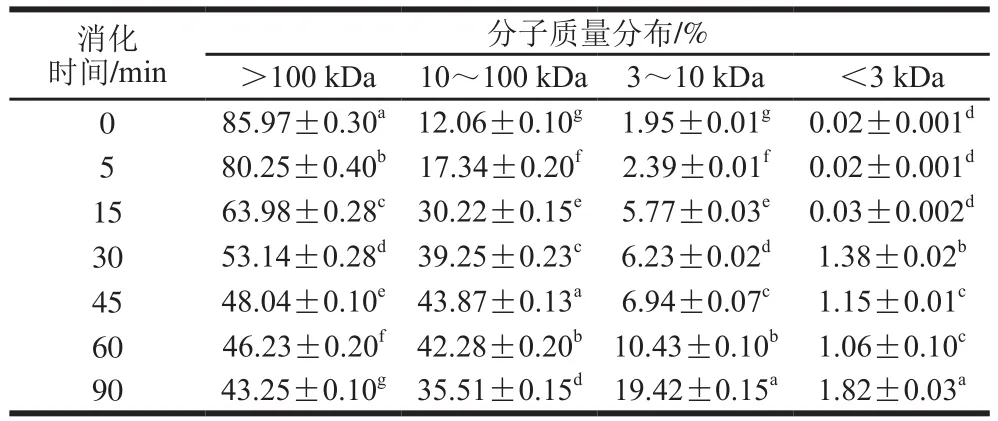
表4 SPI-花青素(1∶0.05)消化产物分子质量分布Table 4 Molecular mass distribution of hydrolysates of SPI-anthocyanin (1:0.05) complex
通过对表2~4与表1比较发现,在未消化的4 种样品中,蛋白质分子质量主要都集中在100 kDa以上,且所占比例相似。随消化时间延长,大于100 kDa的蛋白逐渐被消化,且消化均在30 min内较明显,但添加的花青素量越大,各消化时间点对应的消化产物中该分子质量蛋白所占比例的降低越不显著,这主要是由于花青素的添加,降低了蛋白水解程度。消化初期,各样品中低于10 kDa分子质量的蛋白肽含量均很少,随着反应进行,大分子质量蛋白逐级水解,消化终点处,空白组中10 kDa以下蛋白肽含量增加至35%,添加花青素的蛋白样品中其含量也有所增加,但消化最不明显的样品组其含量只增加至20%,同时各样品中蛋白肽分子质量多集中在3~10 kDa之间。10~100 kDa分子质量肽段均呈现先增加后减小的趋势,主要由于消化初期,高于100 kDa的蛋白初步水解成10~100 kDa分子质量肽段,而后期则是因100 kDa以上的蛋白及10~100 kDa分子质量多肽进一步水解使其含量降低,也因此使得更小分子的肽含量有所增加,但花青素添加量的增多,导致最终水解产生的小分子肽含量降低,这也是由于底物受花青素影响水解不够彻底造成的,这与SDS的分析结果也是相吻合的。
2.5 大豆蛋白及消化产物空间构象分析
2.5.1 SPI及消化产物圆二色谱分析
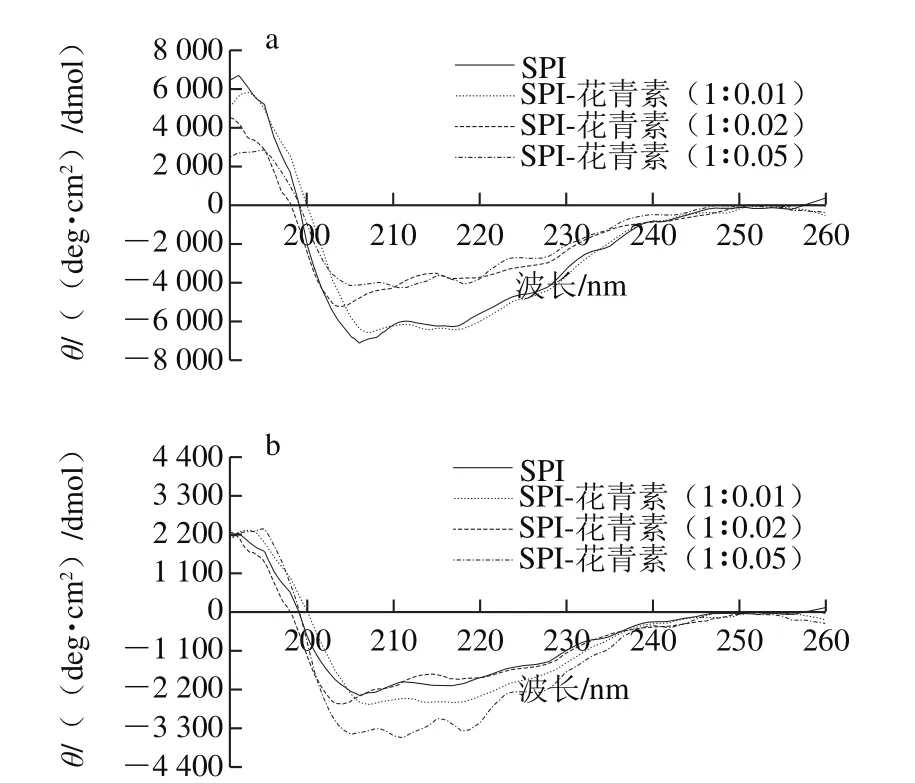
图4 未消化大豆蛋白(a)和体外模拟消化后大豆蛋白(b)样品的圆二色谱图Fig. 4 CD spectra of SPI (a), SPI-anthocyanin complexes and hydrolysates (b)
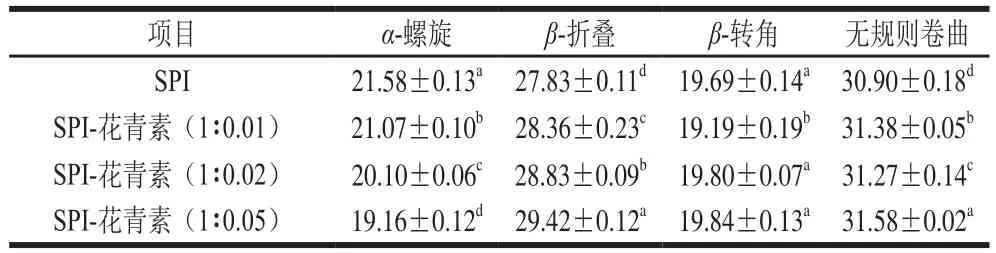
表5 圆二色谱测定天然及SPI-花青素复合物中大豆蛋白的二级结构含量Table 5 Secondary structure contents in SPI and SPI-anthocyanin complexes%
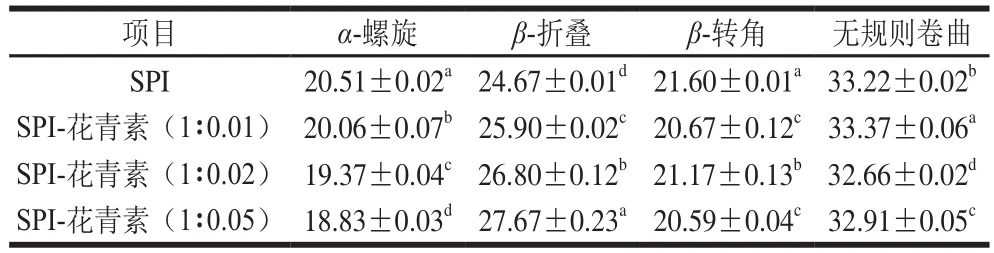
表6 圆二色谱测定不同质量比花青素复合的SPI消化产物二级结构含量Table 6 Secondary structure contents in digests of SPI and SPI-anthocyanin complexes%
圆二色谱是一种高效而精确定性定量分析蛋白二级结构的常用手段,能够在液体蛋白样品中进行直接测定[31]。本实验选择能够反映肽键圆二色性的远紫外区(190~260 nm)光谱条件,对天然及与花青素复合后的SPI经1.5 h体外模拟消化前后的蛋白样品进行圆二色谱分析。图4a为天然及与花青素复合后的蛋白圆二色谱图,图4b所示为体外模拟消化后大豆蛋白圆二色谱图,SPI与花青素复合后二级结构含量变化见表5,对应消化产物的二级结构变化见表6。在205 nm和217 nm波长处的摩尔椭圆度有两个最小值,在190~195 nm附近有一最大正值,该值为蛋白质α-螺旋的典型特征峰。图4a显示随着花青素添加量的增多,α-螺旋的典型特征峰逐渐降低,表明蛋白质二级结构发生了变化。图4b中在190~195 nm左右处的椭圆率显著降低,表明在消化过程中α-螺旋结构有较明显损失。同时,当蛋白水解时,217 nm波长处的椭圆率负值有所减少,这也表明蛋白二级结构被破坏[32]。由表6可知,SPI与花青素复合后,α-螺旋含量降低,β-折叠含量递增,β-转角含量高低浮动整体无明显变化,无规则卷曲含量升高,这些现象可能是由于花青素结合到了SPI α-螺旋中的某些氨基酸区域,进而蛋白分子部分展开,空间构象被改变所致,且该现象在花青素质量配比增大后更显著。谢凤英等[33]研究表明,多酚化合物的添加会使米糠蛋白的α-螺旋含量降低,β-折叠结构含量先升高后降低,而无规则卷曲结构的含量增加,这与本实验结果一致。同时,也有相关研究表明,绿原酸、阿魏酸与香豆酸(香豆酸)等酚类物质同α-乳白蛋白及β-乳球蛋白互作,能够降低α-螺旋含量,增加β-折叠和转角含量。天然及添加花青素的蛋白样品消化后,α-螺旋及β-折叠结构含量均降低,且花青素质量配比越大,消化后α-螺旋及β-折叠含量降低值越小,蛋白二级结构变化越不明显,推测是因各花青素与蛋白复合,可能在某种程度上影响蛋白酶解程度,使各酶解产物与对应未消化样品间的空间构象存在不同程度的差异。消化30 min时,α-螺旋及β-折叠含量降低较明显(表中未给出),表明两者的消化水解主要发生于反应初期,并推断α-螺旋和β-折叠结构的消化可能增加了无规卷曲的含量,各结构间可能存在相互转化关系。
2.5.2 SPI及消化产物荧光光谱分析
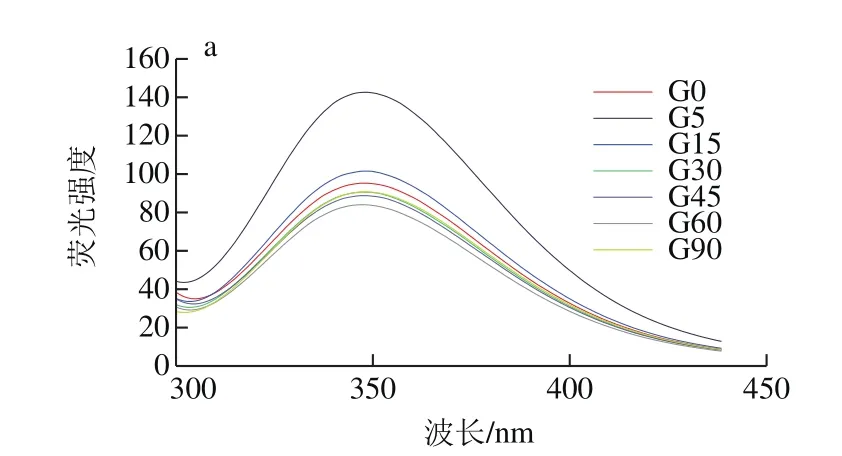
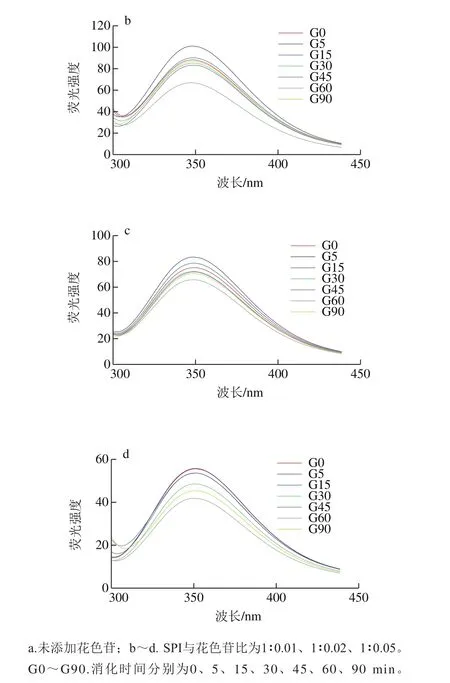
图5 同一蛋白样品不同消化时间荧光谱图Fig. 5 Fluorescence emission spectra of digested SPI samples at different periods
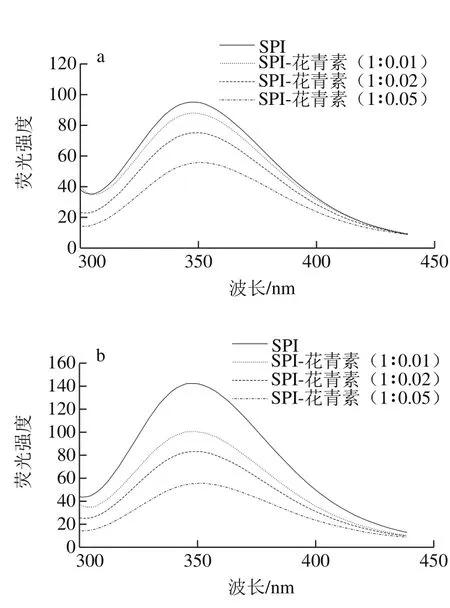
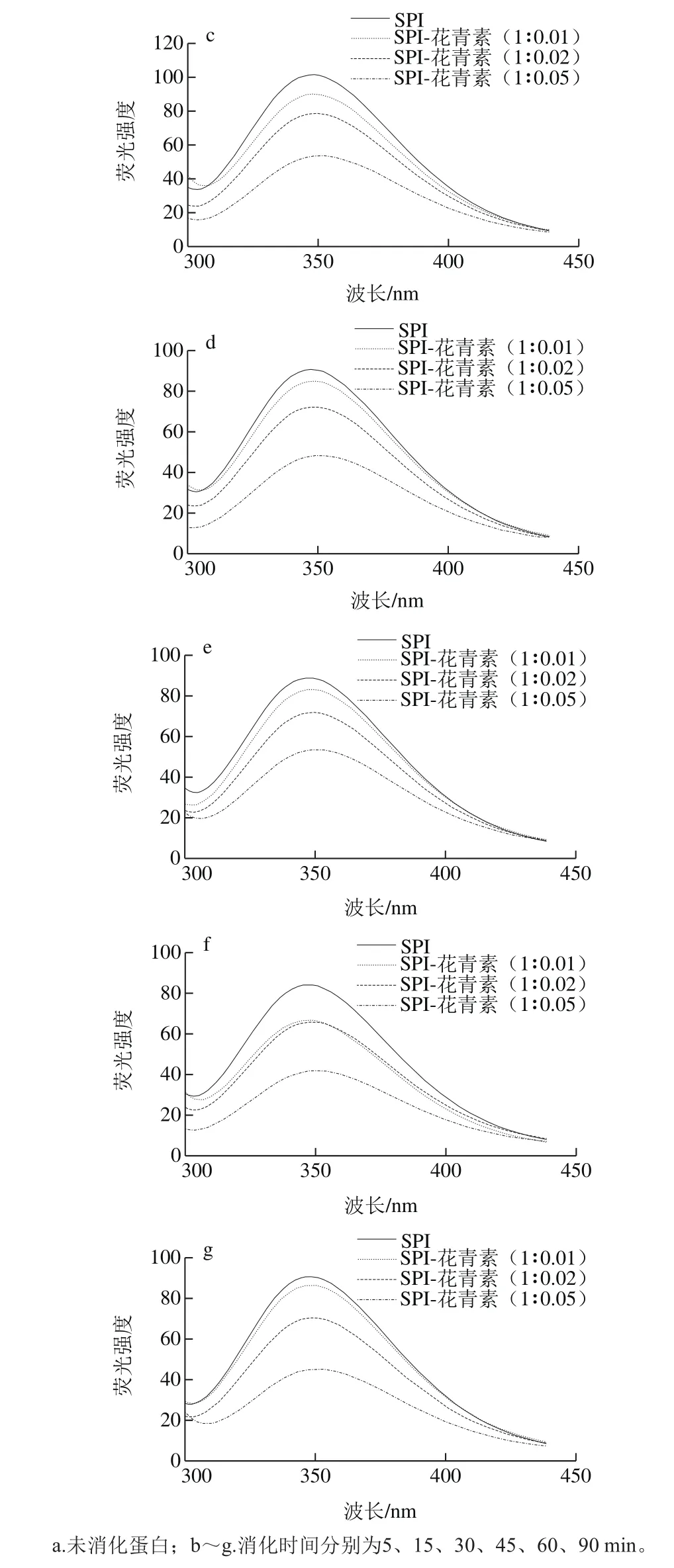
图6 不同蛋白样品同一消化时间荧光谱图Fig. 6 Fluorescence emission spectra of digested SPI-anthocyanin complexes at each period
蛋白质分子可解离的基团除氨基和羧基外,还有大量凸出的侧链基团,如组氨酸的咪唑,酪氨酸的羟基等。消化过程中蛋白质主侧结构解离与重聚的变化能够使蛋白质分子中可解离基团的电离情况发生变化,从而使蛋白质的空间结构发生改变。因此通过研究不同消化程度的消化产物中蛋白荧光性质变化,可以得出不同消化程度条件下大豆蛋白三级结构改变的信息。290 nm波长处激发产生的荧光光谱主要是由蛋白质分子中的色氨酸残基发射的,色氨酸残基是蛋白质的主要内源荧光源,通过记录色氨酸的荧光图谱,以反映色氨酸残基所处微环境变化情况,从而揭示出在不同体外模拟消化时间内花青素质量浓度对蛋白质三级结构的影响。
如图5所示,各样品的SPI在连续1.5 h的消化过程中,λmax均分布在346.6~350.6 nm内,且随消化时间延长,消化产物的λmax整体呈红移趋势,表明蛋白在消化过程中逐渐解离,蛋白分子内部的发色基团暴露在外部极性环境中;也有部分暴露于分子外部极性环境的色氨酸残基转向分子内部非极性环境中,蛋白质的三级结构发生了改变。由图6可知,未消化样品中,随花青素添加量增大,大豆蛋白最大荧光发射波长λmax发生红移,由346.2 nm偏移至350.2 nm,说明花青素与大豆蛋白发生了结合,从而改变了蛋白构象,色氨酸微环境发生改变,由疏水环境变为亲水环境,肽链结构舒展。任一相同消化点时,随花青素质量配比的增加,消化产物的λmax均逐渐发生红移,这与花青素质量配比增加,样品中—OH基团增多有关,同时,也是由于更多的色氨酸残基暴露在极性环境中及蛋白质结构的舒展导致[34]。
此外,花青素质量配比的增加会导致蛋白样品在任一相同消化时间点的蛋白荧光强度降低,特别是SPI与花色素质量比为1∶0.05时,这也说明蛋白质结构展开,花青素与色氨酸残基间发生了互作而削弱了SPI的荧光强度[34]。
3 结 论
体外模拟消化实验表明,随消化时间延长,大豆蛋白消化程度逐渐增加,且水解主要发生在消化前30 min。花青素的添加会降低蛋白质水解度,且花青素质量配比越大,抑制消化效果越明显。
采用SDS-PAGE对各蛋白样品及消化产物进行亚基组成分析,表明胃蛋白酶对蛋白各组分消化性能有较显著差异,7S较11S球蛋白更易被消化,花青素的添加抑制11S蛋白水解,却能够有效促进大豆蛋白主要致敏原α-亚基降解,推测花青素的添加可有效降低大豆蛋白食用致敏性。
利用排阻色谱分析蛋白样品及消化产物分子质量分布,结果表明,随消化反应的进行,大分子质量蛋白逐渐被水解成小分子肽,最终分子质量分布集中在3~100 kDa之间,同时花青素的添加使得最终消化产物分布在3 kDa以下的蛋白肽含量减少,这与SDS-PAGE分析结果一致。
圆二色谱分析结果表明,花青素改变了SPI构象,主要表现在α-螺旋结构含量降低,β-折叠含量增加,β-转角变化无明显规律,无规则卷曲含量增加,构象的变化对蛋白的消化过程及水解度产生一定程度影响,从而造成消化产物结构也被不同程度的改变。
荧光分析表明,蛋白及消化产物中,色氨酸残基分布于蛋白分子外极性环境中,且随花青素质量配比增加,消化产物的λmax逐渐红移。大豆蛋白在消化过程中逐渐被解离,荧光基团暴露于溶剂中,但花青素的添加对蛋白有显著荧光猝灭效果。
