年龄对血小板和淋巴细胞比值与冠心病关系的影响性研究
2018-10-31李秋敏林桂香王再生李元玲
李秋敏 刘 凯 林桂香 王再生 李元玲
心血管疾病(cardiovascular diseases,CVD)的发病率和病死率由于人口增长和老龄化而在世界范围内明显上升[1]。冠心病(coronary artery disease,CAD)是心血管疾病中最常见的一种形式,是一个重大的全球性健康问题,给经济带来很大负担[2]。适当的心血管疾病危险分层对临床决策的制定至关重要,至少可以平衡治疗方法的成本,风险和获益[3]。由于参与动脉粥样硬化进展的各种生物标志物,也参与复杂的斑块形成和破裂及疾病早期的生理和形态转变[4],所以CAD的生物标志物为预防疾病进展和有效治疗及减少并发症提供了一个窗口。血小板聚集和炎症反应是冠状动脉粥样硬化的病理生理学中的两个重要因素[5],炎症和血小板增多的一些生物标志物已经与CAD相关联。有研究显示[6]:高白细胞计数与缺血性心脏病预后不良有关;而中性粒细胞增加,淋巴细胞计数下降的患者预后相对较好,其中淋巴细胞减少被认为是CAD中慢性炎症后淋巴细胞凋亡的结果。在稳定性冠心病和急性冠状动脉事件之后的患者中,低淋巴细胞计数也与更高的病死率有关[7]。
血管内皮在长期炎症的刺激下,会引起巨核细胞系的增殖增加,血小板计数升高,而血小板计数升高与不良预后密切相关[8],还会引起血栓并发症和心血管病死率增加。尽管报道显示高血小板计数与CAD和心血管病死率的关联,但血小板计数通常随着年龄下降[9]。随着越来越多的人认识到低淋巴细胞和高血小板计数反映了动脉粥样硬化及其后遗症的进展,血小板与淋巴细胞比率(platelet-to-lymphocyte ratio, PLR)已经成为CAD的生物标志物和预后预测因子[10]。PLR检验价格便宜、简单易行,可用于心血管危险分层。这种新型标志物结合了血栓形成和炎症参数,并且可能比单独用血小板或淋巴细胞计数预测动脉粥样硬化斑块负荷和心血管结果更有价值。
基于此本研究探讨PLR和CAD之间的关系,而且这种关系是否有年龄依赖性。
资料与方法
1.入组对象 单中心横断面研究中收集了2015年3月至2017年3月期间,在海南省人民医院心血管内科、老年病科接受冠状动脉动脉造影检查的患者的临床,血管造影和检验数据。其中入组822例,排除标准为:肝炎或肝功能不全的患者(n=7),非黑色素瘤皮肤癌(n=26),活动性血液系统疾病(n=1),肾衰竭终末期(n=4),活动性感染(n=19),慢性炎症或自身免疫性疾病(n=43),全身抗感染或糖皮质激素药物使用(n=9)和入院时心源性休克(n=1)。
2.研究方案 对所有患者进行冠状动脉造影检查,并由1至2名经验丰富的介入性心脏病专家审查结果。根据美国心脏病学会/美国心脏协会(ACC / AHA)的指南:CAD被定义为直径> 2mm的任何主要冠状动脉的血管直径有50%或更多的狭窄或既往明确行经皮冠状动脉介入(PCI)。高血压定义为多次重复血压(BP)测量SBP≥140mmHg (1mmHg=0.133kPa)和/或DBP≥90mm Hg,或既往明确诊断高血压,长期服药治疗。脉压按收缩压和舒张压之间的差值计算。糖尿病的诊断根据《中国2型糖尿病防治指南(2013 年版)》,或既往明确诊断糖尿病,长期药物治疗。吸烟病例包括现在或既往有吸烟史的患者。根据国际糖尿病联盟的定义:中心性肥胖定义为BMI≥30kg / m2或男性腰围≥102cm,女性≥88cm。
静脉血样在入院时或冠状动脉造影前留取。通过自动细胞分析仪从乙二胺四乙酸(ETDA)管获得全血计数。从同一静脉穿刺的血清分离管自动分析血脂水平,肝功能测试,尿素,电解质和肌酸酐。通过将血小板计数除以淋巴细胞计数来计算PLR。
研究人群分为年龄在55岁以下(n=197)的年轻人和年龄在55岁以上(n=625)的年龄较大的人群。根据入院时或冠状动脉造影术前PLR值将所有研究对象分为两组,高PLR组≥146.7和低PLR组<146.7。该研究符合赫尔辛基宣言,所有参与者在参与之前签署书面知情同意书。
3.统计学分析 数据处理基于SPSS 21.0软件完成。Kolmogorov-Smirnov检验用于评估连续变量分布的正态性。正态分布计量资料以均数±标准差表示,非正态分布资料采用中位数(M)及四分位数间距(P25,P75)表示。两个年龄组之间的基线特征的差异比较:连续变量采用Wilcoxon秩和检验。分类数据以患者数量和百分比表示,采用卡方检验或Fisher’s精确检验。单因素和多因素Logistic回归分析评估PLR作为血管造影证实的CAD的预测因子。传统心血管危险因素包括在多元Logistic模型中。以P<0.05为差异有统计学意义。
结 果
入组822例患者,214例正常,经过冠状动脉造影确诊608例冠心病,其中70%为男性,年龄55~71岁,平均64岁。197例患者年龄在55岁以下,其中明确诊断CAD的有127例,正常对照组70例;625例患者年龄在55岁或以上,其中明确诊断CAD的有481例,正常对照组144例。

表1 研究人群的基线特征
注:ACEI/ARB:血管紧张素转换酶抑制剂/血管紧张素受体阻断剂;AMI:急性心肌梗死
1.基本临床特点 患者的基线特征见表1。两个年龄组在性别、肥胖状况和血脂异常方面具有可比性。与年轻患者相比,老年患者高血压患病率增加,脉压增大,糖尿病患病率高,糖化血红蛋白升高。他汀类药物、血管紧张素转换酶抑制剂(ACEI)和血管紧张素Ⅱ受体阻断剂(ARB)的使用率在老年组显著增加。
在血液学和生物化学参数中,年龄55岁以下患者的血小板计数,血肌酐高,高TG和低HDL-C与CAD相关。年龄≥55岁患者中,低淋巴细胞计数,高肌酐,高尿素,低HDL-C和低LDL-C与CAD相关,两组患者吸烟史均与CAD相关。
在年龄55岁以下患者中,CAD患者的PLR值(112.93±21.46)显著低于冠状动脉正常者[(126.3 ±21.88),P=0.022]。相比之下,入院时PLR在年龄≥55岁CAD患者(129.1±31.06)与对照组(122.3 ±26.49),差异无统计学意义(P=0.350)。
周围血管疾病(peripheral vascular disease,PVD)和中风的病史可能为PLR的混杂因素。然而,患有和不患有PVD的患者(年龄<55岁,P=0.092,年龄≥55岁,P=0.487)或脑卒中史(年龄<55岁,P=0.553,年龄≥55岁,P=0.643),这些在最终的回归模型中并没有包含在协变量中。
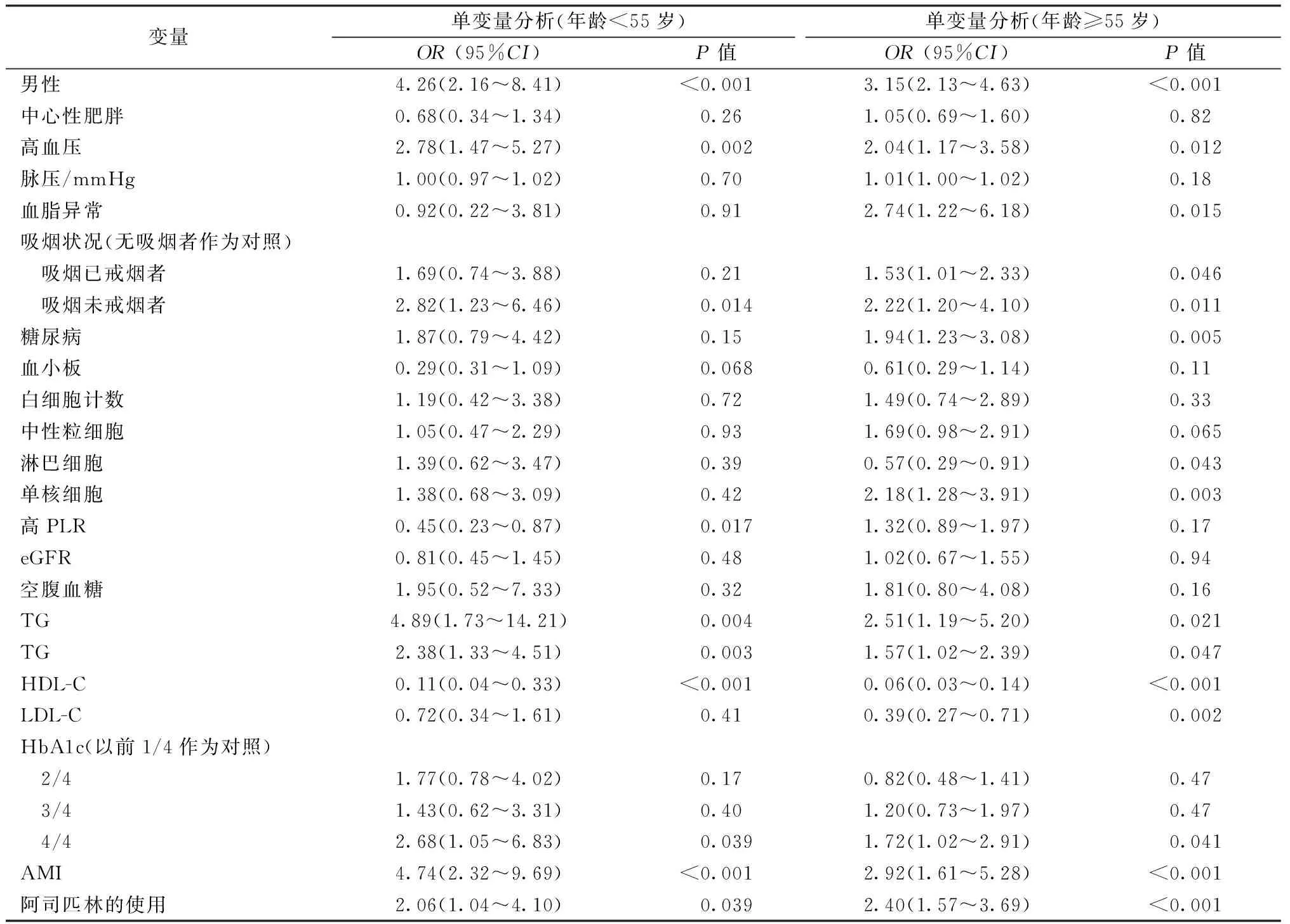
表2 单因素Logistic回归分析结果

表3 多因素Logistic回归分析

图1 按年龄分层的PLR三分位数的预测CAD发病率的边线图
2.55岁以下患者的临床特点 CAD和多个参数之间进行单因素Logistic回归分析(表2)。单因素Logistic回归分析显示,高PLR与早期CAD呈显著负相关(OR=0.45, 95%CI:0.23~0.87,P=0.017)。男性,高血压,吸烟史,HDL-C,LDL-C,TC,TG和HbAlc与早发冠心病显著相关。多因素Logistic回归模型对传统心脏危险因素和AMI进行校正(表3),评估CAD和PLR之间的独立关联。多变量回归分析显示,年轻患者PLR与早发CAD存在显著负相关(OR=0.31,95%CI:0.11~0.87,P=0.026,图1)。
3. 55岁以上患者的临床特点 在年龄较大的年龄组中,单因素回归分析显示男性,高血压,吸烟状况,HDL-C,LDL-C,TC,TG和HbA1c的相关性(表2)。虽然高PLR与CAD之间的单变量Logistic回归分析无相关(OR=1.32,95%CI:0.89~1.97,P=0.17),多因素分析回归模型显示高PLR与CAD呈正相关(OR=2.22,95%CI:1.28~3.82,P=0.004)(图1),是心血管危险因素。虽然糖尿病与早发CAD无关(OR=1.87,95%CI:0.79~4.42,P=0.15),但与老年患者CAD相关(OR=1.94 95%CI:1.23~3.08,P=0.005)。
讨 论
在这项研究中,我们发现入院时或冠状动脉造影术前PLR是年轻(年龄<55岁)和老年(年龄≥55岁)CAD患者的预测因子,是传统的心血管危险因素,也提供年龄调节PLR与CAD之间关系的证据。在55岁以上的患者中,入院时高PLR能增加CAD的危险;相反,高PLR与55岁以下患者的早发冠心病负相关。
在传统心血管危险因素的干预下,血管内皮会发生改变,并能促进炎症进展及血小板增多和动脉粥样硬化病变。一项研究[11]发现,85岁以上患者的高血小板计数与长期心血管病死率之间存在显著的相关性。而在动脉粥样硬化的慢性炎症过程中白细胞介素-6的释放能引起巨核细胞增殖和血小板水平升高和活化增强[12]。活化的血小板释放促炎因子并引起血栓形成再促进内皮损伤和斑块破裂,随后粘连聚集并和单核细胞一起迁移至动脉粥样硬化的内皮损伤部位[13]。除了引发动脉粥样硬化之外,还有研究显示血小板增多也是急性心肌梗死的诱因[14],而且血小板计数升高可以作为血栓形成和心血管死亡的预后价值判断指标[15]。血小板增多还可能对动脉粥样硬化本身进展的临床结局具有影响。
既往有研究提示淋巴细胞计数与CAD发病之间有相关性,淋巴细胞减少发生在动脉粥样硬化的慢性炎症之后,并且与主要的不良心血管事件相关[16]。急性冠状动脉事件中皮质醇的增加,作为生理应激反应的一部分,导致相对淋巴细胞浓度下降[17]。因此,淋巴细胞计数可以被看作是皮质醇产生的效应,可能是这种应激反应的早期标志物。PLR整合了血栓形成和炎症的预测风险,在预测冠状动脉粥样硬化并发症方面,可能比单独的血小板或淋巴细胞计数更有价值。
研究显示PLR与高SYNTAX和Gensini分数正相关[18]。在STEMI患者中,描述了PLR与梗塞相关的冠状动脉血管通畅性之间的独立关联[19]。同时PLR也是一个有用的预后指标。在各种研究中,高PLR与急性冠状动脉事件后心血管预后不良有关[20]。术前高PLR能预测STEMI患者PCI术后裸金属支架再狭窄和无复流现象[21]。本研究首次通过证明年龄相关因素,在该病的病理生理学中可能是重要的证据,首次调查年龄对PLR与血管造影证实的CAD之间的关联的重要影响,相对于其他炎症因素,也可能是早期CAD动脉粥样硬化的重要驱动力[22]。
目前尚不清楚早发CAD的确切炎症机制,但在年轻人群中,致命CAD的发病率正在全球范围内上升。与迟发性CAD相比,早发CAD临床表现、血管造影和病理学特征均有不同。鉴于我们在老年人和年轻人中发现PLR和CAD之间与年龄相关的关系,我们推测,引起早期CAD的炎症途径与老年患者不同。早发CAD与促炎细胞因子和抗炎细胞因子之间的不均衡相关,而更高水平的T淋巴细胞导致加速动脉粥样硬化。Efe等[23]在40岁以下的年轻患者中100%发现了炎症反应,主要是淋巴细胞为主,而在66岁以上的患者中为61%。Velibey等[24]也证明了冠状动脉斑块的年龄依赖性的炎症特征,得出结论:老年CAD患者存在较高的炎症水平,与早发CAD患者相比,与FOXP3 + T调节(Treg)细胞呈负相关。推测Treg细胞通过抑制免疫应答来减少宿主损伤,并且在减缓Treg细胞功能受损可加速动脉粥样硬化过程的动脉粥样硬化进程中是重要的,导致早发CAD的病情进展和斑块稳定性的改变。
早发CAD患者的动脉粥样硬化,可以由功能障碍的血小板聚集引起,而不是慢性炎症引起巨核细胞增殖和血小板增多症[25]。虽然迟发CAD患者与血栓前状态有关,但同时具有高血纤维蛋白溶解能力可能是有益的,并有助于延迟心血管事件。与健康的患者相比,年轻的CAD患者在纤维蛋白溶解时可以改变纤维蛋白结构和增加相关的纤维蛋白原,血管性血友病因子和纤溶酶原激活物抑制剂-1的浓度。akn等[26]还发现,增强的P-选择素表达可能与年轻CAD的患者血小板活化增加有关。
已经确定,免疫系统随着年龄而变化,CVD也是如此,淋巴细胞功能下降是这种免疫衰老的最常见特征[27]。炎症与心脏危险因素有关; 肥胖,胰岛素抵抗和CAD。在一般人群中,血小板和淋巴细胞的绝对计数随着年龄增长而降低,这与我们的数据一致。然而,随着年龄的变化PLR没有得到大样本的研究。早发CAD更可能在吸烟者和有CAD家族史的患者中更为明显。研究证实[28]:部分基因已经与包括胆固醇在内的年轻发病CAD相关联如:酯转运蛋白基因,肝脂肪酶基因,ApoA1,E,B基因以及各种内皮型一氧化氮合酶等。尽管存在各种假设,但仍然缺乏大量解释早发CAD的研究,而早发和迟发CAD的病理生理学和组织学之间的精确差异仍不清楚。我们的研究涉及多样化的患者,中位年龄各为49岁和67岁,分别表现为急性冠状动脉综合征和稳定型心绞痛。我们还评估了PVD或脑血管疾病对PLR的可能混杂效应,发现PVD和无脑卒中史的患者的PLR没有显著差异。
总而言之,本研究显示PLR与血管造影证实的CAD之间的相关性与年龄有关。虽然高PLR是老年高危患者CAD的标志物,但与年轻患者的CAD呈负相关。这些发现也有越来越多的文献支持:将炎症与CAD联系起来,并且还提示炎症的替代因素可能对于促进早发CAD患者中加速的动脉粥样硬化更重要。传统的生物标志物并不能完全解释CAD的总体风险和病理生理学,特别是在年轻患者中。CVD的生物标志物的研究是未来的一个重要领域,随着人口老龄化的发展,CVD的医学研究逐渐成为不可否认的更为普遍的一类疾病。PLR是一个广泛使用和廉价的标志物,有可能突出显示冠心病高风险的患者以及积极治疗方法的风险分层。需要进行前瞻性研究以更好地理解PLR与CAD和潜在病理生理学的年龄相关性相互作用。此外,还需要更大规模的研究来确定其与传统心血管危险因素相结合的治疗用途。
