脑心肌炎病毒pCMV-HA-VP2表达载体的构建及在HEK293细胞中的表达
2018-10-30李向茸王兴陇马瑞仙李生军冯若飞
李 倩,李向茸,王兴陇,马瑞仙,李生军,冯若飞
(1.西北民族大学 生物工程与技术国家民委重点实验室,甘肃 兰州 730030;2.甘肃省动物细胞工程技术研究中心,甘肃 兰州 730030;3.西北民族大学 生命科学与工程学院, 甘肃 兰州 730030)
脑心肌炎病毒(Encephalomyocarditis Virus, EMCV)是引起多种哺乳动物、啮齿动物乃至灵长类动物产生脑炎、心肌炎、神经性疾病、繁殖紊乱及糖尿病的病原体[1].世界各地的许多野生动物和家畜都感染了EMCV,其中包括欧洲[2]、南美洲[3]、澳大利亚[4]、韩国[5]、意大利[6]和中国[7].同时EMCV拥有广泛的寄主,包括田鼠、松鼠、大象、猪、野猪、浣熊、羚羊、狮子和鸟类[6].猪对EMCV最易感.据血清学调查发现,我国规模化猪场已普遍存在EMCV感染[8].除了在畜牧业方面的重要性,EMCV还具有公共卫生意义.血清学研究已经表明,人类易感染EMCV.EMCV在健康中国人中的血清流行性大约是30.56%[9],并且一些在人类移植和人原代细胞培养方面的病毒感染的研究表明,人类细胞对EMCV敏感[1, 10],因此 EMCV病毒应当受到病毒学界的重视.
EMCV是一种无包膜的单股正链小核糖核酸病毒,长约7.8 kb,包括5’-UTR和3’-UTR以及中间一个较大的开放读码框(ORF)[11].EMCV蛋白的结构及功能与其同病毒科的脊髓灰质炎病毒(Poliovirus, PV)、鼠脑脊髓炎病毒(Theiler’s Murine Encephalomyelitis Virus, TMEV)和口蹄疫病毒(Foot and Mouth DiseaseVirus, FMDV)相似[12].EMCV病毒主要由三个前体蛋白构成[13],分别是P1、P2和P3,其中前体蛋白P1区包含四种结构蛋白VP1、VP2、VP3、VP4[14].病毒衣壳正是由这些结构蛋白构成,病毒抗原表位形成也与这四种结构蛋白密切相关[15],其中VP1是最重要的抗原表位[16],具有中和性.其次抗原性从强到弱依次为VP3、VP2、VP4[11][17].有相关研究表明,病毒粒子表面的衣壳蛋白VP2存在较深的凹陷结构.此结构是受体结合位点[18],为病毒进入细胞提供了路径.同时其表面还包括具有免疫活性的B细胞线性表位.目前,对于EMCV表面的衣壳蛋白VP2仅限于其抗原特性的研究.本试验拟构建VP2病毒结构蛋白的真核表达载体,并将其转染进HEK293细胞进行瞬时表达,为EMCV受体研究提供了基础,同时为后期建立稳定表达细胞系,生产抗原蛋白及疫苗的安全性提供了可靠的依据.
1 材料和方法
1.1 主要材料
EMCV毒株(GenBank:X74312)、人胚肾细胞(HEK293)、pMD18-T载体、pCMV-HA载体、E.coli BL21感受态细胞、兔抗脑心肌炎病毒VP2多克隆抗体等均由西北民族大学生物工程与技术国家民委重点实验室提供.
RNA提取试剂盒购自天根生化科技(北京)有限公司;新生牛血清购自兰州民海生物工程有限公司;EcoRⅠ内切酶、SfiⅠ内切酶、T4 DNA连接酶等购自大连宝生物;LipofectamineTM2000 Reagent购自Invitrogen公司;山羊抗鼠IgG(Dylight594)、HA抗体购自Abbkine公司;HRP-山羊抗兔/鼠IgG购自美国Jackson公司;ECL化学发光显色试剂盒购自美国Pierce公司.
1.2 引物设计与合成
根据GenBank公布EMCV(GenBank:X74312)序列设计一对引物,分别在VP2上游和下游加入了EcoRⅠ和SfiⅠ限制性内切酶识别位点.上游引物:TCGCGGCCATGGAGGCCGATCAAAATACAGAA GAAATGGAG(SfiⅠ),下游引物:CGGAATTCGCTGTCTAGAAAGT GTCTCGTGC(EcoRⅠ).引物由上海生工生物工程技术有限公司合成,VP2全长768 bp.
1.3 目的基因的扩增
参照总RNA提取试剂盒说明书,提取EMCV(X74312)病毒RNA,反转录体系和条件:Oligo(dT)18(10 μM) 2 μL,dNTPs(10 Mm) 2 μL,RNase Inhibitor 1 μL,模板(RNA)10 μL,70 ℃ 5 min,立即冰浴3 min.冰浴后依次加入DEPC水4 μL,5×First strand Buffer 5 μL,M-MLV 1 μL,混匀后42 ℃ 60 min,95 ℃ 5 min.
PCR体系和条件:DEPC水18.5 μL,10×Taq buffer 2.5 μL,dNTPs(10 mM) 0.5 μL,上游引物(20 μM)0.5 μL,下游引物(20 μM)0.5 μL,Ex Taq酶(2.5U/μL)0.5 μL及2 μL cDNA模板,94 ℃ 预变性5 min,94 ℃变性 30 s,66 ℃退火 45 s,72 ℃延伸1 min,共循环34次,72 ℃延伸10 min.
1.4 pCMV-HA与VP2双酶切并连接重组
将1.3所得的PCR产物进行胶回收.胶回收后直接进行双酶切,连接表达载体.选择VP2胶回收产物和载体pCMV-HA,分别用EcoRI 和SfiⅠ限制性内切酶进行双酶切.酶切体系如下:DEPC水15 μL,10× M buffer 5 μL,10×H buffer 5 μL,EcoRI 2.5 μL,SfiⅠ2.5 μL,质粒DNA 20 μL,37 ℃酶切3 h.酶切后对目的片段分别进行胶回收.将胶回收产物进行重组连接,反应体系如下:T4 ligase Buffer 1 μL,T4 DNA连接酶1 μL,载体pCMV-HA双酶切产物3 μL,VP2双酶切产物5 μL于22 ℃连接2 h.取10 μL连接产物转入到感受态细胞BL21中进行转化、涂板、挑取菌斑、摇菌,在摇菌3 h后作菌液验证.将阳性菌液送上海生工生物工程技术服务有限公司测序.将测序鉴定正确的阳性菌液提取高纯质粒,并测定其含量,重组质粒命名为pCMV-HA-VP2.
1.5 重组质粒pCMV-HA-VP2转染HEK293细胞
用10%新生牛血清的DMEM培养液将HEK293细胞接种到6孔细胞培养板中,37 ℃、5% CO2培养至视野中单层细胞量达到70%~80%.用脂质体介导法转染细胞,分别取重组质粒pCMV-HA-VP2和空载质粒pCMV-HA 1.5 μg加入至250 μL Opti-MEM中稀释.各取10 μL脂质体LipofectamineTM2000 Reagent稀释于250 μLOpti-MEM中,室温放置5 min后混合.继续室温放置20 min,逐滴加入到HEK293细胞中,设空白对照.于37 ℃下培养6 h,弃去上清,加5%维持液继续培养,48 h后收细胞进行基因、蛋白水平检测.
1.6 重组质粒pCMV-HA-VP2基因水平表达情况
转染48 h后收取实验组和对照组细胞,参照细胞总RNA提取试剂盒说明提取细胞总RNA,反转录、PCR依照1.2中步骤进行.通过核酸电泳观察重组质粒pCMV-HA-VP2基因水平表达情况.
1.7 间接免疫荧光实验(IFA)
转染pCMV-HA-VP2重组质粒和pCMV-HA空载质粒,48 h后于细胞孔中加入70%丙酮(预冷)固定15 min,弃固定液,在超净工作台中放置5 min~20 min使丙酮挥发干净.加封闭液作用90 min,分别加入鼠抗HA抗体,37 ℃孵育1 h,然后用PBS洗4次,每次5 min.再加入带荧光标记的山羊抗鼠IgG,37 ℃避光孵育1 h.然后用生理盐水洗4次,每次5 min,之后加入核染料,避光染色20 min, 用生理盐水洗2次后在荧光显微镜下进行观察.同期设置空白对照组.
1.8 Western-blotting检测pCMV-HA-VP2蛋白水平表达情况
转染48 h后收取实验组和对照组的细胞,蛋白样品经过RIPA裂解、Loading Buffer煮样后进行Western-blotting检测.一抗分别为鼠抗HA单克隆抗体和兔抗EMCV-VP2多克隆抗体.二抗分别为HRP标记的山羊抗鼠和山羊抗兔.抗体孵育之后进行ECL显色.
2 结果与分析
2.1 目的基因的扩增
以EMCV cDNA为模板进行PCR扩增,所得产物经1%的琼脂糖凝胶电泳检测,得到一条768 bp的目的条带,与预期目的片段大小相符(图1).

M: DNA分子质量标准; 1: VP2基因的PCR扩增产物; 2: 阴性对照
2.2 pCMV-HA-VP2质粒重组和酶切、测序鉴定
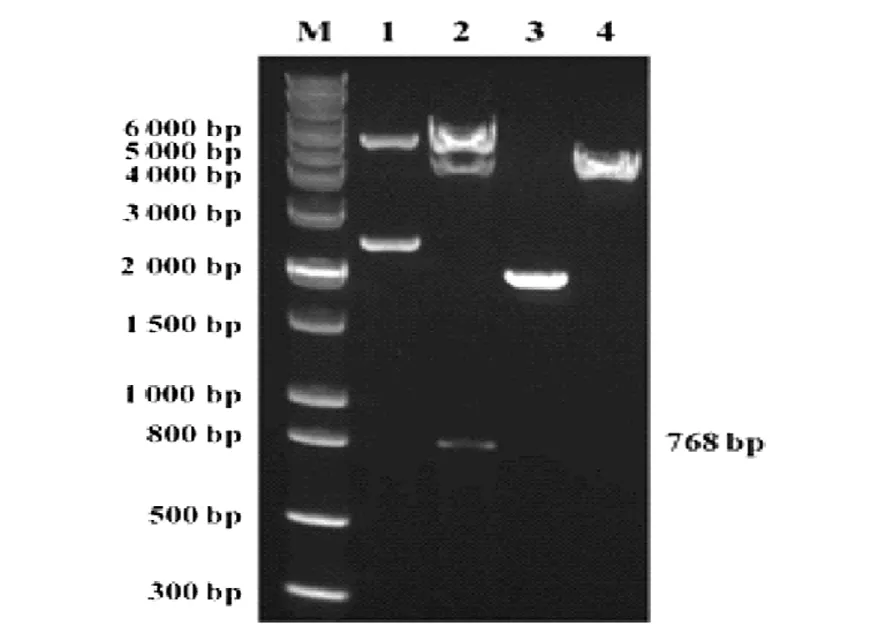
M: DNA分子质量标准; 1: 重组质粒pCMV-HA-VP2;2: 重组质粒pCMV-HA-VP2的双酶切产物; 3: pCMV-HA 空载; 4: pCMV-HA空载的双酶切产物
图2重组质粒pCMV-HA-VP2的双酶切鉴定
重组质粒pCMV-HA-VP2进行双酶切鉴定(EcoRI /SfiⅠ),得到768 bp的酶切片段,大小与预期相符,见图2.将重组质粒测序并经过同源性比对,结果显示pCMV-HA-VP2与X74312基因序列同源性100%,说明重组质粒构建正确.
2.3 重组质粒pCMV-HA-VP2基因水平表达情况
转染48 h后提取细胞总RNA,进行RT-PCR扩增,经1%的琼脂糖凝胶电泳检测,结果如图3.得到768 bp大小的目的片段,与预期结果相符,说明重组质粒pCMV-HA-VP2在HEK293细胞中成功转录表达.图4为实验组、空载组和空白组的β-actin验证图.

图3 PCR检测VP2基因在HEK293细胞中的转录结果图4 β-Actin基因检测
2.4 IFA检测
转染pCMV-HA-VP2重组质粒和pCMV-HA空载质粒,48 h后作间接免疫荧光检测.实验组检测到红色荧光信号,空载组和空白对照组未检测到红色荧光信号,三组经核染料染色后,均出现蓝色荧光信号(图5).
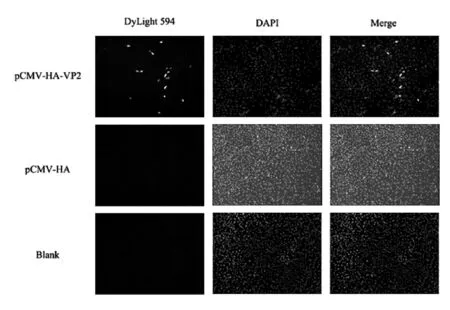
图5 VP2蛋白的间接免疫荧光分析(100×)
2.5 Western-blotting 检测
处理转染后的细胞样品,分别用HA单抗及EMCV-VP2多抗进行Western-blotting检测,两个实验组均在30 kD左右出现免疫杂交条带,与预期VP2蛋白大小一致,空载组和空白组未出现特异条带.说明pCMV-HA-VP2重组质粒在HEK293细胞中融合表达成功,且表达的VP2蛋白具有抗原性,见图6A、6B.

6A: HA抗体检测; 6B: EMCV-VP2抗体检测
3 分析讨论
EMCV是引起患者脑炎、心肌炎等疾病的人兽共患病病原[19].近年来尤其在养猪业中肆虐,不仅严重滞后了养猪业的发展,还对人类健康造成潜在威胁.因此研究EMCV病毒的抗原表位已成为热点.VP1、VP2、VP3均是由大小形态不同的楔形环圈组成,抗原性的差异正是由于这些环圈表面氨基酸的不同所造成的.衣壳围绕2、3和5倍对称的对称轴,其中VP1围绕5倍对称轴分布,而VP2和VP3围绕3倍对称轴交替[20,21],VP4蛋白位于衣壳的内部,并与病毒RNA相互作用.
目前,对结构蛋白 VP1 和 VP3的研究较多.关于VP2 蛋白抗原表位及中和能力鉴定的研究还很少.VP2蛋白氨基酸某联合区域的膜表面极性较强,并且位于VP2蛋白表面的“凹陷”处,暴露于VP2表面[22].还有研究发现,VP2蛋白存在6个B细胞抗原表位区域[23],有一定的免疫活性,因此VP2结构蛋白具有一定的研究价值.本试验构建了pCMV-HA-VP2真核表达载体,并且将其成功转染进HEK293细胞中,通过基因、蛋白及IFA检测,真核表达载体pCMV-HA-VP2能够成功地在HEK293细胞中表达,具有抗原性.通过EMCV-VP2的体外表达,为研究与其互作蛋白的筛选以及建立稳定表达细胞系奠定了基础,也为EMCV受体研究及生产抗原蛋白及疫苗的安全性提供了可靠的依据.
