鼠源VCAM-1真核表达载体构建及在同源细胞中过表达研究
2018-10-30王兴陇李向茸马瑞仙李生军李琼毅张海霞马忠仁冯若飞
王兴陇,李向茸,李 倩,马瑞仙,李生军,李琼毅,张海霞,马忠仁,冯若飞
(1. 西北民族大学 生物工程与技术国家民委重点实验室,甘肃 兰州 730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;3.甘肃省动物细胞工程技术研究中心,甘肃 兰州 730030)
血管细胞黏附分子(vascular cell adhesion molecule 1,VCAM-1)是Ig超家族成员中的I型跨膜糖蛋白,分子量为100~110 kDa,含有674个氨基酸,其配体是VLA-4分子,分布于白细胞表面[1].VCAM-1基因含有7个免疫球蛋白结构域,仅在内皮细胞被细胞因子刺激后才在大血管和小血管上表达[2-4].炎症疾病期间,VCAM-1通过几种介质(包括ROS)在内皮细胞上诱导VCAM-1的表达,如细胞因子信号通过高水平的短寿命ROS诱导内皮细胞中VCAM-1的表达,激活NF-κB通路[5-8].然后内皮上的VCAM-1既作为白细胞迁移的支架,又可作为通过NADPH氧化酶产生的ROS产生内皮信号的触发器,导致内皮细胞内产生超氧化物和过氧化氢,对内皮细胞产生损伤[9-11].炎症通过抑制白细胞与VCAM-1结合或通过抑制VCAM-1信号转导而被阻断,VCAM-1信号转导和VCAM-1依赖性炎症被抗氧化剂阻断.因此,VCAM-1信号传导是炎症性疾病过程中药物干预和抗氧化剂干预的目标.在病毒受体的相关研究中,VCAM-1被鉴定为EMCV-D 在鼠类血管内皮细胞上的受体[12].
VCAM-1是EMCV-D 在鼠类血管内皮细胞上的受体,并且VCAM-1参与机体的免疫反应、炎症反应、肿瘤的发展及转移等多种病理生理过程[13-14].因此本文建立了小鼠成肌细胞(C2C12)的VCAM-1过表达方法,为之后VCAM-1与EMCV病毒感染研究建立了基础,同时为VCAM-1与疾病相关研究提供了技术支持.
1 材料与方法
1.1 细胞、菌体及载体
小鼠成肌细胞(C2C12)由甘肃省动物细胞工程技术研究中心提供;感受态细胞BL21、表达载体pcDNA3.1(+)均由生物工程与技术国家民委重点实验室(西北民族大学)提供.
1.2 主要试剂
0.25%胰蛋白酶、DMEM培养基均购自兰州百灵生物技术有限公司;新生牛血清(NBS)购自兰州民海生物工程有限公司;Opti-MEM购自美国Gibco公司;培养细胞/细菌总RNA提取试剂盒、质粒小提试剂盒、高纯质粒小提试剂盒、dNTPs(10mM)、TIANScript M-MLV均购自北京天根生化科技有限公司;Oligo(dT)18、RNase Inhibitor均购自生工生物工程(上海)有限公司;TaqDNA聚合酶、pMD18-T、EcoR I 、Kpn I 限制性内切酶、T4 DNA连接酶均购自大连宝生物工程有限公司;LipofectamineTM2000 Reagent 购自Invitrogen公司;Power SYBR Green PCR Master Mix购自美国Applied Biosystems公司;兔抗VCAM-1单克隆抗体、鼠抗β-actin单克隆抗体购自Abcam公司;山羊抗兔IgG-HRP、山羊抗鼠IgG-HRP、山羊抗兔IgG-Alexa Fluor 594均购自Jackson公司;DAPI染色液购自碧云天生物技术研究所.
1.3 引物设计与合成
针对鼠源VCAM-1 (GenBank登录号:X67783.1)的基因序列应用Primer Premier 5.0与DNAStar软件进行引物设计,同时在引物序列上加入酶切位点,分别设计VCAM-1全长基因的特异性引物VCAM-1-F/R、荧光定量PCR引物VCAM-1-qF/R和鼠源mGAPDH-qF/R荧光定量PCR引物,由上海生工合成(见表1).
表1引物序列

1.4 VCAM-1基因提取与扩增
分别收取C2C12细胞,利用天根总RNA提取试剂盒提取细胞RNA,反转录后获得cDNA,进行PCR扩增.PCR反应体系为:DEPC H2O 18.5 μL、上下游引物各 0.5 μL(20 μM)、10×PCR buffer 2.5 μL、dNTPs(10 mM) 0.5 μL、TaqDNA 0.5 μL、cDNA 2 μL.总体系25 μL,条件为94 ℃,5 min;94 ℃,30 s;60 ℃,1 min;72 ℃,3 min;72 ℃ 10 min;第2~4进行35个循环.反应结束,用10 g/L的琼脂糖凝胶电泳验证扩增产物.
1.5 表达载体pcDNA3.1-VCAM-1的构建及鉴定
VCAM-1扩增产物与pCDNA3.1(+)载体分别进行EcoRI、KpnI双酶切,胶回收纯化回收,并用T4 DNA连接酶进行连接.连接完成后,将连接产物转化至大肠杆菌BL21感受态细胞中,均匀涂布于含氨苄青霉素的LB平板上,37 ℃培养12~16 h.随机选取单克隆菌落进行增菌培养并进行测序,将获得测序正确的阳性质粒命名为pcDNA3.1-VCAM-1.
1.6 脂质体介导重组质粒pcDNA3.1-VCAM-1转染C2C12细胞
取已培养至密度约为75%的C2C12细胞培养板,用Opti-MEM漂洗细胞培养板中的细胞.Opti-MEM分别稀释重组质粒pcDNA3.1-VCAM-1及空载质粒pcDNA3.1.按比例加入脂质体LipofectamineTM2000混匀.逐滴加入C2C12细胞中,空白对照加入等量Opti-MEM,于37 ℃、5% CO2培养箱中孵育.孵育6 h后,弃去转染液,每孔分别加入3 mL含10% NBS的DMEM细胞培养液培养.
1.7 VCAM-1基因在C2C12细胞中转录检测
转染48 h后,各组弃去细胞上清,用预冷的PBS漂洗细胞两遍,之后用预冷的PBS将细胞吹打下来并收集在离心管中,1 000 r/min离心10 min,收集细胞沉淀.取收集的细胞提取总RNA,分别测定RNA的浓度及纯度.根据测定结果进行定量反转录,反转录得到的cDNA作为模板进行荧光定量PCR检测,目的基因为VCAM-1,内参基因为mGAPDH.反应体系:Power SYBR Green PCR Master Mix,2.5 μL;DEPC H2O,18.5 μL;VCAM-1-qF/mGAPDH-qF,1 μL;VCAM-1-qR/mGAPDH-qR,1 μL;cDNA,2 μL.反应条件:95 ℃,30 s;95 ℃,5 s;60 ℃,35 s;第2~3步骤重复40次.将所得数据进行统计学分析,比较各组间差异.
1.8 Western-Blot检测VCAM-1蛋白表达情况
运用1.7的方法收集细胞,用RIPA裂解液裂解后进行SDS-PAGE,在低温、60 V恒压条件转印到PVDF膜上.取出PVDF膜用50 g/L脱脂奶粉室温摇床封闭1 h,加入一抗,37 ℃摇床孵育2 h,PBST洗5次,5 min/次;再加入二抗,37 ℃摇床孵育1 h,PBST洗5次,进行ECL显色.一抗分别为1∶2000稀释的兔抗VCAM-1单克隆抗体和1∶4000稀释的鼠抗β-actin,二抗分别为1∶5000稀释的HRP标记的山羊抗兔和山羊抗鼠.
1.9 间接免疫荧光法检测VCAM-1基因细胞定位
重复步骤1.6,转染24 h后,弃去原培养基;PBS洗3次,每次5 min;加入80 g/L预冷丙酮1 mL/孔,固定15 min;弃去,晾干,加入0.1 mL/L TritonX-100对细胞透化处理15 min;PBS洗3次,每次5 min,用50 g/L牛血清白蛋白于37 ℃封闭90 min;加入1∶200稀释的兔抗VCAM-1单克隆抗体,37 ℃孵育1 h;PBS洗5次,每次5 min;再加入1∶500稀释的山羊抗兔IgG-Alexa Fluor®594,37 ℃避光孵育1 h;避光条件下PBS洗5次,每次5 min;DAPI染色液复染核10~15min;蒸馏水洗10 min;加入抗荧光猝灭的封片液封片,在尼康激光共聚焦显微镜下并拍照.
2 结果与分析
2.1 VCAM-1基因的扩增与酶切、测序验证
PCR扩增VCAM-1基因后进行核酸电泳验证,检测到片段大小与预期一致的特异性条带(图1,A);表达载体pCDNA3.1-VCAM-1构建成功后,双酶切得到了目的基因与表达载体,大小与预期一致(图1,B).重组载体pCDNA3.1-VCAM-1由上海生工测序,核苷酸和氨基酸序列同源性均为100%,表明表达载体构建成功.
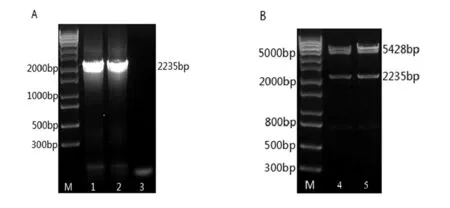
M:1kb plus DNA分子质量标准;1,2:VCAM-1基因PCR产物;3:PCR阴性对照;4,5:重组质粒pcDNA3.1-VCAM-1酶切产物
2.2 VCAM-1基因在C2C12细胞中转录检测结果
实时荧光定量PCR检测VCAM-1基因水平表达与统计学分析,转染pCDNA3.1-VCAM-1组基因丰度明显高于对照组,差异显著(P<0.01),见图2,表明重组质粒转成功,并进行转录.

图2实时荧光定量PCR检测VCAM-1基因在C2C12细胞中的转录结果(P<0.01)
2.3 VCAM-1基因在C2C12细胞中蛋白水平的检测
经Western blot检测,VCAM-1在细胞量一致的情况下(内参调控),转染pCDNA3.1-VCAM-1组蛋白的表达量明显高于对照组,见图3,表明VCAM-1成功过表达.

图3VCAM-1蛋白在C2C12细胞中表达产物Western-blot分析
2.4 VCAM-1基因在细胞过表达定位
间接免疫荧光实验检测结果,见图1.VCAM-1均在细胞浆中表达,且转染pCDNA3.1-VCAM-1组 明显要高于对照组,表明转染组VCAM-1蛋白获得了过表达,且与细胞中原有的蛋白共定位于胞浆内.
3 分析讨论
本研究成功构建了真核表达载体pcDNA3.1-VCAM-1,并在C2C12细胞中进行了表达.通过相对荧光定量PCR检测发现,VCAM-1过表达组基因水平明显高于对照组.通过Western-blot分析,过表达组VCAM-1蛋白高于对照组细胞.利用间接免疫荧光实验分析可知,在C2C12细胞上VCAM-1本底表达较低,当转染了真核表达载体pcDNA3.1-VCAM-1后,VCAM-1的表达明显增多,且共定位于胞浆中.结果证明,转染后基因水平及蛋白水平均有明显表达,成功建立了VCAM-1瞬时过表达的方法.
VCAM-1被鉴定为EMCV-D 在鼠类血管内皮细胞上的受体,且与白细胞整联蛋白结合触发信号级联反应.在炎症过程中,细胞因子在内皮细胞上诱导VCAM-1表达,细胞因子信号激活NF-κB通路.VCAM-1在病毒感染、炎性反应及天然免疫研究中具有较为重要的作用.VCAM-1瞬时过表达方法的成功建立,为深入研究EMCV病毒受体奠定了基础.

图4 VCAM-1蛋白在C2C12细胞中的过表达定位
