调脂通脉中药对动脉粥样硬化兔模型内皮细胞标志物的影响
2018-10-30郭书文苏兆铎武建功刘文臣
张 璐 孙 晴 郭书文 郑 敏 苏兆铎 武建功 刘文臣 陈 曦
(1.北京中医药大学,北京 100029;2.首都医科大学附属北京中医医院,北京 100010;3.中日友好医院,北京 100029;4.首都医科大学,北京 100069)
动脉粥样硬化(AS)病变斑块的易损性是引起心脑血管急性事件的主要原因,“罪犯病变”一词很好地描述了易损斑块的特征。AS斑块中主要病理特征是“脂质核心”,在病理因素刺激下,内皮细胞功能障碍,单核细胞分化成巨噬细胞表达多种模式识别受体(PRRs)[1],巨噬细胞通过这些 PRRs(如清道夫受体)特异性的摄取ox-LDL,ox-LDL沉积,凝集素样氧化低密度脂蛋白受体1(LOX1)激活,释放炎症因子,引起趋化因子MCP-1表达,趋化单核细胞,形成泡沫细胞,最终形成脂质核心[2]。可见,动脉内膜损伤是AS病变发生的始动环节。调脂通脉中药由黄芪、当归、决明子、生山楂、泽泻、地龙、三七粉组成,来源于临床经验方,用于治疗血脂异常,效果明显。本实验采用高脂饲料饮食加球囊损伤颈动脉内膜的方法复制兔动脉粥样硬化模型,通过观察内皮细胞标志物内皮素(ET-1)、内皮型一氧化氮合酶(eNOS)、前列环素 2(PGI2)、血栓烷 A2(TXA2),探讨调脂通脉中药改善AS的作用机制。现报告如下。
1 材料与方法
1.1 实验动物 健康新西兰大耳兔,体质量2.5~3.0 kg,3~4月龄,雄性,购自北京金牧阳实验动物养殖有限责任公司,许可证编号SCXK(京)2010-0001,饲养于北京大学医学部普通动物实验室。饲养条件符合国家二级标准,单笼饲养,自由进食、水。
1.2 实验药物 调脂通脉中药,组成:决明子、生山楂各 30 g,生黄芪 20 g,泽泻 12 g,当归、地龙各 15 g,三七粉6 g,共128 g。严格遵循口服颗粒剂制备工艺,按处方比例称取药材,前6味中药加水煎煮2次,浓缩制成稠膏,将三七粉按比例加入上述稠膏,混匀,制成整粒,干燥,包装,制成每剂20 g的颗粒(由北京中医药大学第三临床医学院提供)。按人体质量70 kg折算成兔等效剂量:7.3 g/(kg·d)。 阿托伐他汀钙片(立普妥,辉瑞制药有限公司提供,生产批号:1237304,规格20 mg/片),按临床 20 mg/d 折算,兔等效剂量为 1.1 mg/(kg·d)。
1.3 动物饲料 高脂饲料(胆固醇1%,猪油3%,蛋黄粉10%,普通饲料86%)购于北京华阜康生物科技股份有限公司,许可证编号:SCXK(京)2009-0008。实验兔每只每日给予120 g高脂饲料,其余为普通饲料。
1.4 试剂与仪器 乌拉坦,500 g/瓶,国药集团化学试剂北京有限公司提供。肝素钠注射液,2 mL/支:12500 IU,由常州千红生化制药有限公司提供。盐酸利多卡因注射液,5 mL∶0.1 g/支,上海朝晖药业。注射用青霉素钾(兽用),北京立时达药业,160万IU/支。ELISA试剂盒,武汉华美生物工程有限公司提供。2.0 mm×15 mm球囊导管,德国贝朗公司提供。球囊扩张压力泵,BMW指引导丝,Y阀三通管,备皮刀,临时动脉夹,眼科剪,眼科镊,止血钳(蚊式和普通),持针器,无菌带线缝合针,不同规格的注射器。全自动生物化学分析仪,型号7600,日本日立公司;全封闭式组织脱水机,型号ASP300S,德国 Leica;石蜡组织包埋系统,型号 EG1150,德国Leica;手动轮转式切片机,型号RM2235,德国Leica;H&E自动染色机,型号ST5020,德国Leica;全波长多功能酶标仪,型号22051164,瑞士Tecan。
1.5 模型制备 高脂饲料喂养2周后采用球囊损伤颈动脉方法复制AS模型[3-4]。术前12 h禁食,不禁水。称体质量,给予25%乌拉坦注射液4 g/kg耳缘静脉注射,麻醉成功标志:呼吸深慢均匀,四肢瘫软,角膜反射迟钝。麻醉成功后耳缘静脉推注肝素钠200 IU/kg,防止凝血。动物仰卧位固定于无菌手术台,电推剪脱毛,常规外科消毒,铺巾,沿颈正中线切开颈部皮肤,暴露皮下组织,纵行逐层钝性分离肌肉、筋膜,分离颈动脉血管,保护伴行的神经,区分颈总动脉、颈内动脉以及颈外动脉后,应用动脉夹结扎颈总动脉和颈内动脉,眼科剪斜向颈外动脉剪一“V”型小口,将2.5 mm×15 mm球囊经颈外动脉送入颈总动脉至主动脉弓处,给予合适压力,重复操作3~4次,随后抽空球囊,缓慢撤出导管,无菌缝合线结扎颈外动脉,撤出动脉夹恢复血流。检查有无出血、渗血,逐层缝合肌肉、皮层。应用800000 IU青霉素肌肉注射3d预防感染。假手术组仅在解剖出颈总动脉后,用无菌缝合线在颈外动脉(远心端处)打一死结,不进行球囊损伤。术后将动物置于加热毯上,无菌敷料覆盖。造模后继续高脂饲养。
1.6 分组与给药 随机化原则分为正常组、假手术组、模型组、西药组和中药组,每组14只,在造模成功后第6周、第12周两个时间点观察指标变化情况。术后灌胃相应药物,中药组予调脂通脉中药7.3 g/kg(颗粒剂用沸水溶成汤剂);西药组予阿托伐他汀1.1 mg/kg(研磨后0.9%氯化钠注射液溶解);正常组、假手术组和模型组不进行药物干预,以相同体积蒸馏水灌胃;各组均为4 mL/kg,每日1次。
1.7 标本采集与检测 1)血脂测定。分别在造模后6周和12周2个时间点将兔空腹禁食12 h,不禁水后,耳缘静脉采血,3000 r/min,离心10 min,留取血清。全自动生物化学分析仪测定血清胆固醇(TC)、三酰甘油(TAG)和低密度脂蛋白胆固醇(LDL-C)水平,计算动脉粥样硬化指数(AI),AI=(TC-HDL-C)/HDL-C。 2)颈动脉病理组织观察。在造模后6周和12周两个时间点将实验兔沿耳缘静脉注入10mL空气处死。剪开颈部皮肤,剥离肌肉组织,暴露颈动脉,剪取尽可能长的颈总动脉。将颈总动脉用生理盐水反复冲洗后固定于10%中性甲醛溶液中,石蜡包埋,连续切片,进行HE染色。3)肝脏病理组织观察。取各组实验在造模后6周和12周两个时间点取肝脏标本,将肝脏组织固定于10%甲醛中,石蜡包埋,切片,梯度酒精脱水,二甲苯透明,树胶封固,封片后显微镜观察,拍照,传入病理图像分析系统进行分析。 4)ET-1、eNOS、PGI2、TXA2 水平检测。用ELISA试剂盒检测血液中ET-1、eNOS、PGI2、TXA2水平,按试剂盒上的说明进行操作,观察第6周、12周指标变化情况。
2 结 果
2.1 各组动脉粥样硬化兔模型血脂水平比较 见表1。与正常组比较,模型组TC、LDL-C水平明显升高,高脂血症较为明显(AI>4)。西药组和中药组TC水平较模型组降低(P<0.05)。LDL-C与TC变化趋势相似,两个药物组的水平在不同时间点均较模型组降低(P<0.05)。中药组和西药组之间未发现TC和LDL-C水平显著差异,两组TAG差异不显著。此外中药组和西药组在12周时升高HDL-C水平(P<0.05)。计算动脉粥样硬化指数(AI),中药组在12周时表现出最佳降低高脂血症的效果(AI<4),有效降低动脉粥样硬化发生风险。

表1 各组血脂水平比较(x±s)
2.2 各组颈总动脉斑块大小评价 见图1。显微镜下观察颈总动脉切片HE染色结果,如图所示正常组颈总动脉结构完整,内膜无增厚,内皮下未见AS病变斑块;中膜平滑肌细胞排列整齐。模型组可见管腔狭窄,AS斑块向管腔内突起,管腔完整性被破坏,内皮细胞受损,可见泡沫细胞组成的脂质斑块。与模型组比,治疗组内皮细胞层紧密排列,连续性佳,平滑肌细胞未见增殖重构,提示治疗有效。12周时,模型组颈动脉斑块几乎布满整个管腔,管腔狭窄,平滑肌细胞排列紊乱,可见典型的脂质斑块形成。斑块底部肌层萎缩变薄。与模型组比较,两个给药组实验兔的AS病变斑块得到了不同程度的控制,中药组和西药组仅见少量斑块,病变较轻。
2.3 各组肝脏形态学改变比较 见图2。6周时,正常组肝小叶结构清晰中央静脉居中,界面平滑,肝索排列规则,胞核结构清晰,细胞未见增生。高脂饮食喂养下的模型组肝脏组织中脂质积聚情况较正常组和假手术组增多。与模型组比较,中药组和西药组肝脏的脂质积聚情况明显减轻。12周时,模型组可见弥漫性肝细胞脂肪变性,肝小叶结构破坏甚至炎细胞浸润,肝细胞体积明显增加,胞质内可见大量脂肪空泡,核被挤于细胞边缘。中药组肝细胞一定程度损坏,可见散在肝细胞脂肪变性,以小空泡脂肪变为主,肝小叶内少许炎细胞浸润,未见肝内炎症现象,脂滴明显减少。少数可见有肝细胞碎屑样坏死和炎细胞浸润,但未见有纤维化改变。
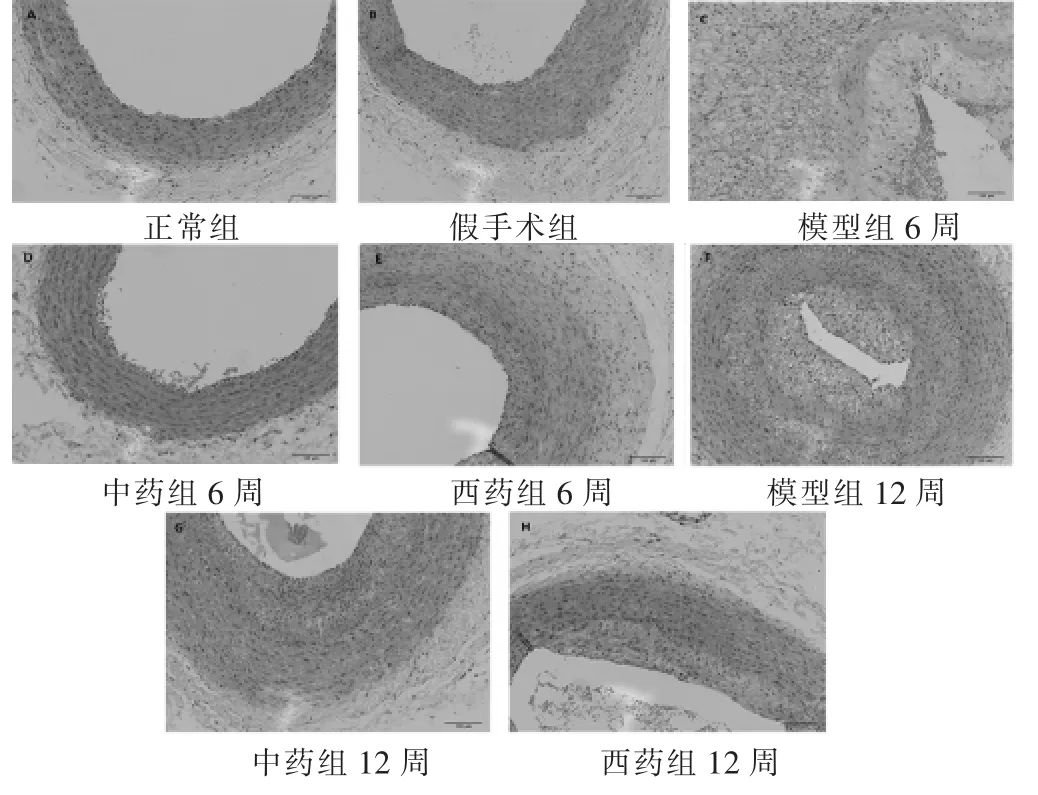
图1 各组颈总动脉切片(HE染色,200倍)

图2 各组肝脏病理组织(HE染色,40倍)
2.4 血清内皮细胞标志物 ET-1、eNOS、PGI2、TXA2水平 见表2。6周时,与假手术组比较,模型组兔血清ET-1、TXA2 含量明显升高,eNOS、PGI2 水平下降(P<0.05)。与模型组比较,中药组和西药组ET-1、TXA2含量下降,eNOS、PGI2 水平升高(P<0.05)。12 周时,与假手术组比较,模型组兔血清内皮细胞标志物ET-1、TXA2含量分别升高了60.21%和 52.73%(P<0.05),eNOS、PGI2水平下降了 55.61%和 42.83%(P<0.05),提示模型组后期内皮损伤严重。与模型组比较,中药组的 eNOS、PGI2水平升高了 58.16%和 31.73%(P<0.05),ET-1、TXA2水平下降了 41.82%和 21.96%(P<0.05),提示调脂通脉中药能够改善内皮细胞损伤。同时,西药组也起到了相同的作用。

表 2 各组血清 ET-1、eNOS、PGI2、TXA2 水平比较(ng/L,x±s)
3 讨 论
正常情况下,内皮细胞通过产生血管活性物质、生长因子、生长抑制因子维持血管壁的稳态[5]。如位于内皮细胞表面的TXA2和进入血流的PGI2、一氧化氮(NO),它们相互拮抗、相互协调,具有抗血栓形成、介导平滑肌细胞舒缩功能的作用[6]。NO是体内L-精氨酸在一氧化氮合酶(NOS)的催化下形成的,是十分重要的信使分子。NOS分为eNOS和诱导型一氧化氮合酶(iNOS),eNOS会在血管内产生NO与其协助调节血管功能,可与原生膜所包围的细胞及与细胞内高基氏体膜联合,是诱导NO生成重要的酶[7]。ET-1是一种由21个氨基酸残基组成的活性多肽,是目前所知最强的缩血管物质[8]。内皮细胞损伤,可表现为血管舒张-收缩功能失衡,即NO水平降低和ET-1分泌增加,出现通透性和分泌功能障碍,甚至内皮剥脱[9]。此外,TXA2和PGI2,作为花生四烯酸代谢产物中生物活性最强的一对,分泌失衡也是发生AS的始动环节,因其参与了激活血小板,使血小板聚集和血管扩张[10]。内皮损伤,活性氧簇(ROS)增加,肌质网钙三磷酸腺苷酶氧化增强,稳态失衡,引起内质网应激、代谢功能失调、自由基形成等多重反应[11]。本实验发现,6周、12周两个时间点,动脉粥样硬化兔模型血液中eNOS、PGI2表达下降,ET-1、TXA2水平升高,表明AS模型出现内皮功能障碍,而兔模型通过调脂通脉中药干预后,能够降低ET-1、TXA2水平,同时升高 eNOS、PGI2水平,改善了内皮细胞收缩-舒张功能障碍。因此,我们推测调脂通脉中药能够改善内皮细胞损伤,保护血液和组织之间的这层“屏障”。
“膏脂学说”是中医认识本病的重要依据。《灵枢·卫气失常》中提到“众人血与气不能相多,膏者多气,气者多热;脂者,其血清,气滑少”。可见气血理论在本病治疗中具有指导意义。中医学认为,“人以脾胃为本,盖人受水谷之气以生”。脾是淋巴器官,具有重要的免疫功能。脾气虚会造成血脂异常,这是一个多脏腑功能失调作用的结果,脾系统的功能不仅仅局限于西医解剖学中的脾脏,还涉及消化系统、血液、免疫、神经功能等。因此,脾气虚可使免疫系统功能下降,而这也正是引起动脉粥样硬化形成的重要因素之一。
在多脏腑功能失调中,最重要的是脾气虚会影响肝的疏泄功能,肝失疏泄使胆汁聚集,形成结石阻滞胆道。胆道受阻会降低净浊化脂的功能,进而引起血脂异常。气血关系密切自不必说,气为血帅,血随气行。肝失疏泄引起气滞不行或脾气虚推动无力,会引起血瘀。脾虚不运清浊,津液停滞,湿邪内聚而致痰生。《临证指南医案》中说“湿为重浊有质之邪,若从外而受者,皆由地中之气升腾;若由内而生者,皆由脾阳之不足”。可见湿邪与脾虚关系密切。湿性黏滞,阻碍气机,化而为痰。明代王绝在《明医杂著》中所言“痰者,病名也,人之一身,气血清顺则津液流通,何痰之有?唯气血浊逆,则津液不清,熏蒸成聚而变为痰焉”。《景岳全书·痰饮》中也提到“痰即人之津液,无非水谷之所化。此痰亦既化之物,而非不化之属也。但化得其正,则形体强,营卫充,而痰涎本皆血气;若化失其正,则脏腑病,津液败,而血气即成痰涎”。气虚、血瘀、痰浊,会引起血液流变异常,血流不畅使血液呈黏滞、浓稠状态,引起血脂增高。所以痰浊凝聚、结于心脉亦是动脉粥样硬化形成的关键病机。
从现代药理学角度看,血脂异常会引起血浆成分发生改变,如血小板、ET-1,动脉收缩,血管内正常的代谢受到抑制,引起脂质沉积[12]。笔者认为,动脉粥样硬化的治疗关键是健脾益气为本,以去浊活血通络为标。以此为依据遴选组成的中药复方——调脂通脉中药,标本兼治,临床长期疗效较好,课题组前期实验研究验证其作用效果明显,能够降低AS模型血清炎症因子、增加抗炎因子如IL-10、TGF-β的表达,还能增加ApoE-/-小鼠斑块内自噬基因的表达[13-15]。本实验对AS兔模型内皮细胞标志物eNOS、ET-1等药效指标进行评价,研究表明调脂通脉中药作用明显,能够起到降低血脂、改善内皮功能紊乱的作用,为AS的预防和治疗提供新的思路。
