四逆汤对高脂血症合并动脉粥样硬化兔模型血清炎性因子的影响*
2018-10-30王元红郁保生雎世聪邹旭峰
王元红 郁保生 雎世聪 邹旭峰 龙 飘
(湖南中医药大学,湖南 长沙 410208)
动脉粥样硬化(AS)主要累及动脉血管内壁,使其增厚变硬,管腔缩小,失去弹性,继而内膜出现脂质或糖类、蛋白质堆积,在外界刺激下发生血管破裂或血栓形成,严重危害人类健康[1]。随着我国生活水平提高,饮食结构改变,AS是众多疾病 (诸如脑梗死、心肌梗死、脂肪肝、肝硬化、慢性肾病等)的形成、病发乃至恶化的重要原因之一。其发病率呈逐年增高的趋势,并且呈年轻化发展[2]。因此,AS的临床特征、病理机制及中、西药研发已成为近年来研究热点。高脂血症(HLP)主要是机体脂肪代谢障碍而导致血清总胆固醇(TC)或三酰甘油(TAG)水平过高的一种病症。HLP能够诱发并促进AS的形成,是 AS的病理因素之一,两者关联密切[3]。药理研究发现[4-5],四逆汤及其各成分提取液均对超氧阴离子自由基有较强的清除能力,可通过抑制巨噬细胞、血管平滑肌细胞以及内皮细胞吞噬脂质,从而达到降脂的目的。本课题组前期研究发现[6],四逆汤可明显减缓AS程度,减轻内膜增厚水平,减少内膜的脂质斑块面积,并减少凋亡泡沫细胞数量,继而减少炎性因子的释放,控制非特异性免疫反应。在此基础上,笔者以四逆汤抗炎作用为切入点,观察四逆汤对HLP合并AS兔模型血清相关炎性因子的影响。现报告如下。
1 材料与方法
1.1 实验动物 新西兰雄性纯种大耳白兔60只,3月龄,体质量(2±0.5) kg,动物许可证号:SCXK(湘)2016-0005,湖南东创科技实验动物有限公司。动物饲养于室温(20±2) ℃、相对湿度(60±5)%的环境,采用12 h/12 h明暗光照。
1.2 实验药物 四逆汤由附子、干姜和炙甘草组成,购于湖南楚仁堂医药连锁有限责任公司,批号:410075782,药物剂量按 2∶3∶4(附子 15 g,干姜 23 g,炙甘草31 g)在湖南中医药大学第一附属医院制剂科制备成四逆汤浸膏(每1 g浸膏含生药4.8 g)。阿托伐他汀钙片,北京嘉林药业股份有限公司,国药准字号H19990258,批号:090203440。双重蒸馏水由湖南中医药大学实验室制备生产。
1.3 试剂与仪器 胆固醇(河南利伟生物药业股份有限公司);丙硫氧嘧啶(50 mg/片,上海朝晖药业有限公司,国药准字H31021082);蛋黄粉(郑州中成化工有限公司);猪油(市售);20%乌拉坦(上海化学试剂公司,生产批号:20150123);TC、TG检测试剂盒 (上海晶都生物技术有限公司,批号:JD1726、JD1721);兔白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)等 ELISA 试剂盒(武汉华美生物工程有限公司,CSB-E06903Rb)。JY3002型电子天平(瑞士METTER,AE100);TGL16M 台式高速冷冻离心机 (德国Eppendorf公司)、SB3200型超声波清洗机(必能信超声上海公司)、全自动生化分析仪 Roche Hitachi917型 (日本 Olympus公司)、BCD-226STC型冰箱(美国Thereto公司)、RM23235轮转石蜡切片机(德国LEICA公司)。
1.4 分组与造模 将实验兔适应性喂养1周后,随机分为正常组、模型组、阿托伐他汀组、四逆汤低剂量、四逆汤中剂量组、四逆汤高剂量组,每组10只。正常组饲喂普通饲料,其余各组饲喂高胆固醇饲料 [胆固醇1%,猪油5%,蛋黄粉10%,基础饲料84%,将猪油加热至液体状,与胆固醇、蛋黄粉拌匀,每100 g高胆固醇饲料中加入20 mg丙硫氧嘧啶(10 mg/kg),一起加入普通饲料拌匀加工成丸剂][7]造模。日食量按120~150 g分笼给予,饮水不限,连续喂养12周。每周定期称体质量1次并记录。成模标准:酶检测兔血清血脂水平提高,其次通过病理切片观察主动脉脂质斑块情况。
1.5 给药方法 造模成功后,各给药组家兔按被试因素施加方法,连续4周给予药物治疗。西药组按1 g/(kg·d)给予阿托伐他汀钙片,磨碎拌入高脂饲料;四逆汤低、中、 高剂量组家兔将浸膏按 3.03、6.06、12.12 g/(kg·d)(按成人等效剂量折算[8]),拌入高脂饲料;模型组继予高脂饲料;正常组继予普通饲料,于早晨9∶00一次性饲喂。各组干预时间均为4周。
1.6 标本采集与检测 1)IL-6、IL-10、TNF-α、IFN-γ的检测。干预4周后,兔耳缘静脉注射20%乌拉坦麻醉固定,迅速剖开腹腔,取腹主动脉血2 mL,分别注入10%EDTA-Na 230 μL 试管、4 万 U/mL 抑肽酶 40 μL试管,混匀,离心,取上清液,存于-20℃冰箱中。取冰冻血清标本,常温融化,预估浓度。于空白孔、标准孔、待测样品孔分别加入样品稀释液、标准品、待测样品100 μL,不触及孔壁。封板后置37℃温育60 min。每孔加入100 μL工作液A,封板,孵育 35 min,洗板3次,甩干。每孔加入100 μL工作液B,封板,孵育60 min,洗板5次,甩干。每孔注入显色剂90 μL,37℃避光显色。每孔依序加50 μL终止液,终止反应。酶标仪在450 nm处测各孔光密度值(OD值)。2)动脉病理组织观察。提取腹主动脉,游离上端至主动脉,剪取小段置于冻存管,液态氮保存,另取小段4%PF液固定,梯度脱水,二甲苯透明,石蜡包埋,切片(厚度4 μm)、烤片、脱蜡、HE染色、封片,镜下观察主动脉形态学变化。
1.7 统计学处理 应用SPSS21.0统计软件。计量资料以(x±s)表示,组间比较方差齐者LSD法,方差不齐时Tamhane′s T2法。不满足正态性分布选择秩和检验。P<0.05为有统计学意义。
2 结 果
2.1 模型鉴定 见图1,表1。HE染色示:正常组兔主动脉管壁结构清晰可见;模型组管壁内可见大量斑块和脂质沉积,表明在造模后家兔主动脉管壁各层组织受到一定的损伤。造模第12周,经抽样检测,与正常组比较,模型组兔血清TC、TAG水平较高,差异有统计学意义(P<0.01),表明造模成功。
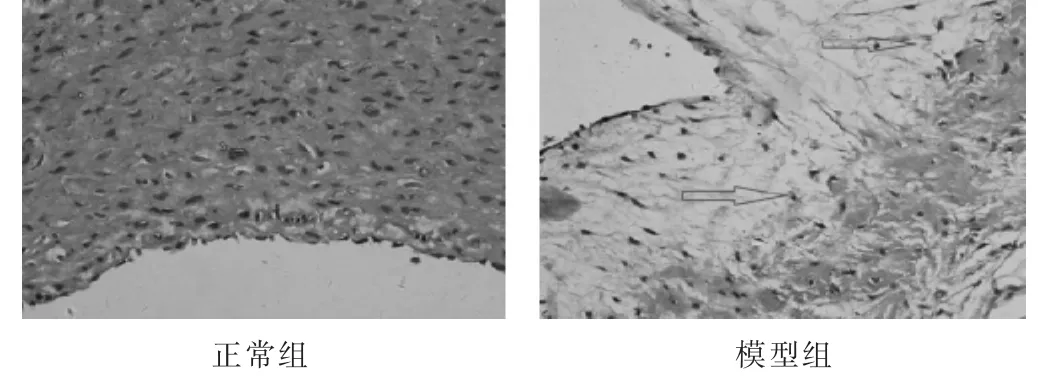
图1 正常组、模型组家兔主动脉管壁组织形态学比较(HE染色,400 倍)
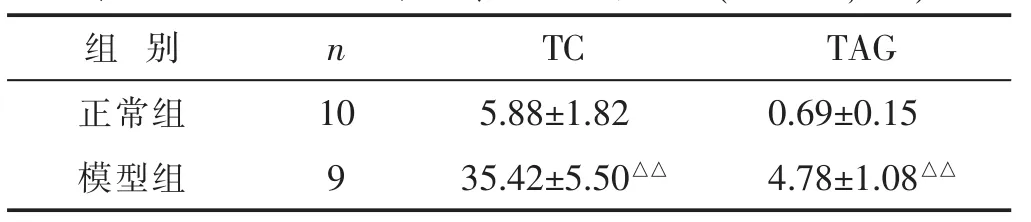
表1 两组家兔血清TC、TAG水平比较(mmol/L,x±s)
2.2 各组家兔主动脉病理观察结果 正常组兔主动脉壁各层次清楚,管腔内壁光滑、无脂质浸及,平滑肌细胞整齐排列,无斑点。与模型组比较,四逆汤高剂量组抑制泡沫细胞形成和平滑肌细胞的增生与重构效果显著;四逆汤中剂量组血管炎症浸润程度降低,脂质斑块排列整齐;阿托伐他汀组脂质斑块较少,但主动脉内膜仍有大量泡沫细胞聚集;四逆汤低剂量组抗炎、降脂效果均不明显。见图2。
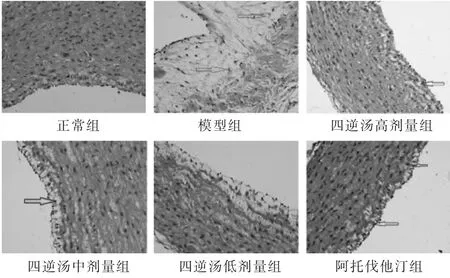
图2 各组家兔主动脉组织形态观察(HE染色,400倍)
2.3 各组家兔血清 IL-6、IL-10、TNF-α、IFN-γ 含量比较 见表2。与正常组比较,模型组IL-6、TNF-α、IFN-γ 含量显著升高(P<0.01),IL-10 显著降低(P<0.01);与模型组比较,四逆汤高、中剂量组及阿托伐他汀组家兔 IL-6、TNF-α、IFN-γ 显著降低 (P<0.05 或P<0.01),IL-10 显著升高(P<0.01),四逆汤低剂量组IL-6、IL-10、TNF-α、IFN-γ 含量与模型组比较, 差异均无统计学意义(P>0.05)。
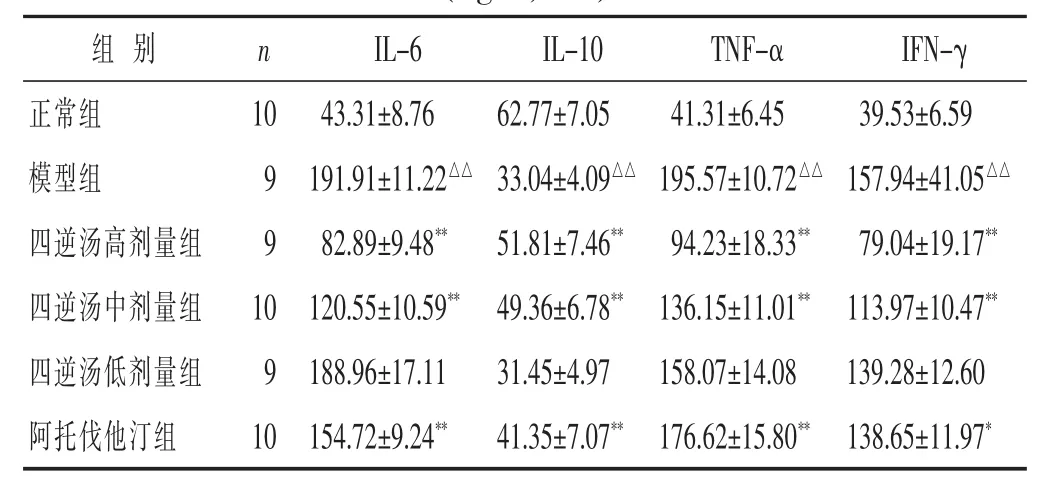
表 2 两组兔血清 IL-6、IL-10、TNF-α、IFN-γ 含量比较(ng/L,x±s)
3 讨 论
动脉粥样硬化可归入中医学“胸痹”“心痛”“痰饮”等范畴。病机为心、脾、肾脏功能虚衰,以致痰浊、瘀血、水湿等病理产物停滞于脉中,阻塞脉道,全身气血运行失常,属本虚标实之病[9]。 如《石室秘录·痰病》认为“肥人多痰,乃气虚也。然补气又不可纯补脾胃之土,当兼补其命门之火”[10],说明补足阳气有助祛除痰瘀之邪,为治疗脂质代谢类疾病开拓新思路。《素问·阴阳应象大论》[11]指出“阳化气,阴成形”,若“阳化气”功能减弱,易气、血、津液运行不畅而变生瘀血、痰饮、水湿等病理产物,以致痰瘀互阻,动脉斑块形成。 《医理真传》[12]谓四逆汤是“回阳之主方也”,君以附子温肾暖阳,补先天欲绝之火种;臣以干姜入脾胃、心经,达温中逐寒、回阳通脉之功,继以甘草,缓其正气,制其毒性。该方配伍药精力专,心脾肾脏之本得以兼顾,则内生病理产物得以祛除。
动脉硬化是血管壁内膜发生纤维组织增生,粥样病变是在动脉内膜处形成斑块,斑块的主要成分是平滑肌细胞、巨噬细胞、胶原纤维和蛋白多糖[13]。关于AS的发病机制,先后有脂质浸润学说、损伤反应学说、炎症反应学说、氧化应激学说等,但目前医学界普遍认为AS是在多种因素作用下,发生病理改变而产生的[14]。
细胞因子是一种低分子量可溶性蛋白质,通过自分泌或旁分泌的方式作用于自身或其他细胞,分为促炎因子和抗炎因子。前者包括IL-6、IL-8、IL-12、TNF-α及近年来新发现的IL-23、IL-17等,主要表现为促炎作用;后者包括IL-4、IL-10、TGF-β等,主要表现为抗炎作用。其中,IL-6、TNF-α是机体产生的一类重要促炎因子,生物活性广泛,在介导炎性反应及参与组织损伤与修复等方面发挥重要作用[15]。IL-6作为早期炎性反应的敏感指标之一,可促进单核/巨噬细胞活化,增强其吞噬杀伤作用[16]。TNF-α能够增强AM的表达、诱导血小板的聚集,介导血管平滑肌细胞增殖和迁移,促进病变进展和斑块形成[17]。TNF-α作为AS炎性反应的标记物,能有效体现炎症活跃程度。IFN-γ是一种重要的免疫活化因子,主要由 Th1细胞和巨噬细胞分泌,可以促进固有细胞的免疫活化,如巨噬细胞、NK细胞。IFN-γ通过对相关炎症介质调节,而诱导泡沫细胞形成,引起内皮损伤及功能降低,导致动脉粥样硬化形成[18]。IL-10 由 CD4+淋巴细胞亚群(Th2)和巨细胞产生,它通过抑制IL-6、TNF-α的分泌,而减少炎性细胞因子的释放以达到抗炎作用[19]。炎症反应与以上各类因子的异常表达有关。
本实验结果表明,在高脂及免疫损失诱导下,模型组 IL-6、TNF-α、IFN-γ 表达颇高,IL-10 表达颇低,四逆汤能降低HLP合并AS模型兔 IL-6、TNF-α、IFN-γ的表达,升高IL-10的表达。从四逆汤对兔血清IL-6、TNF-α、IFN-γ、IL-10的影响可以看出,四逆汤高剂量组效果最显著,其次为四逆汤中剂量组和阿托伐他汀组,效果最低的是四逆汤低剂量组,表明四逆汤对炎性因子的调节具有剂量依赖性。另外,本实验结果中IL-6与IL-10呈负相关,说明IL-6表达水平越高,IL-10表达水平越低,二者之间相互影响。笔者分析AS病变发生机制之一可能是IL-6与IL-10之间比例失衡导致的,提示四逆汤可能通过调节促炎和抗炎细胞因子间的平衡而减轻炎症反应,达到抗动脉粥样硬化的作用。四逆汤抗炎作用的具体机制今后将进一步从炎症反应甚至蛋白表达方面研究。
