转基因甜菜H7-1品系LAMP现场快速检测方法的建立
2018-10-30谌鸿超樊彦莉张舒亚杨捷琳
谌鸿超,蒋 静,郑 江,樊彦莉,张舒亚,杨捷琳
(上海出入境检验检疫局,上海 200135)
甜菜是重要的糖料作物,榨糖后的甜菜粕是重要的动物饲料。随着转基因技术的发展,转基因甜菜种植及应用日益广泛。自2006年转基因甜菜被美国批准商业化种植以来,转基因甜菜在美国和加拿大被广泛种植,2011年转基因甜菜占美国甜菜种植面积的95%,2014年为98.5%,2015—2016年为100%。2016年加拿大甜菜种植也均为转基因甜菜,并被批准用于食用和饲用[1]。目前,商业化种植的转基因甜菜有3个品系,分别为转基因甜菜H7-1(抗草甘膦)、转基因甜菜GTS B77(抗草甘膦)和转基因甜菜T120-7(抗草铵膦),均为抗除草剂。目前大面积种植的是抗草甘膦甜菜H7-1品系,是Monsanto公司产品,转入的外源基因主要有FMV35s、E9 3’、cp4epsps和ctp2[2]。
目前对于转基因生物安全性还有争议,欧盟、日本、中国出台了转基因产品标签法规,对转基因产品实施标识。根据我国农业部发布的《进口用作加工原料的农业转基因生物审批情况》,我国仅批准了转基因甜菜H7-1品系用作加工原料,该品系的进口有效期截止到2018年5月8日[3]。质检总局在2016年发布《进口美国甜菜粕检验检疫要求的公告》(2016年第97号),自2016年9月起允许美国甜菜粕进口[4]。根据法规及相关进出口要求,张舒亚等[2]建立了转基因甜菜H7-1的实时荧光PCR检测方法,也建立了转基因甜菜H7-1的PCR检测方法标准[2,5]。PCR方法由于具有高特异性、高灵敏度被广泛应用,然而该方法需配置高精尖仪器,技术要求较高,不适用于现场快速检测。目前口岸一线和企业自控需要有简便快速、不需精密仪器和专业人员的现场快速检测方法。
环介导等温扩增(Loop-mediated isothermal amplification,LAMP)技术是近年来发展的一种新颖的和较成熟的等温核酸扩增技术。与PCR方法相比,LAMP不需要热循环仪(PCR仪),且LAMP反应中产生大量的副产物——白色焦磷酸镁沉淀,扩增产物通过肉眼观察或浊度计即可判定结果。该方法操作简单,易于推广,对设备和检测人员要求较低,更适用于口岸简易实验室和进出口企业,可实现快速、准确的检测,该技术并已在核酸的科学研究、病原微生物鉴定等领域得到了广泛应用[6-9]。本研究拟将LAMP技术应用于转基因甜菜H7-1的检测,以期建立转基因甜菜H7-1的快速检测方法。
1 材料与方法
1.1 试剂与仪器
试剂:Bst DNA polymerase large fragment,New England Biolabs公司;甜菜碱(Betaine)、MgCl2,Sigma公司;dNTPs,宝生物工程(大连)有限公司;SYBR Green I 荧光染料,Invitrogen公司;E.Z.N.A.® HP Plant DNA Kit,OMEGA公司;引物由生工生物工程(上海)有限公司合成。转基因甜菜H7-1样品、其他植物样品及加工产品为实验室保留样品。
仪器:离心机;漩涡混合器;LAMP实时浊度仪;LA-320C,日本荣研化学株式会社;BioPhotometer plus核酸蛋白含量测定仪,德国Eppendorf公司。
1.2 引物设计
根据转基因甜菜H7-1品系外源基因和甜菜边界序列设计一套特异性引物,包括:
上游外引物(F3):AACACTTAGCTTGGGACAA;
下游外引物(B3):TGATTGAACCCAATCTGGA;
上游内引物(FIP):CCGTAATGAGAAGAGAGAAACATCATATTTCTTAATTTTTGCAGGCGA;
下游内引物(BIP):TCTGGGTGGCTCTAACTATTTACATTTT-CTCAAGCTTGATGGGGAT;
上游环引物(LF):AACACAAAATGCTCATAACAGCCAC;
下游环引物(LB):CTGAAGGCGGGAAACGACAA。
外引物扩增片段长度为237 bp。
1.3 样品制备及DNA提取
取100%转基因甜菜和0%转基因甜菜标准品(购买自IRMM),按质量比将上述两种样品混合成转基因成分质量分数为5%、1%、0.5%的待测样品。
样品DNA的提取使用E.Z.N.A.®HP Plant DNA Kit,-20℃储存备用。
1.4 体系建立和引物筛选
初步确定25 μL的LAMP反应体系:FIP和BIP各1.6 μmolL,F3和B3各0.2 μmolL,LF和LB各0.8 μmolL,20 mmolL Tris-HCl(pH 8.8),10 mmolL KCl,8 mmolL MgSO4,10 mmolL (NH4)2SO4,0.1% Tween20,1 molL甜菜碱,6 mmolL MgSO4,1.6 mmolL dNTP,8 U Bst大片断DNA聚合酶,2 μL DNA引物。用100%转基因甜菜H7-1标准品作为模板进行引物的初步筛选,同时以无菌水作为阴性对照。使用LAMP浊度仪观察,63℃恒温反应60 min,最后80℃下保温5min结束反应,根据出峰时间及阴阳性符合率初步筛选引物。
1.5 特异性试验
选择24个植物转基因品系,分别为:转基因甜菜H7-1(A1)、GM棉花MON531(A2)、GM大豆GTS40-3-2 (A3)、GM大米Bt63 (A4)、GM油菜MS8×RF3(A5)、转基因玉米GA21(A6)、转基因玉米MON810 (A7)、转基因玉米MM88(A8)、转基因玉米MON863(B1)、转基因玉米MON88017(B2)、转基因玉米NK603(B3)、转基因玉米MIR604(B4)、转基因玉米MON89034(B5)、转基因玉米CBH351(B6)、转基因玉米BT11(B7)、转基因玉米BT176(B8)、转基因玉米EVENT98140(C1)、转基因土豆EH92-527-1(C2)、转基因大豆DP305423(C3)、转基因大豆DP356043(C4)、转基因大豆GTS40-3-2(C5)、转基因水稻‘科丰6号’(C6)、转基因水稻‘科丰8号’(C7)、转基因油菜GT73(C8)。
使用上述建立的LAMP反应体系进行试验,评估其特异性,使用LAMP浊度仪观察结果。
1.6 灵敏性试验
使用建立的LAMP反应体系对转基因甜菜H7-1品系成分质量分数为0%、0.1%、0.5%、1%的样品进行检测,评估其灵敏度。
1.7 稳定性试验
分别对4个不同质量分数(空白样品0%、添加水平0.5%、1%、5%)的转基因甜菜H7-1样品进行检测,每个样品重复20次,评估方法的稳定性。
1.8 一致性试验
为验证方法的准确性,选取36份样品作为待测样品,包括非转基因甜菜、其他植物样品及加工产品、非目的转基因成分的其他转基因样品,转基因甜菜H7-1及含转基因甜菜H7-1成分的植物模拟样品及加工产品。使用建立的转基因甜菜H7-1实时浊度LAMP检测和显色法LAMP检测,并使用欧盟发布的官方检测方法荧光PCR法进行验证,比较检测结果与荧光PCR方法结果的一致性。

CH1—2:阴性对照(非转基因甜菜);CH3—4:阳性对照(转基因甜菜H7-1)图1 转基因甜菜H7-1品系引物LAMP筛选结果Fig.1 LAMP screening results of primers for genetically modified sugar beet H7-1
2 结果与分析
2.1 引物筛选和体系优化
结果显示,设计的LAMP引物具有较好的特异性,转基因甜菜H7-1标准品具有明显扩增,而阴性对照未出现扩增(图1)。在引入环引物后,缩短了反应时间,初步确认后续试验反应时间为60 min。
2.2 LAMP检测方法的特异性试验
对24个植物转基因品系进行LAMP反应体系特异性验证,除转基因甜菜H7-1品系(A1)出现扩增外,其余样品均未出现扩增(图2),表明该方法具有特异性。
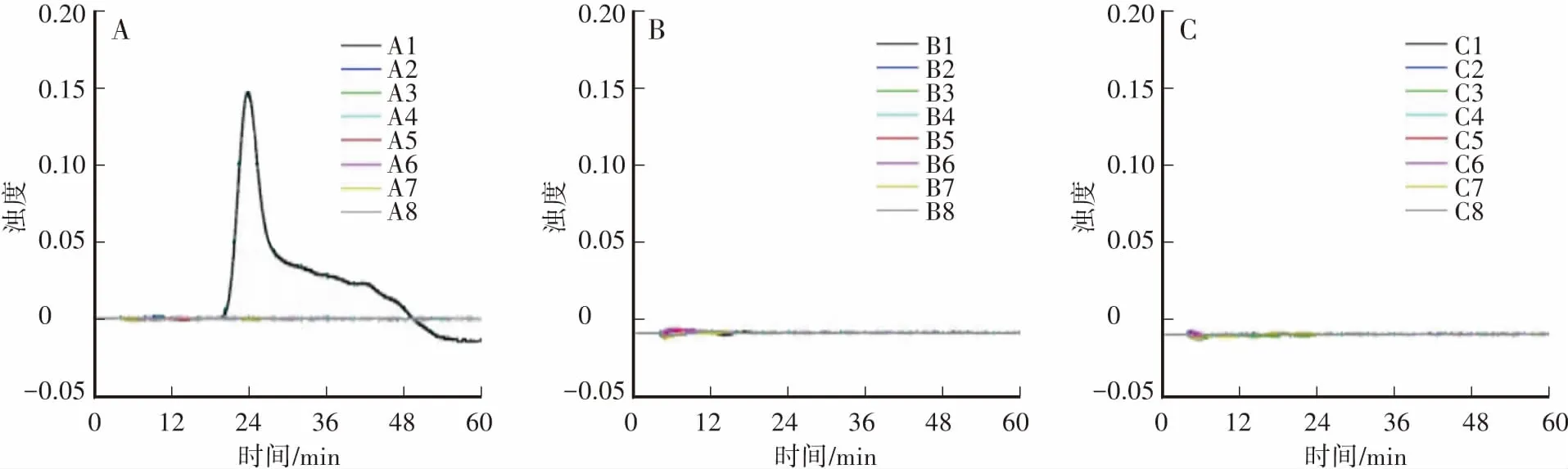
图2 转基因甜菜H7-1品系LAMP特异性检测Fig.2 Specificity detection of genetically modified sugar beet H7-1 by LAMP

D1:阳性对照;D2:5%转基因甜菜H7-1;D3:1%转基因甜菜H7-1;D4:0.5%转基因甜菜H7-1;D5:0.1%转基因甜菜H7-1;D6:0%转基因甜菜H7-1图3 转基因甜菜H7-1品系的实时浊度LAMP检测灵敏度Fig.3 Sensitivity detection of genetically modified sugar beet H7-1 by real-time turbidity LAMP
2.3 LAMP检测方法的灵敏性试验
实时浊度LAMP检测结果显示:质量分数5%、1%和0.5%的转基因甜菜H7-1样品均出现扩增,0.1%和0%转基因甜菜H7-1样品未出现扩增,表明该方法体系的检测下限为0.5%(图3)。显色法LAMP结果显示:质量分数1%、0.5%的转基因甜菜LAMP反应呈现绿色,检测为阳性;0%、0.1%转基因甜菜样品LAMP反应呈黄色,检测为阴性(图4)。由此可见,显色法LAMP可以检测出转基因质量分数低至0.5%的转基因甜菜H7-1品系。
2.4 LAMP检测方法的稳定性试验
对质量分数5%、1%、0.5%和0%的转基因甜菜H7-1样品进行LAMP检测,并重复20次。结果显示,质量分数5%、1%和0.5%的转基因甜菜H7-1反应呈绿色,0%转基因甜菜H7-1反应呈黄色,LAMP检测准确率达到100%(图5),表明该方法检测甜菜中甜菜H7-1品系转基因成分稳定性较好。
2.5 LAMP检测方法与实时荧光PCR检测方法的一致性试验
结果显示,两种方法对于特异性检测结果一致。本研究建立的转基因甜菜H7-1实时浊度LAMP检测和显色法LAMP检测,对质量分数0.5%的转基因甜菜H7-1能特异性扩增,而低于0.1%的转基因甜菜H7-1及其他非目的基因转基因产品不出现扩增,而实时荧光PCR方法能检出质量分数0.1%的转基因甜菜H7-1样品(表1)。

(续表1)
3 讨论
转基因甜菜H7-1品系在美国和加拿大分别于2006年和2008年被批准种植,并已在美国、加拿大、澳大利亚、哥伦比亚、智利、中国等国被批准食用和(或)饲用,但转基因食品的安全性问题一直备受争议。欧盟、日本、加拿大、澳大利亚、中国等实施了转基因食品标识法规。为应对相关法规要求,我国建立了相关转基因成分检测方法标准。对转基因成分的检测标准,基本上是基于蛋白质的ELISA检测方法和基于基因的PCR检测方法,这需要使用较专业和昂贵的检测设备,并需要专业人员操作。随着技术的发展以及企业和一线对于现场快速检测的要求等,目前急需要现场能快速和便捷检测的技术和方法。本试验利用LAMP技术建立转基因甜菜H7-1品系的快速检测方法,通过体系优化,对该方法的特异性、敏感性、稳定性进行了验证,结果表明建立的转基因甜菜H7-1的LAMP检测方法特异性强,稳定性好,灵敏度高,可检出转基因含量高于质量分数0.5%的转基因甜菜H7-1品系;通过对特定样品的检测,检测结果与欧盟规定的荧光PCR方法结果一致,可用于转基因甜菜H7-1的快速检测,能够满足法规要求,建立的检测方法可适用于口岸一线检验检疫需要以及企业的自控检测要求。然而,目前建立的LAMP检测方法只能用于定性检测,不能定量,使用LAMP检测技术进行定量检测需要进一步研究。
