代谢组学技术在植物生态学研究中的应用
2018-10-29李金霞
王 瑛,李金霞
(1.甘肃省环境监测中心站,甘肃 兰州 730020; 2.甘肃农业大学资源与环境学院,甘肃 兰州 730070)
生物机体是一个多因素综合调控的、复杂的动态体系,机体需要不断调节自身复杂的代谢系统,从而维持机体内部及与外界环境的动态平衡才能够完成从基因到性状的生物信息传递[1]。研究环境因子的变化对植物个体的影响及植物的响应机制是植物生态学的一项重要内容。随着分子生物学技术的进步及一些高通量生物信息技术研究手段的迅速发展,人们对植物响应环境变化的机理和过程有了更加深入的探索[2]。基因组学和转录组学考察遗传多样性和基因表达;蛋白质组学能够发现新基因,并监测代谢途径及重要蛋白对环境变化的响应。但是,这些基于分子生物学原理的试验技术往往受到分子标记和检测技术的局限,难以在研究对象的基因型和表型、数量和功能间建立直接关联[3]。而代谢组学的研究结果则可揭示出基因组、转录组和蛋白组受遗传或环境因素影响后的变化规律,更接近细胞或生物的表型,是生物机体生理和生化功能状态的直接体现[2,4]。与此同时,由于代谢组学研究平台非靶向性的特点,可以让人们对植物的初始代谢和次生代谢物质进行全面综合的了解,因此,代谢组学对于植物生态学研究具有重要意义[5]。为此,将在介绍代谢组学的概念、来源、研究策略和分析流程的基础上,论述代谢组学技术在植物与生物和非生物环境相互关系研究中的应用现状,分析代谢组学技术在植物生态学研究中的进展趋势,展望代谢组学技术与其他生物学技术相结合后在植物生态学领域的应用前景。
1 代谢组学的概念、来源及研究策略
1.1 概念和来源
代谢组学(Metabolomics)的概念最先由英国帝国理工大学的Nicholson教授领导的研究小组于1999年正式提出[6-7]。所谓代谢组(Metabolome)具体是指细胞、器官和生物体内一些参与生物体新陈代谢,维持其正常生长和功能的相对分子量小于1 000的内源性小分子化合物的集合[7]。代谢组学主要以信息建模与系统整合为目标,以组群指标分析为基础,以高通量检测和数据处理为手段的一个系统生物学分支,是通过考察生物体系(细胞、组织或生物体)受刺激或干扰后(如基因变异或环境变化),其内源代谢产物的种类、数量的变化或随时间的变化规律一门学科[6-9]。
代谢组学是继基因组学、转录组学、蛋白质组学后出现的一个新的学科。有说法认为,基因组学(Genomics)和转录组学(Transcriptomics)揭露了什么可能会发生或即将发生,蛋白质组学(Proteomics)阐明了是什么促使了发生,而代谢组学则告诉我们什么确实发生了。转录组学和蛋白质组学因不能预测基因功能而遭受批判[6]。与转录组学比较,代谢组学的优点在于:1)基因和蛋白质表达的微小变化会在代谢物上得到放大,从而使检测更加容易;2)代谢组学的研究不需要建立全基因组测序及大量表达序列标签(expressed sequence tag EST)的数据库;3)代谢物的种类要远小于基因和蛋白质的数目;4)研究中采用的技术更通用[8,10],是因为给定的代谢物在每个组织中都一样[11]。由于代谢组学提供的大量直接和有价值的生物化学信息可以用作监测和评估基因功能,从基因组学、转录组学、蛋白质组学和代谢组学4个水平综合分析有助于更加全面、真实地了解植物对外界环境干扰的生物化学过程和生物学响应机制[12]。因此,代谢组学已成为植物生态学研究的有力工具。
1.2 研究策略
代谢组学的研究策略主要分靶向性代谢组学(Targeted metabolomic)和非靶向性代谢组学(Untargeted metabolomic)。靶向性代谢分析主要是指对已知化学结构的特定代谢物进行定量分析[10],典型的是关注一种或几种相关的代谢通路[11]。常用于药代动力学研究,衡量某种疗法或基因修饰的效果。目前建立的最有效的分析系统是色谱与三重四极杆(triple quadrupole QQQ)、飞行时间(time of flight TOF)或四极杆离子阱(quadrupole trap Q-Trap)等质谱串联,用多反应检测器(multiple reaction monitoring MRM)进行检测[12]。靶向性代谢分析的局限性在于可能会错过对一些重要的代谢变化信息的监测。而非靶向性代谢组学范围宽泛,目标是从生物样本中同时分析尽可能多的代谢物。非靶向性代谢组学分析的色谱可选择与飞行时间(TOF)、静电轨道阱(Orbitrap)、离子阱飞行时间(IT-TOF)、四极杆-飞行时间(Q-TOF)等质谱联用[12]。
2 代谢组学的技术平台及分析流程
2.1 技术平台
当前代谢组学的主流检测技术包括核磁共振(nuclear magnetic resonance,NMR)、液相色谱质谱联用(liquid chromatography-mass spectrometry,LC-MS)、气相色谱质谱联用(gas chromatography-mass spectrometry,GC-MS)、毛细管电泳质谱联用(capillary electrophoresis mass spectrometry,CE-MS)[13]、同位素标记质谱[14]、傅里叶变换红外光谱质谱联用[15]、库伦分析、紫外吸收、荧光散射[16]等多种方法[17]。不同的检测技术平台,在检测对象、灵敏度、分离效能和分析速率及准确性等方面各有优势和不足(表1)。其中质谱(MS)和核磁共振(NMR)是目前植物生态代谢组学研究中应用最广泛的两大技术平台。

表1 植物生态代谢组学主要检测技术平台Table 1 Main analytical techniques used in plant ecological metabolomics
GC-MS,LC-MS,NMR,CE-MS分别表示气相色谱质谱联用、液相色谱质谱联用、核磁共振和毛细管电泳质谱联用;下表同。
GS-MS, gas chromatography-mass spectrometry; LC-MS, liquid chromatography-mass spectrometry; NMR, nuclear magnetic resonance; CE-MS, capillary electrophoresis mass spectrometry, similarly for the following tables.
2.2 分析流程
目前,代谢组学的分析流程包括样品的采集和前处理、代谢组数据的采集和预处理、数据分析、标志物识别和代谢途径分析等步骤(图1)[1]。植物代谢物样品制备分为组织取样、匀浆、抽提、保存和样品预处理等步骤[15]。对获得的样品中所有代谢物进行分析鉴定是代谢组学研究的关键步骤,也是最困难和多变的步骤。与原有的各种组学技术只分析特定类型的物质不同,代谢组学分析对象的大小、数量、官能团、挥发性、带电性、电迁移率、极性以及其他物理化学参数差异很大[18],单一的分离分析手段很难保证对它们进行无偏向的全面分析。一般根据样品的特性和试验目的,可从色谱、质谱、核磁共振、红外光谱、库仑分析、紫外吸收等分离分析手段中选择一种或多种组合方法。
样品成分经上述技术平台分析鉴定后,可得到海量的多维元数据。为了充分挖掘元数据中的有用信息,需要对所获得的数据进行一系列相应的整合处理,这也是代谢组学研究中十分关键的一步。在代谢组学研究中,通常采用模式识别和多维统计分析等方法,如无监督的主成分分析(principal component analysis,PCA)、非线性映射(nonlinear mapping,NLM)、聚类分析(hierarchical cluster analysis,HCA)和有监督的偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)、人工神经元网络(artificial neural network,ANN)以及近年来常用的支持向量机(support vector machine,SVM)等,从这些大量的数据中进行两类或多类的判别分类,从而为数据降维,使它们更易于可视化和分类[10-11]。

图1 代谢组数据获取及与基因组、转录组、蛋白组相关联分析的流程图Fig. 1 Proposed scheme of metabolome data acquisition and correlation of metabolome, proteome, and transcriptome
3 代谢组学技术在植物生态学研究中的应用现状
3.1 在植物与非生物环境关系研究中的应用
植物的正常生长、发育和繁殖需要光、水、碳和矿质营养等元素。不适宜的环境包括极端高温或低温,盐渍化和干旱等会形成一个复杂的综合胁迫条件,植物可以对这些胁迫条件感知和作出相应的反应,并通过多种途径来保证它们的存活[19]。
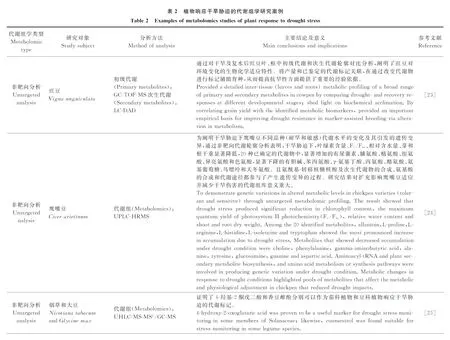
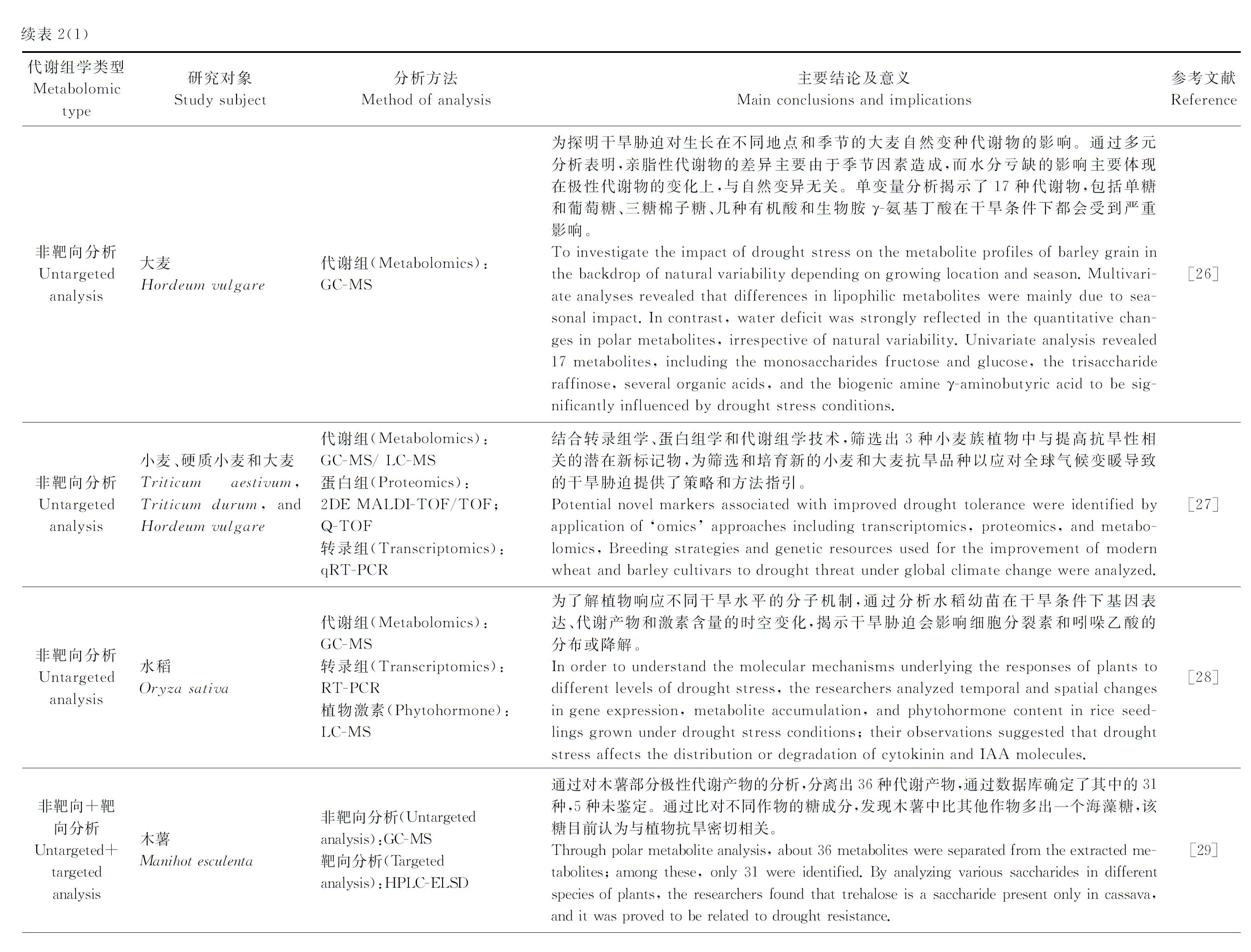
3.1.1水分胁迫 水分是影响植物生长发育的重要因子之一[1]。干旱已成为限制农业生产的一个全球性问题。植物可在分子、细胞和生理各个水平对干旱作出相应[20]。研究水分亏缺对植物的生理伤害及植物的响应机制,无论在理论上还是实践中都具有重要的意义[21-22]。近年来植物响应干旱胁迫的代谢组学研究案例如表2所列。
3.1.2温度胁迫 温度是影响植物生长发育的重要环境因子。温度三基点,即最低温度、最适温度和最高温度是植物生长发育最基本的温度指标。当温度过低或过高以致对植物产生有害效应均称为温度胁迫。过高温度称为热胁迫,相反,过低温度则称为冷胁迫[21]。在极端温度胁迫下,植物体内会发生一系列复杂的生理、生化变化来响应外界环境的变化[39-40]。
有学者将生长在两个近理想温度(25和35 ℃)下的酿酒葡萄(Vitisvinifera)品种Shiraz和Cabernet Sauvignon的植株叶片的代谢组学和生理学响应进行了对比分析,发现当生长在25 ℃下时,两个品种叶片的生长速率和光合特性都基本相同,但当生长在35 ℃下时,Shiraz的呼吸速率和非光化学猝灭都相应增强,光合速率和生长量都相应减少。相反,Cabernet Sauvignon的光合活性和生长量则相对稳定。在35 ℃下生长时,两个品种中的二糖(棉子糖、海藻糖和核酮糖)的积累都相应增加,而单糖(葡萄糖、果糖和蔗糖)的含量却相应减少,且Shiraz比Cabernet Sauvignon表现得更加明显。这一研究结果说明了葡萄生长的理想温度依品种不同而变,从而对生长在不同温度下的不同葡萄品种植株的代谢响应变化进行了初探[41]。


另有学者对高温在棉花(Gossypiumspp.)花期和铃期对棉花纤维中糖代谢和纤维素合成的影响进行了研究后发现,在温度升高后,棉花纤维中蔗糖合成酶和酸碱转换酶的活性降低,蔗糖含量减少,而蔗糖磷酸化酶的活性增强,愈伤葡聚糖的含量增加[42]。Chen等[43]对坛紫菜(Porphyrahaitanensis)中脂类代谢物对短期高温胁迫的响应进行研究后鉴定出了39种脂类标记物,为进一步了解坛紫菜中脂类代谢物对高温胁迫的响应机制提供了思路。同样,Gall[44],Kiet和Nose[45]和Chen[46]等分别对芒草(Miscanthassinensis)代谢组、抗辐射水稻(Oryzasativa)品种(32R)根部阳离子代谢组和冠盘藻脂类代谢组对低温胁迫的响应开展了研究。
3.1.3盐碱胁迫 土壤盐渍化已成为全球重大资源与环境问题。盐胁迫对植物生长的影响主要表现在离子毒害、渗透胁迫等。植物受到盐胁迫后首先会迅速启动相关基因,进行转录调控,进而合成相应蛋白质来控制代谢物合成和离子转运以调节渗透平衡[47-48]。近年来植物响应盐碱胁迫的代谢组学研究如表3所列。
3.1.4重金属胁迫 随着环境污染程度的加剧,植物除受到上述一系列常见的自然环境因子胁迫外,还会受到铜、锌、镉、铬等重金属造成的污染因子胁迫。近年来,植物代谢组学的研究虽然在逐年增多,但是在植物对有毒物质的响应机理方面的研究依然较少[63]。
有研究[63]将日本水稻品种(Oryzasativavar.japonica)暴露于浓度从10到1 000 μmol·L-1的重金属[Cd(Ⅱ)和Cu(Ⅱ)]后收割,从水稻地上部分提取了代谢物质并将高效液相色谱(HILIC TSK gel amide-80column)和四极杆轨道阱(Q-Exactive)质谱联用进行了非靶向性分析,共检测出了112种代谢产物,其中97种被鉴定和确认。通过对检测出的代谢物质的途径分析表明,植物对两种金属的响应途径存在潜在的相似性,尽管从表面上看,Cd(Ⅱ)的伤害较严重。在两种金属胁迫下,水稻次生代谢物质及氨基酸类、嘌呤类、含碳化合物和甘油酯类的代谢途径都受到了影响,生长和光合能力也相应减弱,同时还诱导了防御机制来减少细胞损伤。
营养学研究表明,土壤中锌的浓度可以影响茶树根部离子的吸收运输。从而影响P、S、Al、Ca、Fe和Cu在叶片和根部的分布。Zhang等[64]通过代谢组学研究证实,缺Zn会影响茶树碳水化合物的代谢,而Zn过量则会影响黄酮类化合物的代谢。缺Zn和Zn过量都会导致烟酰胺水平降低,加速烟酰胺腺嘌呤二核苷酸(NAD)降解,从而降低能量代谢。同时,通过营养元素和代谢物的关联分析说明茶叶中Zn含量与有机酸、含氮代谢物和一部分碳水化合物等的含量呈正相关关系,而与次生代谢物和另外一部分含碳化合物呈负相关关系。同时,代谢物之间的关联分析表明,有机酸、糖类、氨基酸和黄酮类化合物在茶叶受Zn胁迫后的代谢调控中扮演着主要角色。
3.1.5辐射胁迫 20世纪以来,随着大气中氟氯烃以及其他氮化物的急剧增加,导致臭氧层减少,到达地球表面的太阳紫外线辐射(ultraviolet UV)随之增加。其中 UV-B(ultraviolet-B,280-320 nm)波段对植物有强烈的生物化学效应,可损伤氨基酸残基,导致氨基酸合成中的蛋白质和酶失活;中波UV-B辐射可影响次生代谢产物合成的基因表达,导致萜类、生物碱、酚类及含氮化合物等次生代谢物质增加,对植物造成胁迫[65-66]。
松树是重要的速生木材,Pascúal等[67]基于当前的紫外辐射模型,模拟未来辐射剂量随时间变化的过程,结合光合参数和基因表达,将辐射松(Pinusradiata)的代谢组和蛋白质组数据通过偏最小二乘法回归分析后表明,辐射松早期对辐射胁迫的响应是通过降低光系统活性和电子传递速率,同时积累光保护物质和增强光呼吸来阻止紫外辐射造成的伤害。除此之外,辐射松还通过调控初生代谢来应对活性氧减少而造成的氧化压力。该研究还发现了与辐射松响应紫外线辐射胁迫后的信号转导、调控和管理等相关的新的蛋白激酶和蛋白酶。从而揭开了辐射松响应辐射胁迫的一个复杂的分子作用网,加深了目前对于松树适应紫外线辐射胁迫机制的了解。
为了探明红豆杉叶片在超强紫外线(ultraviolet-A,UV-A)照射后响应和防御的分子机制,有学者[68]将红豆杉叶片在UV-A辐射前后的蛋白质组学和基于GC-MS的代谢组学数据进行了关联分析。结果发现,在高强度的UV-A辐射后,红豆杉叶绿体受到了损伤,光合作用、糖酵解、次生代谢、蛋白质的合成、降解及活性等相关系统都发生了明显的变化。在UV-A辐射后,光系统Ⅱ(PSⅡ)和光系统Ⅰ(PSⅠ)中分别有47种和6种蛋白发生了改变,说明PSⅡ对于UV-A辐射较PSⅠ更加敏感。此外,随着糖酵解相关的4种关键酶的增加和糖酵解过程的增强,次生代谢作用增强。1-脱氧-D-木酮糖-5-磷酸还原异构酶(DXR)和4-羟基-3-甲基-2-邻苯基二磷酸还原酶在UV-A辐射后显著增加,促进了紫杉醇的合成。这项研究表明,短期的高强度UV-A辐射可以刺激植物的胁迫防御系统并提高紫杉醇的含量。



3.1.6其他胁迫 植物除受到上述各种胁迫外,还会受到如臭氧(O3)胁迫、二氧化碳胁迫、营养胁迫、有机污染胁迫[21]等其他多种形式的逆境胁迫[16],代谢组学技术通过分析植物受到各种胁迫后代谢物的变化均可为探究植物对逆境的响应机制提供依据。
Geng等[69-70]模拟CO2浓度随着时间的推移逐渐升高的过程,对甘蓝油菜(Brassicanapus)叶肉细胞和保卫细胞对CO2浓度升高后的代谢组学响应进行了分析和比较,通过对比在高浓度CO2诱导的气孔关闭和低浓度CO2引起的气孔开放过程中有机酸、蔗糖、茉莉酸和各类生长激素等的变化,探明了茉莉酸类化合物在高浓度CO2诱导气孔关闭过程中的信号传导作用;也有学者[71]结合代谢组学、蛋白质组学和转录组学的方法,对水稻幼苗叶片响应O3胁迫的分子机制进行了研究,结果表明臭氧胁迫可以激发叶片细胞中一系列基因、蛋白质和代谢物的变化。Huang等[72]通过代谢谱分析,对生长在低P环境中大麦(Hordeumvulgare)的C和N的代谢变化进行了分析,为研究低P环境对大麦属植物C和N代谢的影响探索出新的思路。
3.2 代谢组学在植物与其他生物相互作用关系研究中的应用
代谢组学技术近十年来在植物与昆虫相互关系的研究中已应用广泛,也为当前研究植物与其他生物的相互关系提供了借鉴[73]。
3.2.1植物与食草动物 应用代谢组学技术研究植物与食草动物相互作用的关系多数集中在运用非靶向代谢组学策略来发现植物中能够抵制食草动物侵害的次生代谢物质[74]。这一方法一方面可以鉴定和发现具有不同抗性的基因型和植物品种;另一方面,通过对比这些基因型植物代谢轮廓,可直接发现与抵抗机制相关的代谢标志物。有研究[75]应用代谢组学技术探究了白杨(Populusdeltoids)抵制美国白蛾(Hyphantriacunea)侵害的机理。通过对7个对美国白蛾有不同抗性的白杨品种代谢轮廓的对比和相关性分析,发现白杨中类苯基丙烷(phenylpropanoid)的合成在其抵御白蛾的侵害过程中起到了关键的作用。为进一步揭示白杨抗美国白蛾的分子机制奠定了基础,同时还为进一步选育抗白蛾侵害的白杨品种提供了生物标记。同时,Capitani[74]、Arany[76]、Kuzina[77]和Leiss等[78-80]也通过代谢组学技术开展了植物与食草动物相互作用关系的研究。
植物在受到食草动物侵害不仅会在次生代谢物层面,初始代谢物也会发生变化。非靶向代谢组学技术同样可以应用于研究植物在受到食草动物侵害后发生的初始代谢物的变化[81-82]和植物与昆虫相互作用后植物防御信号传导途径的研究[83-85]。此外,应用非靶向代谢组学技术同时分析受侵害植物和食草动物代谢物变化的研究也有少量报道[86]。
3.2.2植物与植物 植物间的相互作用是构建植被群落的重要因素,是群落生态学研究的中心内容之一[87]。目前应用代谢组学分析技术研究植物与植物间相互关系的报道较少。Gidman等[88]基于傅里叶变换红外光谱技术(Fourier transform infrared spectroscopy,FT-IR)的代谢指纹分析结合化学计量学和聚类分析手段,研究了单子叶植物短柄草(Brachypodiumdistachyion)和双子叶植物拟南芥(Arabidopsisthaliana)相互竞争后各自的代谢变化。42 d的生长指标显示,两个物种在竞争条件下生长状况都发生了变化。而代谢指纹分析数据则显示,在拟南芥的竞争压力下,短柄草的代谢组发生了明显的变化,而拟南芥各组织中的代谢物却没有明显的变化。此项研究为探明植物在与其他生物相互作用后的总体代谢轮廓提供了借鉴途径,同时证明FT-IR技术适合于靶向性代谢分析前的快速筛选。
3.2.3植物与微生物 应用代谢组学技术研究植物与微生物相互作用关系的报道相对较多,多集中在植物与病原菌相互关系的研究。植物受到病原菌的侵染后会产生自身的免疫应答反应,代谢物在这种免疫反应中扮演着非常重要的角色[89-90]。
Sade等[91]将GC-MS和LC-MS技术结合,通过对比分析抗性品种和易受侵染品种中的代谢组和转录组的变化,对番茄(Solanumlycopersicum)响应黄化曲叶病毒侵染的机理进行了的探究,结果发现,番茄植株在受到黄化曲叶病毒侵染后,初生代谢物组和次生代谢物组都发生了不同形式的变化,显示出不同的调控途径,且在抗性品种中水杨酸的合成对调节植株的抗性起到了重要作用。该研究对番茄响应黄化曲叶病毒侵染的代谢途径有了更深入的了解。He和Wu等[92]运用热解场电离质谱(pyrolysis-field ionization mass spectrometry Py-FIMS)技术对小麦(Triticumaestivum)根际土壤溶液中植物和微生物间相互作用产生的代谢物进行了分离和鉴定。Han和Micallef[93]运用气相色谱-飞行时间质谱(GC-TOF)技术,通过对比不同番茄品种各器官表皮的代谢物和分泌液的变化及在其表皮上寄生的肠道沙门氏菌种群的数量和生长状况的变化,发现植物表皮的代谢环境对沙门氏菌的生长和寄生效率有重要的影响。这一方法对了解人体病原菌与植物之间的相互关系提供了新的途径,同时为寻找安全培养微生物的作物品种提供了新的策略。
寄生线虫侵害是许多作物减产的一个重要原因[94]。Hofmann等[95]通过代谢轮廓分析和基因靶向表达分析,探明了拟南芥受线虫侵染后局部和整体的代谢响应机理,为探索植物抵抗线虫侵染的代谢调控机制开辟了新的途径。Eloh等[96]首次应用GC-MS技术对根结线虫(Meloidogyneincognita)侵染两个月后的番茄植物进行了非靶向代谢指纹分析,并通过主成分分析法和正交投影结构判别法分析发现丙氨酸、苯丙氨酸、泛酸盐和辅酶、甘氨酸、丝氨酸、三氨酸及可溶性糖的代谢在番茄受到线虫侵染后都发生了转变,这项研究表明代谢组学方法在识别被线虫侵染植株方面有足够的敏感性和特异性。Scandiani等[97]对阿根廷大豆(Glyciremax)猝死综合症(SDS)的主要病原-南美大豆猝死综合症病菌(Fusariumtucumaniae)侵染初期的根部代谢轮廓进行了分析,结果表明易受侵染植株根部氨基酸的积累是侵染早期的主要特征,同时证明了基于GC-MS的代谢组学技术比较适用于大豆对SDS的快速表征检测。
4 展望
随着代谢组学研究技术和数据处理方法的进步及其在生态学分支学科中应用的日益深入,使得植物生态学的研究不再局限于关注某一基因或蛋白质的分子生物学变化,不再单纯研究某一代谢物组或某一代谢路径的生态学响应,而是飞跃到对整体或者某个层面的海量代谢物同时研究的高度,突破了分析层面窄、数据信息不足的限值[5,12]。同时,随着超高效液相色谱(UPLC)、三重四极杆(QQQ)质谱、飞行时间(TOF)质谱等高灵敏度、高分辨率分析检测技术的迅猛发展和广泛应用,代谢组学技术已成为植物生态学研究的重要平台,使得多角度、多层次、全方位了解隐藏在生物样本中特定组分的动态变化规律变得更加可能。然而,每一个检测技术都有其优缺点,各层面的“组学”都有其局限性,因此,将多种分析检测技术如NMR、GC-MS、LC-MS等结合应用,制定一套代谢组学的标准(包括方法、信息和数据库),同时将代谢组学分析数据与其他“组学”层面的数据进行整合[11],从而对植物响应外界环境变化的机理进行更全面的、更深层的探索,这将是未来植物生态代谢组学的研究热点。
目前,国内外关于植物生态代谢组学的研究多数停留在实验室阶段,通过人为控制一种或两种环境因子的胁迫条件来分析植物的代谢组变化,这些实验室人工创造的环境与植物生存的自然环境不尽相同。自然环境是一个多变的复杂系统,植物生存其中常常会同时受到多重不利因素的影响,在多重不利因素影响下的代谢应激机制是否与实验室人工环境中的研究结果一致尚不知晓[8]。因此,未来植物生态代谢组学研究的重点应该转向自然环境,多收集一些野外研究的基本数据,如生长、密度、繁殖等,将野外大田数据与实验室高通量的“组学”信息相结合,实现生物个体代谢网络和生态系统过程与功能的模型解释。
