心律植入装置感染的相关研究及现状
2018-10-27王轶童综述李学斌审校
王轶童 综述 李学斌 审校
(1.大连医科大学附属第一医院心内科,辽宁大连116011;2.北京大学人民医院心内科,北京100044)
自1958年第一台植入性起搏器于瑞典问世以来,随着植入装置的性能及其设计制造生物工程技术的不断提高,心律植入装置(cardiac implantable electronic device,CIED)[包括起搏器、埋藏式心脏复律除颤器(implantable cardioverter defrillator,ICD)、心脏再同步化治疗(cardiac resynchronization therapy,CRT)、植入式Holter]已广泛用于预防和治疗缓慢性心律失常、快速性心律失常(快速性心房颤动、室性心动过速、心室颤动)及非心电疾患(肥厚型心肌病、扩张型心肌病等)。感染是起搏器植入术后常见的并发症之一,发生率为2%~6%[1-3]。在CIED不断广泛应用的背景下,其植入感染造成的再住院率、死亡率及医疗费用的增加也越来越受到关注。现对CIED感染发生的发病机制、临床诊断、高危因素及处置方法进行综述,旨在进一步提高对起搏器治疗感染的认识,能更好地预防并处理CIED植入感染。
1 CIED感染的病理生理机制
CIED感染包括起搏器囊袋本身的感染、播散至静脉系统电极的感染、侵犯心内膜的菌血症和感染性心内膜炎。CIED感染病原体最常见的是细菌,其中85%为葡萄球菌感染,凝固酶阴性的葡萄球菌最多见,约占68%,主要为表皮葡萄球菌,金黄色葡萄球菌约占23%[4]。关于CIED感染的发病机制尚未完全阐明,目前局部术区伤口污染、浅表异物的存在被认为是诱发CIED感染的主要因素,大多数学者认为,多数的早期感染是由于手术中细菌污染及设备生物膜的形成,生物膜不被机体的免疫系统及传统抗菌药物的作用而杀灭[3],因此常规内科治疗难以根治植入性装置感染。
1.1 囊袋感染
大多数研究者认为植入装置的感染可能是由于术中的污染,而感染的发生与装置的更换和血行感染相关。约25%的CIED感染发生于装置植入的30 d内,33%发生于1个月~1年内,42%发生于装置植入1年后[5],这些数据表明约一半的CIED感染与手术操作相关。另有研究表明尽管进行仔细的术前准备,植入装置感染后培养的菌株与起搏器囊袋制作过程中所培养菌株大多一致,表明囊袋感染细菌的大部分来源于植入过程中产生的污染,而植入过程中可能产生污染的原因包括腋下及周围皮肤污染、手术过程中无菌操作不够、术中切口污染、手术室空气消毒等因素。也有一些研究指出经验不足的术者发生囊袋感染的概率较有经验的术者高,这可能也与手术操作过程中造成的囊袋细菌污染及反复插入电极致皮肤细菌污染入囊袋相关。
Ramsdale等在术前提取了约470例患者的生物标本,并没有预测随后发生的感染,且囊袋组织培养的阳性率明显高于实际感染的发生率[2],表明囊袋细菌污染并非感染发生的单一因素。也有研究表明囊袋局部血肿与植入继发感染相关[6],可能与血液提供了富含致病菌生长与繁殖需要的营养成分有关。此外机体免疫力低下、伤口皮肤血运差、愈合不佳等均为感染发生的宿主因素。
1.2 电极的生物膜形成
生物膜的形成是许多亚急性和慢性细菌感染,包括异物感染的发病机制中的关键步骤。生物膜难以被传统的抗生素消除,甚至导致严重的血行感染。生物膜一旦形成,便为游离状态的细菌提供新的黏附位点,同时细菌不断地从生物膜游离释放出来成为慢性感染源,可以解释感染性心内膜炎的发生。抗生素对从生物膜中游离出来的细菌有效,但不能消除黏附在生物膜及其内的细菌[7]。生物膜的产生并非是不可避免的,许多情况下,生物膜是由于植入设备的更换触发的[8],但是其确认需要取出CIED设备及采用先进的扫描电子显微镜技术[9],所以该理论需要今后的论证。
一般情况下,几乎所有的抗生素组合对新形成的生物膜均有效,但对陈旧的生物膜有难度[10]。扫描电镜下发现了CIED电极导线所有的裂缝中均有生物膜累积,生物膜上可见多部位定植的金黄色葡萄球菌,可以证明抗生素治疗的难度。
1.3 血行感染
当远离植入装置部位的感染引起的菌血症经血行播散也可引起植入系统的感染,多见于金黄色葡萄球菌血症、革兰氏阴性杆菌菌血症。电极相关的感染性心内膜炎死亡率高,被认为是CIED感染最严重的并发症,而晚期发生电极导线相关的感染性心内膜炎经常是由于血行播散感染如透析导管、中心静脉导管、动静脉瘘或周围脓肿而引起[11]。在植入装置的囊袋未找到感染证据发生的电极导线上的赘生物形成或明显的感染,可以用血行感染解释,这也能解释有些患者距最后植入术多年后才发生感染的这一现象。
2 感染的分类及诊断方法
根据感染发生的部位、临床表现不同,诊断方法也略有不同,通常将CIED感染分为两种。
2.1 局部感染(囊袋感染)
该型是最常见的CIED感染类型,多发生于植入或更换装置的第1年内[11],起搏器囊袋可表现为局部发红及疼痛、局部皮温高、肿胀、皮肤侵蚀或瘘道形成。多数患者不伴发热,但术后早期很难与伤口正常生理炎症反应及囊袋血肿区分,应避免任何情况下的经皮穿刺抽吸液体[12],尤其是在明确诊断前不能贸然打开囊袋,因为囊袋一旦打开,就几乎意味着要把植入系统全部拔除。
2.2 系统感染(菌血症或感染性心内膜炎)
未得到及时控制的致病菌可能沿着电极导线播散,导致血液感染和/或心内膜炎,可有发热、寒战、肺部受累等表现,对不明原因的长期发热、败血症等也应高度怀疑CIED感染可能。血培养、囊袋组织培养均有助于明确致病菌,并指导抗生素的选择。比较常见的细菌为葡萄球菌属(金黄色葡萄球菌和表皮葡萄球菌)、棒状杆菌、真菌、霉菌、结核杆菌等,但并非细菌培养阴性就意味着不存在感染,细菌培养阴性的CIED感染比例仍不低,且使用抗生素后细菌培养的假阴性率波动在12%~49%[3]。
超声心动图对于感染性心内膜炎的诊断及判断赘生物的位置及大小有着独特的优势,且能直视瓣膜及心肌损害。经胸超声心动图有着价格便宜、非侵入性的优点,可作为首选,但其诊断感染性心内膜炎的敏感性相对较低。经食管超声心动图虽然价格较贵,且为侵入性,但在对感染性心内膜炎的诊断敏感性>90%,远远高于经胸超声心动图的诊断敏感性(30%),且对左心系统感染性心内膜炎、区分电极导线近端的组织以及清晰发现赘生物有着独特的优势;但超声心动图难以鉴别赘生物和血栓形成,需结合细菌病原学及18-氟-脱氧葡萄糖正电子发射断层计算机扫描(PET-CT)综合考虑。
PET-CT既往用于诊断及分期恶性肿瘤,对于代谢高低的差异判断有很高的特异性,近期常被用于超声心动图及心脏核磁扫描难以明确的感染性心内膜炎及导线赘生物。感染性心内膜炎及导线赘生物的代谢活跃,PET-CT中18-氟-脱氧葡萄糖的摄取率高,能够与血栓及非感染的赘生物相鉴别,能够避免长期使用抗生素、电极拔除的风险,也有助于心腔内多电极植入时感染部位的识别。因电极导线拔除术作为 CIED 感染最重要、且唯一有效的治疗方法,且伴有心脏破裂、上腔静脉穿孔、瓣膜损伤等严重并发症风险[13],有少数患者因局部皮肤破溃、囊袋局部疼痛而初步诊断为囊袋感染,经过 PET-CT的摄取显像最终明确为非感染病例,从而避免了电极导线拔除术。
最近有一些研究表明,通过使用声波降解法分离生物膜上的细菌用于诊断植入相关感染,较传统诊断方法均有较高的敏感性及特异性[14],同时超声降解法也用于评估无感染症状CIED囊袋细菌定植情况。国内外指南提倡采用多种方式达到病原学的诊断,如血培养、囊袋组织培养、导线电极、导线赘生物等,但由于其血培养敏感性低,组织细菌培养受污染的可能性大,均会造成病原学的假阴性和假阳性可能。因此超声降解技术被认为是一种敏感性高的分离病原学的技术,尤其是对于已经接受抗生素治疗的患者[14]。
3 感染率增加的相关因素
由于植入装置感染的高风险及感染后处理的难度,在给予植入治疗前,需充分评估感染发生的风险,目前认为慢性肾功能不全、高龄、糖尿病等因素与植入后感染的发生相关,但由于这些因素很大程度上均为个体不能改变的因素(见表1),所以在植入前应注意优化可改变的因素。
4 CIED感染处置方法
4.1 药物使用
4.1.1 抗生素的使用
植入术前预防性使用抗生素可以将感染风险减低至0.64%,指南也提出应在皮肤切开前1 h内静脉注射抗生素,在CIED相关感染诊断确立时,无论内科保守治疗还是外科拔除治疗,都必须启动抗生素治疗[2-3],因此可以认为抗生素治疗是CIED植入和感染治疗的基础。在抗生素的选择方面通常基于覆盖最可能的病原体(常见的葡萄球菌属)选择各种头孢类抗生素治疗,最常用的抗生素为一代头孢类抗生素头孢唑林,其抗菌作用兼有青霉素、耐酶和氨苄青霉素特点[15],优于二三代头孢类抗生素,但对革兰氏阴性杆菌的效果不及二三代头孢。万古霉素、替考拉宁、达托霉素、利奈唑胺有相似的对革兰式阳性杆菌抗菌活性。由于植入装置感染控制不佳会导致电极相关感染性心内膜炎的发生,所以推荐静脉注射方法而非囊袋局部用药[16],抗生素的疗程一般在7~10 d。对于复杂装置[ICD、心脏再同步化除颤器(CRT-D)等]的感染及感染性心内膜炎的处置方法与上述一致,但感染性心内膜炎抗生素使用疗程一般在6~8周,菌血症疗程一般在14 d。
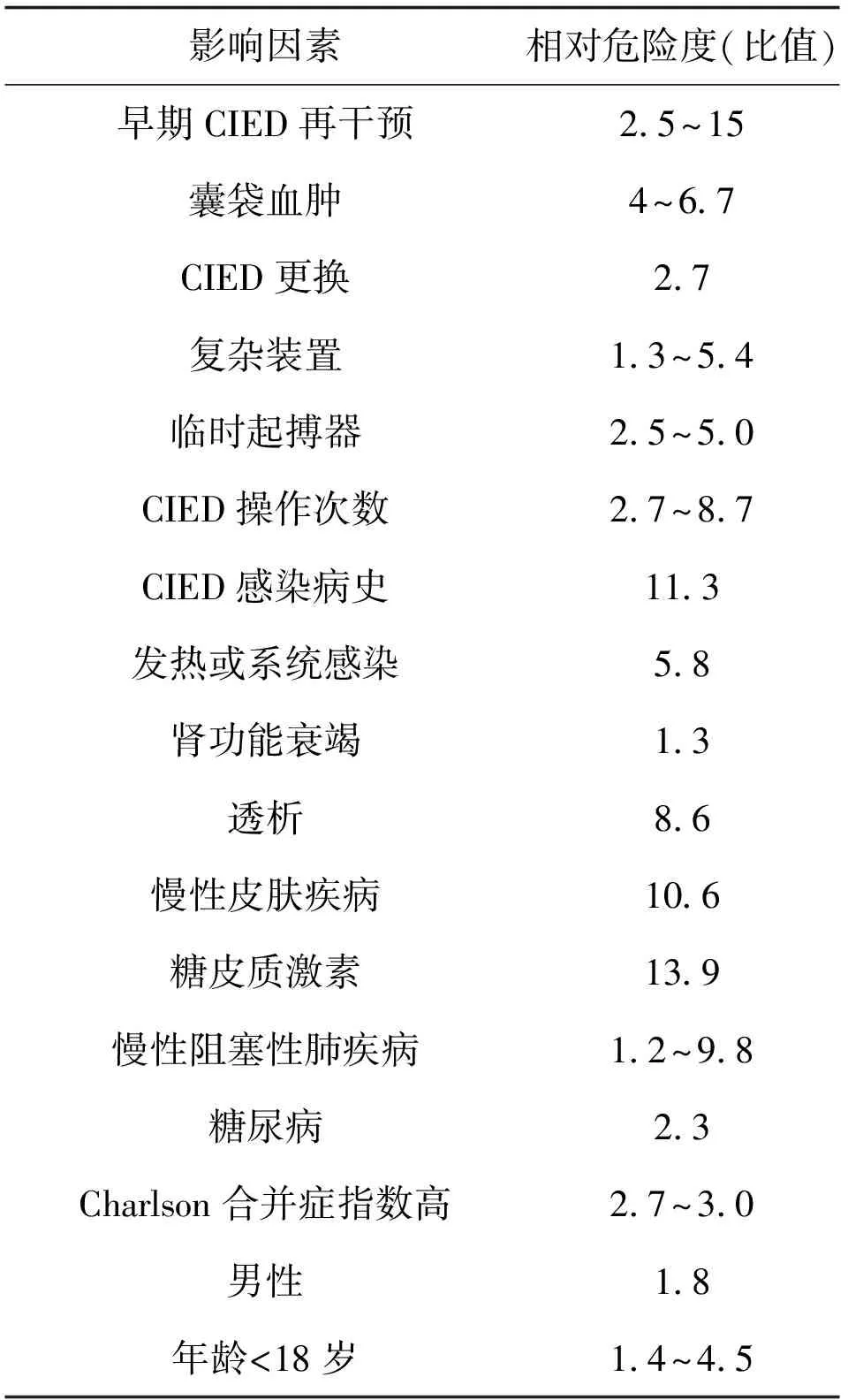
表1 影响CIED装置感染率增加的相关因素[12]
注: Charlson合并症指数(Charlson comorbidity index):对患者合并症情况进行积分评价,其评分对患者生存率及预后有明显影响。具体内容包括心肌梗死、充血性心力衰竭、周围性血管疾病、脑血管疾病、慢性阻塞性肺病、结缔组织疾病、消化性溃疡疾病、糖尿病、慢性肾脏疾病等各个方面。其中相对危险度>1为危险因素,相对危险度<1为保护性因素。
4.1.2 抗凝药物的使用
目前心房颤动和机械心脏瓣膜的患者接受抗凝治疗的比例逐年上升[17],同样用于服用阿司匹林和氯吡格雷防治支架后血栓形成的比例也成上升趋势,这些患者围手术期抗凝或抗血小板治疗可能增加术后囊袋血肿的风险。根据最近的文献,30%的CIED患者在手术过程中接受抗凝或者抗血小板治疗[18]。对于围手术期抗凝治疗,目前观点尚不一致。虽然有指南提出对于长期服用抗凝药物的接受胸部手术的患者,围手术期中首选治疗剂量的低分子肝素皮下注射或静脉应用普通肝素作为桥接治疗[19],但近期大量的临床试验表明进行心脏起搏器或ICD手术患者使用桥接治疗的患者出血事件及血肿发生较继续华法林治疗或者双联抗血小板治疗的患者风险高[20]。尚未有关于新型口服抗凝药物对于围手术期治疗的临床试验结果。
4.2 装置拔除
4.2.1 适应证
一旦确定植入装置感染,应根据CIED的工作情况、电极导线测试正常与否及囊袋感染情况,选用不同的方法进行处理。处置方法包括抗生素治疗、装置和电极导线全部取出更换新的装置、保留电极导线装置消毒后再植入、对侧再植入CIED、患侧感染灶清创,上述均结合抗生素治疗。在长期随访CIED感染的患者中,接受装置拔除的患者死亡率较保守治疗的死亡率低且无复发性感染[21],且目前的指南也指出拔除电极导线是植入装置感染处置的Ⅰ类指征。虽然保守治疗失败率高,但其在中国所占比例仍不少见[22]。
4.2.2 拔除方法
导线拔除的方法有两种:一种为内科医生于导管室在X射线下经静脉拔除电极;第二种为外科开胸直视下拔除装置系统,比较特殊的是两种技术的混合方式称为电极导线拔除杂交技术。
经静脉电极拔除分为以下方法:(1)直接牵引法:可用于牵引血管外电极导线及心腔内电极导线,此法虽然操作简单但可能由于电极植入时间的延长,电极和周围组织粘连严重可能导致牵引时间长、电极断裂或心肌撕裂,所以目前临床应用少。(2)血管内反推力牵引技术:通过一整套的拔除工具经静脉拔除电极,目前认为是最安全和有效的拔除电极的方法。拔除工具主要有:锁定钢丝、机械扩张鞘、激光扩张鞘、射频扩张鞘、下腔装置等[23],可以沿植入导线原静脉途径或经下腔静脉途径拔除。①锁定钢丝[24]:在将钢丝插入中心腔并抵达电极头端后,将钢丝头端膨胀。锁定与电极固定为一个整体,同时牵引锁定钢丝及电极,避免了直接牵引导致的电极拉伸、断裂以及头端分离。锁定钢丝的问世奠定了电极拔除技术的不断迈进。②各种鞘管:包括机械鞘、激光鞘、电外科鞘、伸缩鞘,分别借用机械力、激光能量、射频能量来固定、牵引和拔除电极导线、分离电极导线与周围包裹的心肌组织,使电极导线容易拔出,其中Evolution鞘管作为改进的机械鞘,增加了分离电极包裹效率,并且在与snare针眼圈套拔除装置相对照的研究中,Evolution鞘管具有更低的手术射线曝光时间及更低的手术并发症特点[25]。③针眼圈套拔除装置(snare):采用股静脉长鞘推送至心腔,将头端金属抓捕器推出鞘管,将电极体部纳入鞘管腔内,撤出体外。(3)外科开胸取导线:即开胸手术切开心房或心室,直视下取出电极导线,该方法创伤大,不适宜于年龄大和一般情况差的患者,而适宜于血管内反推力牵引法失败或有禁忌(如赘生物)或者经静脉拔除失败但必须拔除电极导线的患者。
4.2.3 术后并发症
并发症通常分为手术中及手术后。术中并发症包括心肌损伤、心脏压塞、血管或瓣膜撕裂、血胸、气胸、肺栓塞等。手术过程需进行外科开胸的准备。为了减少风险,患者的心脏病史、适应证及手术的并发症、可能面临的技术挑战以及取出后的计划都需详细的权衡和决定。循证医学研究显示植入电极时间长、女性、ICD的电极这些因素与术后并发症的发生率成正相关[26]。
4.3 再植入
在植入装置及电极拔除后需重新评估CIED的植入指征,原因可能与某些心律失常疾病已被解决,回顾性研究提示20%~40%接受电极拔除的患者不需再次植入装置[27-28]。有关再植入时间普遍的观点是应个体化,一般认为除感染性心内膜炎伴瓣膜赘生物需血培养转阴14 d后再植入其他类型的CIED感染需血培养转阴3 d后即可再次植入新装置。
为防止感染的反复及进展,术中需对感染灶彻底清创,对于需再植入的通常优先对侧胸部,其次可选择髂静脉入路。虽然相关共识及指南均不推荐感染装置消毒后再植入,但研究提示对原装置进行环氧乙烷消毒后再植入的随访结果提示并无感染再发风险[29-30]。
5 结论
随着CIED植入术及患者合并症的逐年增加,感染成为一个日益严重的问题,管理的关键在于预防及治疗,在植入前详细评估收益及风险;由于感染症状多样及不典型,诊断常比较困难,CIED感染的治疗包括抗生素治疗及完整去除CIED装置,对患者的预后至关重要。未来为减少CIED感染仍需流行病学资料的收集,多中心、随机对照试验和普及感染的识别及治疗。
