乳鼠窦房结细胞、心房肌细胞及心室肌细胞动作电位比较
2018-10-26项国剑林风辉张建成
陈 茜, 王 容, 项国剑, 李 泱, 林风辉, 张建成
心脏实现泵血功能是以心肌的收缩和舒张为基础的,心脏之所以能不停地进行有序的、协调的收缩与舒张交替的活动,归根结底都是由心肌细胞动作电位(action potential, AP)的规律性发生与扩布引起的。窦房结是心脏正常窦性节律的起搏点,窦房结细胞具有强大的自律性,可以自发、有节律地搏动。心脏的正常搏动由窦房结组织产生,并按传导组织的顺序依次通过结间束抵达房室结及心房肌,后通过希氏束、浦肯野纤维使全部心室肌几乎同时被激动,从而引起心肌细胞有节律地收缩和舒张。
已知心肌细胞主要由4类细胞组成,包括心室肌细胞(ventricular cell, VC)、心房肌细胞(atrial cell, AC)、窦房结细胞(sino-atrial node cell, SNC)[包括移行细胞(T-细胞)和起搏细胞(P-细胞)]和浦肯野纤维。前二者是工作细胞,具有稳定的静息电位,主要执行收缩功能,在4相的静息期无自动去极化功能。而窦房结细胞是自律性细胞,它们组成心内特殊传导系统,这类细胞大多没有稳定的静息电位,在4相的最大舒张期可以发生缓慢自动去极化,并可自动产生节律性兴奋。目前,乳鼠和成年大鼠心肌细胞被用于药物干预、缺氧复氧损伤、疾病模型离子通道改变等方面的研究,但成年大鼠心肌细胞分离后无法传代和长时间培养,只能用于即时及短时间研究,限制了干预[1-3],而乳鼠心肌细胞由分离培养后获得,数量多,对乳鼠心肌细胞膜AP的认识有利于今后进行模型构建、药物干预等较长时间的研究。为此,本研究采用全细胞膜片钳技术,观察乳鼠窦房结细胞、心房肌细胞及心室肌细胞的AP,并进行比较。
1 材料与方法
1.1材料
1.1.1动物 新生24 h内Wistar大鼠15只,清洁级,雌雄不拘,SPF级[斯贝福(北京)实验动物科技有限公司,许可证号:SCXK(京)2011-0004],质量检测单位:中国食品药品检定研究院。
1.1.2试剂与溶液 DMEM细胞培养基、PBS磷酸盐缓冲液(美国Thermo公司);FBS胎牛血清(美国Invitrogen公司);HEPES缓冲液(美国Amresco公司);青链霉素混合液(北京索莱宝科技有限公司);Trypsin(中国Hotaibio公司);NaCl,KCl,NaHCO3,MgCl2·6H2O,Na2ATP,K-aspartate,CaCl2,Na2ATP及葡萄糖(美国Sigma公司)。
记录单细胞AP的细胞外液(mmol/L)配方:NaCl 140,KCl 4,MgCl2·6H2O 1.0,HEPES 10,Glucose 5,CaCl21.0;pH值用NaOH调至7.36。记录单细胞AP的电极内液(mmol/L)配方:K-aspartate 120,KCl 20,MgCl2·6H2O 1.0,Na2ATP 4,HEPES 10,Glucose 10;pH值用KOH调至7.30。
1.2方法
1.2.1乳鼠心肌细胞的急性分离与培养方法 (1)取材:乳鼠体表用75%酒精反复浸泡数秒后,呈仰卧位固定四肢于泡沫上,消毒胸腹部皮肤,沿胸骨右缘剪开并去除前胸壁,暴露心脏,置于解剖显微镜下分离心包膜,将心脏向右下方轻轻牵拉,轻移右心耳,看清上腔静脉,于界嵴中部静脉窦侧、前腔静脉根部取0.7 mm×0.7 mm×0.7 mm的组织块,同时剪取心房组织及心室中下1/3处,立即置于预冷的不含血清的DMEM培养液;(2)冲洗:将组织培养皿置于超净台中,用滴管反复轻柔吹打组织,洗去部分残留血液后,再次将组织块移入PBS液中反复吹打冲洗,直至洗净;(3)消化:将清洗后的组织块移入消毒过的青霉素小瓶内,用眼科剪将组织块剪碎成0.5~1.0 mm3的乳糜状小块,加入体积为组织块30~50倍的0.08%的胰酶,用吸管轻柔吹打0.5 min,自然沉淀后弃上清液。再加入0.08%的胰酶(体积同上),置于37 ℃水浴中轻轻振荡3~5 min,吹打0.5 min,自然沉淀,吸取上清液,加入等体积的10% FBS培养基终止消化,重复消化3~5次,至基本消化成单细胞为止;(4)过滤、离心:将细胞悬液用400目金属滤网过滤后分装于15 mL的离心管中离心,940 r/min下离心6 min,弃上清液;(5)接种培养:每根15 mL离心管用含10% FBS培养基重悬后,将单细胞悬液接种于60 mm的培养皿内,置于37 ℃、体积分数为0.05的CO2孵箱中孵育90 min;(6)采用差速贴壁法分离技术,因成纤维细胞贴壁快,培养皿中的细胞悬液即为较纯化的心肌细胞,轻轻吸出培养皿内的细胞悬液,分装于6个35 mm的培养皿内,放回培养箱继续孵育,每天换液1次,以备膜片钳记录用。
1.2.2膜片钳记录方法及刺激参数的设置 选取细胞膜完整、表面光滑、横纹清晰的心肌细胞检测AP。采用全细胞膜片钳记录的方法,将膜片钳放大器(Axonpatch 700B,美国Axon公司)与计算机连接,应用数模转换器(Digidata 1440A,美国Axon公司)采集刺激信号及电压输入信号,此过程由Clampfit-9.2软件控制调节。GG-17玻璃毛坯经微电极拉制仪(pp-83,日本Narishige公司)经两步法拉制成电阻为3.0~5.0 MΩ的微电极,常规安装电极并调整方向,调节三维微操纵器,使微电极头端进入细胞外液,在显微镜下观察电极的位置,缓慢移动,使其与细胞膜进行封接,电极电阻上升0.5~1 MΩ时停止移动,通过注射器给电极施加负压,使封接电阻达1 GΩ或以上,吸破细胞膜成为全细胞记录模式,信号经截止频率为1 kHz的四阶贝塞尔低通滤波器,采样频率为5 kHz。将膜片钳设定为电流钳模式,记录窦房结细胞AP时不给予刺激,记录心房肌及心室肌细胞膜AP时给予2.5 ms、1 000 pA、1.0 Hz的外向电流,诱导并记录心室肌单细胞AP。

2 结 果
2.1窦房结细胞、心房肌细胞及心室肌细胞分离培养后的生长状况 于倒置显微镜下观察分离培养后的细胞:接种培养后,视野下见大小不等、圆形、清亮的单细胞悬浮于培养基中,4 h后,3种细胞均开始贴壁生长,16 h后可见部分散在细胞开始搏动;48 h后各类细胞胞体不断增大,搏动的细胞渐增多,偶可见融合成片状的细胞同步搏动。培养24 h后,可见窦房结细胞体积小,细而长,呈长梭形(图1A),心房肌细胞体积亦较小,呈梭形或三角形(图1B),而心室肌细胞体积较大,可伸出伪足并交织成网,呈短梭形、多角形或不规则形(图1C)。

A:窦房结细胞(×100); B:心房肌细胞(×100);C:心室肌细胞(×40).图1 倒置显微镜下观察分离培养后的细胞Fig 1 Observation of cells isolated and cultured under inverted microscope
2.2窦房结细胞、心房肌细胞及心室肌细胞培养后搏动频率比较 随机选取窦房结细胞、心房肌细胞和心室肌细胞各10个计算搏动频率,3种细胞的搏动频率分别为(152.1±10.9),(116.3±8.6),(92.4±9.3)min-1,组间两两比较,差别均有统计学意义(P<0.01,图2)。
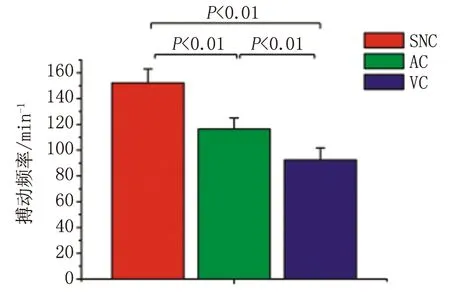
VC:心室肌细胞;AC:心房肌细胞;SNC:窦房结细胞.图2 窦房结细胞、心房肌细胞及心室肌细胞搏动频率比较Fig 2 Comparison of beating rates in sino-atrial node cells, atrial cells and ventricular cells
2.3窦房结细胞、心房肌细胞、心室肌细胞膜AP 在膜片钳实验电流钳模式下记录3种细胞的AP,在不给予任何电流的刺激下,窦房结细胞可记录到自发性AP(图3A),给予2.5 ms、1 000 pA、1 Hz的电流刺激后,可诱发出心房肌和心室肌细胞AP(图3B,3C)。心房肌细胞AP形状呈三角形,而心室肌细胞的AP形状则更像矩形。
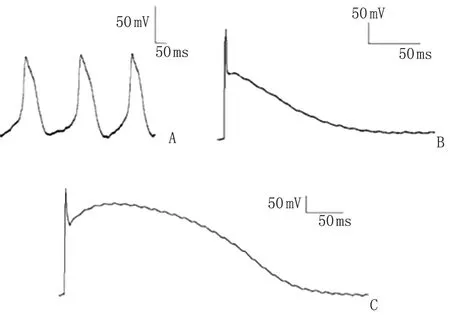
A:窦房结细胞; B:心房肌细胞; C:心室肌细胞.图3 窦房结细胞、心房肌细胞及心室肌细胞动作电位Fig 3 Action potential of sino-atrial node cells, atrial cells and ventricular cells
2.4窦房结细胞最大舒张电位(maximum depolarization potential, MDP)及心房肌细胞、心室肌细胞膜AP静息电位(resting membrane potential, RMP)的比较 窦房结细胞没有稳定的静息电位,其MDP为(-41.3±4.0)mV(n=16),而心房肌细胞、心室肌细胞的RMP分别为(-50.7±2.9)mV(n=11),(-59.8±2.1)mV(n=13),差别无统计学意义(P>0.05,图4)。

VC:心室肌细胞;AC:心房肌细胞;SNC:窦房结细胞.图4 窦房结细胞最大舒张电位、心房肌细胞及心室肌细胞膜动作电位静息电位的比较Fig 4 Comparison of MDP in sino-atrial node cells and RMP in atrial cells and ventricular cells
2.5窦房结细胞、心房肌细胞、心室肌细胞膜AP时程(action potential duration, APD)的比较 窦房结细胞、心房肌细胞、心室肌细胞复极至20%(APD20)分别为(23.6±4.9),(11.6±2.2)及(23.8±6.8)ms,复极至50%(APD50)分别为(77.82±5.1),(93.9±13.0)及(206.9±21.0)ms,复极至90%(APD90)分别为(208.2±10.8),(211.1±17.5)及(386.4±33.3)ms。心室肌细胞的APD20,APD50和APD90均较心房肌细胞延长,差别有统计学意义(P<0.05,图5)。
3 讨 论
AP的产生主要是细胞膜两侧电荷的不均衡分布以及细胞膜对某些离子的通透性发生改变所致。不同心肌细胞具有不同种类和特性的离子通道,因而不同部位的心肌细胞AP的开关机制及其电生理特性也不尽相同。
本研究结果显示,窦房结细胞无需电流刺激可记录出自发性AP,其搏动频率较心房肌细胞及心室肌细胞快。因窦房结细胞属于自律性细胞,其AP分为0相去极化期,3相复极化期和4相舒张期,与心房肌细胞及心室肌细胞等工作心肌AP的最大不同是,其去极化期存在众多离子参与的内向和外向电流。由于其细胞膜上很少表达瞬时外向钾电流(Ito)通道和缺乏内向整流钾电流(IK1)通道,因此窦房结细胞AP无明显的1相和2相,而是直接进入3相复极化过程;同时,因L型钙电流(ICa,L)和T型钙电流(ICa,T)的激活、延迟整流钾电流(IK)的失活、起搏电流(If)的发展,故窦房结细胞可自动去极化而产生自发性AP[4-6]。

APD:动作电位时程; VC:心室肌细胞;AC:心房肌细胞;SNC:窦房结细胞. 与AC比较,☆:P<0.05.图5 窦房结细胞、心房肌细胞、心室肌细胞动作电位APD20,APD50,APD90的比较Fig 5 Comparison of APD20, APD50, APD90 in sino-atrial node cells, atrial cells and ventricular cells
一般情况下,心肌细胞均可记录到静息电位和AP,而在AP中又包括去极化和复极化两大过程。工作心肌的静息电位中,由内向整流钾电流(IK1)引起的K+平衡电位是构成静息电位的主要成分,同时心肌细胞膜在静息状态下对Na+也有一定通透性,由钠泵活动产生的泵电流可以使细胞内的负电位稍增大[7]。本实验结果得出,心房肌及细胞静息电位较心室肌细胞小,但差别无统计学意义,考虑心房肌细胞静息电位受到Na+内漏的影响较大,且其细胞膜上IK1通道密度较心室肌细胞低,故其细胞内负电位与心室肌细胞相比较小。有文献报道,乳鼠心房肌及心室肌细胞静息电位分别为-60~-70 mV,-70~-80 mV[8-9]。但本实验记录到的心房肌及心室肌细胞静息电位较低,考虑可能与膜片钳试验中细胞封接不够严密和破膜不够完全有关。
工作心肌的AP通常分为5个时相:0~4相。0相为AP起始阶段的除极反应,是由钠离子通道(INa)开放和Na+内流所引起;1~4相构成了AP的复极过程,Na+,K+,Ca2+及Na+/K+泵等电流共同参与其中[7]。比较心房肌和心室肌细胞的APD时,心房肌细胞平台期不明显,且APD时程较心室肌短。因心房肌细胞存在各种钾离子电流,如Ito及IK,细胞膜对K+的通透性较大,K+外流和复极化速度较快,同时还有心室肌细胞不存在的超激活的延迟整流钾电流(IKur)和持续外向钾电流(Iso),且其ICa,L较弱,可能是心房肌细胞AP呈三角形、APD较短、特别是APD20和APD50更短的原因[1,10-13]。此外,心房肌细胞的Ito通道较发达,加速其复极化过程,故其平台期不明显。而心室肌细胞中ICa,L密度大,故其AP具有明显的2相平台期。心室肌上IK是AP快速复极期的主要电流,主要有快激活的延迟整流钾电流(IKr)和慢激活的延迟整流钾电流(IKs),而哺乳动物的心房肌上该电流不明显[6,14],故心室肌细胞APD90较心房肌细胞长。
本实验未对窦房结细胞、心房肌细胞及心室肌细胞的各种离子流进行研究,因乳鼠为刚出生的大鼠,发育尚不完全,参与AP各时相的离子通道是否与成年大鼠有差异尚不明确,还需在今后实验中进一步完善与探讨,为今后进行缺氧复氧损伤、疾病模型离子通道及药物干预等方面的研究奠定坚实的电生理基础。
