新型荧光纳米材料在核酸和蛋白质检测中的应用
2018-10-26陈朝会张正涛苏鲁方
陈朝会,张正涛,苏鲁方
(江汉大学 交叉学科研究院,湖北 武汉 430056)
0 引言
21世纪,随着人们生活水平的进一步提高,对疾病的早期诊断提出了更高的要求,而核酸、蛋白质和微量元素的变化在一定程度上可以反映某些疾病的早期病变,例如:癌胚抗原超过20 μg∕L时往往提示有消化道肿瘤,70%~95%的原发性肝癌患者血清中AFP高达250 μg∕mL~6 mg∕mL,因此,分子生物水平上的早期诊断成为疾病检测的趋势。分子生物水平上的诊断包括核酸和蛋白质检测。核酸是生物体内重要的遗传信息载体,在生命活动中起着存储和传递遗传信息的作用,决定着生物体的生长、遗传和变异等一系列重大的生命现象。核酸突变或缺失等都将导致疾病的发生。如镰刀形红细胞贫血症是珠蛋白β基因的点突变引起的;白化病是酪氨酸酶基因缺失引起的黑色素缺乏或合成障碍所导致的。蛋白质是生命活动的基础,许多重要的生命现象和生理活动都是通过蛋白质实现。蛋白质含量的变化与疾病息息相关,因此许多疾病相关蛋白的检测在病理学、基因组学等方面有重要的参考价值。如叶酸受体是一种与肿瘤相关的跨膜单链糖蛋白,该蛋白在人体的很多肿瘤细胞,如卵巢癌、脉络丛癌、室管膜癌等中过度表达,但是在正常细胞中却很少表达,甚至不表达。叶酸受体的检测可以为疾病诊断提供许多有价值的信息。
目前常用检测核酸和蛋白质的方法有循环伏安法、电致化学发光法、紫外-可见分光光度法(比色法)、质谱法、荧光分光光度法等。电分析法简单快速,但是电极修饰过程繁琐,并且需要一定的电化学基础;化学发光法线性范围宽,反应快且不需要光源,但是应用对象受限、不容易建立均相体系;比色法仪器简单、直观性强,但是其灵敏度有待进一步提高;质谱法则需要借助昂贵的仪器。荧光分光光度法因其灵敏度高,适用范围广,操作简便等优点被广泛应用于核酸、蛋白质和细胞等的检测。同时,纳米科技的快速发展,为荧光分析法提供了更广阔的发展空间。本文主要介绍新型纳米荧光材料在核酸及蛋白质检测中的应用。
1 量子点在核酸及蛋白检测中的应用
1.1 传统量子点
量子点(quantum dot,QD)是一种三维受限的准零维纳米材料,其直径范围为1~100 nm,当其尺寸小于或等于其玻尔半径时,在外界激发下可以发射荧光。量子点一般由II-VI族元素(如CdS、CdSe、CdTe、ZnSe、ZnS等)[1]、III-V族元素(如InP、InAs等)或IV-VI族元素(如PbS、PbSe)[2]的半导体材料构成,也可由两种或两种以上的半导体材料构成核∕壳结构(如CdSe∕ZnS核∕壳结构量子点等),广义上的量子点还包括硅点和碳点。与传统有机荧光染料相比,量子点具有量子产率高、Stockes位移大、抗光漂、一元激发、多元发射等优点,这使其在核酸和蛋白检测中具有广泛的应用前景[3-4]。
ZHANG等[5]合成硫代磷酸功能化的DNA量子点,利用合成序列中的识别部分与特定的乙肝病毒序列形成双链前后的荧光强度变化,构建了基于DNA功能化量子点的核酸传感器。ENKIN等[6]利用BHQ与DNA功能化纳米银簇之间的荧光共振能量转移效应(fluorescence resonance energy transfer,FRET),结合链置换反应,构建了多个目标序列的同时检测平台。为拓展量子点的应用,CHEN等[7]基于N-乙酰半胱氨酸包裹的CdTe量子点和钌的配合物之间的光诱导电子转移效应,建立双色检测蛋白质的分析方法。ZHANG等[8]利用一步法合成的DNA功能化无镉量子点与二硫化钨之间的共振能量转移作用,结合小分子末端保护技术,建立了高灵敏、高选择性的蛋白质检测法。MA等[9]利用不同蛋白质对双色巯基乙酸(TGA)封端的CdTe量子点的光诱导自组装及量子点的荧光信号(颜色和强度)的影响,建立双通道荧光传感器以同时区分多种蛋白质。
在过去20年中,量子点可调谐的荧光性质让其成为荧光传感研究中的明星材料。但是随着研究的继续深入,其潜在毒性也不可避免地暴露出来,因此需要寻求新型无毒纳米材料。
1.2 硅点
荧光硅量子点(silica nanoparticles,SiNPs)作为一种典型的间接带隙半导体纳米材料,具有独特的发光性能,当其半径小于或接近激子波尔半径(硅的波尔半径小于5 nm)时会产生量子限域效应。硅量子点的量子限域效应增加了其直接带隙跃迁的辐射复合,进而增加发光效率且使发光峰位置移向高能区,表现出其发光波长受核尺寸控制的特性,而且随着量子点尺寸的减小,其发射波长蓝移。此外,与传统含重金属Cd量子点相比,硅量子点具有独特的光学性能、良好的生物相容性及无毒的特性,这些优势使得其在生物医学方面呈现出良好的应用前景[10-12]。
SU等[13]利用硅量子点作载体,将硫醇功能化且修饰有荧光染料的DNA与带有烯烃链端的硅量子点进行偶联,制备了DNA功能化的硅量子点,加入目标MicroRNA-21后,MicroRNA-21与偶联的DNA可形成更稳定的DNA∕RNA复合物,使猝灭剂链被置换出来,体系荧光回升。通过监测荧光强度,可实现目标核酸的定量检测(图1)。在荧光共振能量转移过程中,硅量子点常被用作供体,如KIM等[12]利用量子点作供体,金纳米棒作受体,结合抗原抗体特异性作用,建立结核分枝杆菌Ag85B抗原的高选择性测定法;CHENG等[14]基于硅量子点与有机染料之间的荧光共振能量转移,利用蛋白酶切割肽链阻断共振能量转移的发生构建了蛋白酶传感器。

图1 硅点合成及检测MicroRNA-21示意图Fig.1 Two-step synthesis of SiNP ODN conjugates and derection of MicroRNA-21
1.3 碳点
碳点(Carbon nanodots,C-dots)是由分散的类球状碳颗粒组成,是一种新型的碳基零维纳米材料。碳点具有水溶性好、低毒、原料来源广、成本低、生物相容性好等诸多优点,因此它的出现引起了研究者广泛的关注,常被用来构建核酸和蛋白质的生物传感器[15-17]。LOO等[18]基于单双链DNA与羧基化碳点之间作用力不同及羧基化碳点对染料的猝灭,建立了均相检测核酸的方法。XU等[19]以适配体功能化的碳点为荧光信号,利用目标蛋白质与适配体特异性作用,构建了检测凝血酶的传感器。该方法需要通过离心除去没结合目标蛋白的DNA,使检测步骤复杂化。为此,ZHANG等[20]基于Mn掺杂ZnS量子点与碳点之间的磷光能量转移效应,建立了简单、快速检测凝血酶的方法(图2)。基本原理如下:设计适配子修饰的量子点,没有目标蛋白存在时,碳点与适配子之间的π-π相互作用使之靠近Mn掺杂ZnS量子点并发生磷光能量转移,此时体系没有荧光;加入目标蛋白后,蛋白与适配子结合,π-π堆积相互作用的消失,碳点远离ZnS量子点,磷光能量转移过程被抑制,ZnS量子点的磷光恢复。
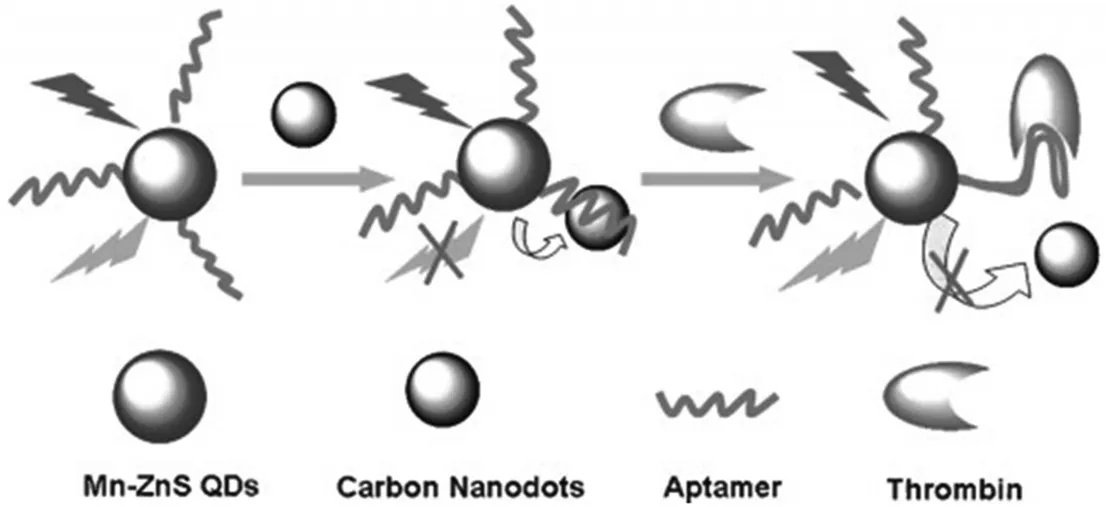
图2 基于Mn掺杂ZnS量子点与碳点之间的磷光能量转移效应检测凝血酶示意图Fig.2 Thrombin detection based on phosphorescence energy transfer effect between Mn doping ZnS quantum dot and carbon dot
半导体量子点荧光量子产率高、生物相容性好,但是其表面改性及功能化操作复杂,这在一定程度上限制了其应用。
2 金属纳米簇在核酸和蛋白质检测中的应用
2.1 金簇
金属纳米簇是由几个至几百个金属原子组成的新型荧光纳米材料,其直径一般小于3 nm。与半导体量子点和有机染料相比,金属纳米簇具有尺寸小、无毒、良好的生物相容性以及在盐溶液中稳定性高等优点[21]。常见的金属纳米簇有金簇、银簇、铜簇等[22-23]。其中,金纳米簇(Au nanoclusters,AuNCs)由于合成简单等优点在生物医学检测中有着广泛的应用[24-25]。
XIE等[21]以牛血清白蛋白为稳定剂和还原剂,利用碱性条件下牛血清白蛋白上的酪氨酸残基还原氯金酸,制备牛血清白蛋白包裹的荧光金簇。在此基础上,LI等[26]利用变性牛血清白蛋白(denatured bovine serum albumin,dBSA)合成的水溶性金簇为荧光信号,基于S-乙酰硫代胆碱碘化物水解产物硫代胆碱对dBSA-AuNCs的猝灭作用,建立了无需染料标记的乙酰胆碱酯酶活性检测方法(图3)。该方法原理如下:在乙酰胆碱酯酶存在的条件下,其底物S-乙酰硫代胆碱碘化物水解产生硫代胆碱,硫代胆碱分子中硫醇基与dBSA-AuNCs结合,使金簇的荧光发生猝灭;没有目标物存在时,S-乙酰硫代胆碱碘化物水解反应不能发生,dBSA-AuNCs荧光强度不变。但是由于难于在金簇上修饰核酸和蛋白质,这使得金簇的应用大大受限。
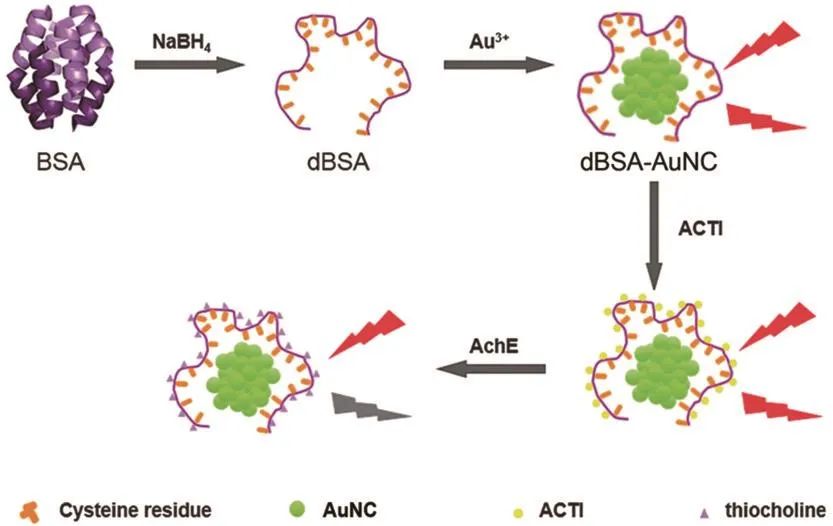
图3 变性牛血清白蛋白指导的荧光金簇的合成及乙酰胆碱酯酶活性检测示意图Fig.3 Schematic of dBSA-directed synthesis of fluorescent Au clusters and detection of AChE activity
2.2 银簇
DNA功能化的银纳米簇因其易于合成及功能化、较小的粒径和毒性[27-30]、好的生物相容性等优点受到了研究者的青睐。2004年,DICKSON等[27]首次发现富含胞嘧啶的DNA序列可用于纳米荧光银簇的合成,该发现建立了纳米团簇和DNA分子之间的连接,为后期DNA功能化银簇的生物医学应用奠定了基础。在此基础上,通过对比不同序列合成的银团簇的发射波长,实现了碱基序列对银团簇的发射波长调控[31]。基于银簇的荧光性质及依赖序列合成的特点,研究者们构建了一系列检测蛋白质[32-35]、细胞[36-38]等的传感器。2013年,WANG等[39]首次发现,DNA功能化纳米银簇和嵌入Hemin的G四联体之间存在光致电荷转移效应。该效应的强弱与银簇和G四链体结构间距离有关,当距离超过15个碱基时,荧光猝灭效率只有50%。基于这一发现,并通过将适配子序列引入到探针中,构建了检测蛋白质的传感器。但是由于G四链体的猝灭效率不高,使得该方法具有高的背景信号。为了解决这一问题,LIU等[40]利用石墨烯做猝灭剂,构建了检测目标核酸和蛋白质的传感器(图4)。没有目标核酸∕蛋白质存在时,DNA功能化的纳米银簇吸附在石墨烯表面,银簇荧光被石墨烯猝灭;加入目标核酸∕蛋白后,目标核酸∕蛋白与探针DNA结合,形成双链DNA或使DNA的二级结构发生改变,并脱离石墨烯表面,纳米银簇的荧光得到恢复。

图4 基于DNA功能化银簇/氧化石墨烯检测目标核酸和蛋白Fig.4 Detection of target DNA and thrombin with DNA-templated AgNCs/GO hybrids as sensing matrices
银簇合成原料廉价、易得且其表面易于修饰核酸,这使得银簇在核酸及蛋白检测中应用广泛[41-42],但是,银簇的合成需要依赖特定序列的DNA模板,相对耗时且成本较高。为了系统地研究不同序列与所合成的纳米颗粒之间的相互关系,需要建立一种易于操控的DNA模板纳米颗粒合成方法。
2.3 铜簇
DNA功能化的铜纳米簇(Copper nanoclusters,CuNCs)是近年来新报道的一类荧光纳米颗粒。2010年ROTARU等[43]发现,铜离子在抗坏血酸存在的条件下可以被还原成铜纳米颗粒,这些铜纳米颗粒聚集在双链DNA的大沟中形成稳定的铜纳米簇;并且随着双链DNA序列增长,合成的铜纳米簇粒径变大、荧光增强。SONG等[44]进一步研究了双链DNA碱基对组成对铜纳米簇形成的影响,发现含有A-T碱基对的双链更易于形成荧光铜簇,而G-C碱基对则不会形成。通过透射电镜、荧光寿命等表征手段证明,铜纳米颗粒的粒径和荧光寿命可以通过双链DNA的长度进行调控。QING等[45]通过考察不同碱基对铜纳米颗粒合成的影响,发现铜纳米簇能够选择性地在单链多聚T碱基序列中形成,并以该聚T碱基模板化的荧光CuNPs作为荧光探针,建立了新型的无需标记检测S1核酸酶的方法。作为非标记探针,DNA功能化铜簇用于生化检测的灵敏度有待进一步提高,为此,研究者们将信号放大技术与DNA功能化铜簇结合,建立了多种高灵敏检测核酸和蛋白质的方法[46]。YE等[47]通过TdT的酶促聚合反应得到聚T碱基的DNA序列,利用铜离子和T碱基之间的相互作用,原位合成了红色荧光的铜纳米颗粒,并以此为荧光信号实现了多聚核酸激酶的定量检测。
3 结语
与传统有机染料相比,新型荧光纳米材料易于合成,原料廉价易得且自身具有荧光,这些优势使得其在核酸和蛋白检测中有着广泛的应用。然而,现有新型荧光纳米材料仍存在一些需要改进的地方,如稳定性、毒性、灵敏度等。对这些性质以及表面改性路线的研究会进一步拓宽这些材料的生物医学应用,为生物传感、生物成像、药物输送和高级治疗等提供重要的参考。
