超高效液相色谱-串联质谱法测定莲藕、莲叶、莲子、田泥与田水中12种农药残留
2018-10-25张新忠陈宗懋赵梅勤姚月凤绳慧珊王新茹罗逢健
张新忠,陈宗懋,赵梅勤,姚月凤,绳慧珊,王新茹,周 利,罗逢健
(1.中国农业科学院茶叶研究所 农产品质量安全研究中心,浙江 杭州 310008;2.农业部茶叶产品质量安全风险评估实验室,浙江 杭州 310008;3.浙江天丰生物科学有限公司,浙江 金华 321025;4.山东农业大学 农学院,山东 泰安 271018;5.天津农学院 园艺园林学院,天津 300384)
莲藕种质资源丰富,兼具食用性和药用性,营养丰富,含有大量利于人体健康的营养成分,因特殊的风味和保健功能而广受国内外消费者欢迎。随着种植业结构调整,莲藕栽培已成为我国一些地区的特色农业[1]。近年来,干莲叶作为一种特色茶——莲叶茶在市场上也有销售。喷施除草剂等农药可防治莲藕田病虫草害,降低人工成本,提高莲藕种植的经济效益,但也可能导致莲藕及莲叶、莲子中的农药残留;另外,整个现代农业体系中农药的使用、环境的恶化导致莲藕的生长环境发生变化,田水、田泥中残留的化学农药,也可能会传递富集到莲藕及莲叶中,导致莲藕及莲叶、莲子中的农药残留,影响莲藕及莲叶、莲子质量安全。

莲藕、莲子和莲叶属于区域性特色小宗农产品,特殊性强,国内外目前对其中农药等污染物残留研究较少,仅有少量文献报道[4-9]。如王赟莘等[4]利用固相萃取(SPE)柱净化,高效液相色谱法(HPLC)测定了水生蔬菜中22种杀虫剂、杀菌剂农药残留;喻磊[5]利用固相微萃取结合气相色谱电子捕获检测器法(GC/ECD)、气相色谱质谱法(GC-MS)和HPLC分析了莲藕、荸荠和茭白中的农药残留;Miao等[6-7]对比了QuEChERS提取净化和SPE柱净化,建立了GC/ECD和GC-MS分析莲子中36种有机氯类、拟除虫菊酯类农药残留的分析方法;戴守辉等[8-9]利用加速溶剂萃取,手性气相色谱-质谱法研究了莲藕中多氯联苯手性对映体的选择性富集行为;沈迎春等[1]研究了嘧菌酯、多菌灵和丙环唑对莲藕叶斑病的防治效果和残留试验。

1 实验部分
1.1 仪器与试剂
超高效液相色谱-三重四极杆质谱联用仪,UPLC-Quattro Premier XE配有电喷雾电离(ESI)源和MassLynx 4.1工作站(美国Waters公司);高速离心机(德国Sigma公司);电子分析天平(0.000 1 g和0.01 g,瑞士Mettler-Toledo公司);R-210旋转蒸发仪(瑞士Buchi公司);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);T-18高速均质匀浆器(德国IKA公司);DFT-200手提式高速万能粉碎机(温岭市林大机械有限公司);Vortex Genie2型涡旋振荡器(美国Scientific Industries);MZ 2C型真空抽气泵(德国Vaccubrand公司);6位玻璃大体积负压固相萃取装置、50 mL离心管、0.22 μm Filter Unit滤膜(天津博纳艾杰尔科技有限公司)。
乙腈、甲醇(色谱纯,Honeywell Burdick & Jackson,韩国SK Chemicals);无水硫酸钠、氯化钠(分析纯,上海试四赫维化工有限公司);乙酸铵、甲酸(色谱纯,德国CNW公司);纯净水(杭州娃哈哈有限公司);BondElut C18-SPE柱(500 mg/6 mL,美国Agilent公司);PestiCarb-SPE柱(500 mg/6 mL,天津博纳艾杰尔科技有限公司)。
10 mmol/L乙酸铵溶液:称取0.78 g乙酸铵,加入纯净水并定容至1 000 mL,溶解超声脱气,现配现用。
0.1%甲酸乙腈溶液:准确吸取1.0 mL甲酸,加入乙腈并定容至1 000 mL,混匀超声脱气,现配现用。

空白莲藕、莲叶、新鲜莲子(剥壳得到莲子肉、莲子壳)、田泥和田水均采自湖南张家界种植基地。莲藕切成1 cm以下小段,再切碎,用高速万能粉碎机打碎;莲叶先切成1 cm×1 cm左右小块,再用高速万能粉碎机打碎;新鲜莲子剥壳成莲子肉、莲子壳,再分别用高速万能粉碎机打碎;田泥去石块和植物根茎,晾干压碎过20目筛;田水用滤纸过滤掉固体颗粒;上述样品制备好均存放于-20 ℃冰箱中备用。
1.2 色谱-质谱条件
色谱柱:Acquity UPLC BEH C18柱(50 mm×2.1 mm×1.8 μm);柱温:40 ℃;进样量:5 μL;样品盘温度:8 ℃;流量:0.25 mL/min;流动相:0.1%甲酸乙腈(A)和10 mmol/L乙酸铵溶液(B);梯度程序洗脱:0~1.0 min,15%~40% A;1.0~5.2 min,40%~90% A;5.2~5.3 min,90%~100% A,保持1.3 min;6.6~6.8 min,100%~15% A,平衡保持1.2 min。
电喷雾正电离-多反应监测扫描模式(ESI+-MRM);电喷雾电压:3.0 kV;离子源温度:120 ℃;脱溶剂气温度:350 ℃;锥孔反吹气:N2,50 L/h;脱溶剂气:N2,650 L/h;碰撞气:Ar,0.35 mL/min;倍增电压:650 V;二级质谱母离子驻留时间:20 ms;其他参数见表1。
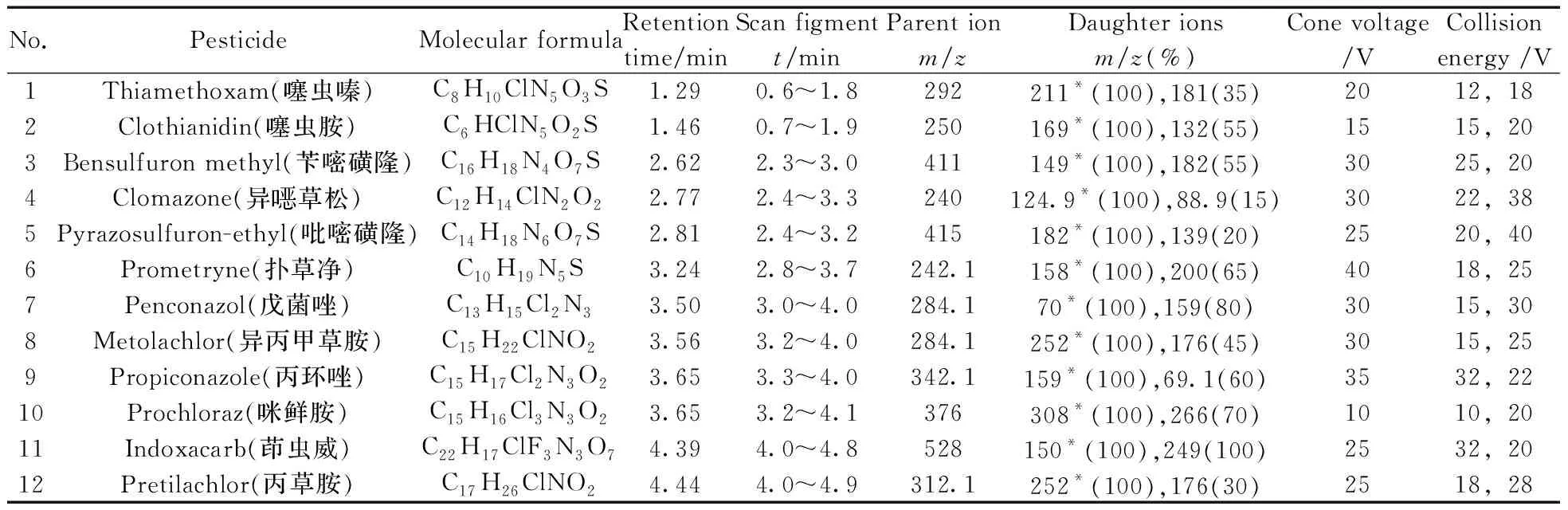
表1 12种农药的ESI+-MS/MS测定条件及相关信息Table 1 ESI+-MS/MS conditions for the residue determination and related information of twelve pesticides
*quantitative daughter ions(ion ratio)
1.3 样品处理
1.3.1莲藕、莲叶、莲子肉、莲子壳及田泥称取磨碎后的莲藕、莲叶、莲子肉、莲子壳或田泥(其中莲叶、莲子壳、莲子肉为5.00 g,莲藕、田泥为10.00 g),置于50 mL塑料离心管中,加10 mL水涡旋混匀,放置30 min,再准确加入20 mL乙腈涡旋浸泡过夜,于17 400 r/min均质2 min,涡旋,加2.5 g NaCl涡旋振荡混匀后,超声提取10 min,5 000 r/min离心5 min,准确分取上层乙腈层10 mL至鸡心瓶,45 ℃下旋转蒸发浓缩近干,加2 mL乙腈超声溶解,上样至500 mg/6 mL PestiCarb-SPE柱,弃去流出液,再加20 mL乙腈-苯(3∶1,体积比)洗脱,合并接收流出液至50 mL鸡心瓶,45 ℃下旋转蒸发浓缩近干,室温下N2吹干,加1.0 mL乙腈-水(1∶1,体积比)超声溶解后,过0.22 μm滤膜至进样瓶,UPLC-MS/MS进样5 μL,基质外标法定量测定。
1.3.2田水量取50 mL田水样,上样至依次经5 mL乙腈、5 mL水活化的500 mg/6 mL BondElut C18-SPE柱上,5 mL水淋洗,10 mL乙腈洗脱,接收流出液至50 mL鸡心瓶,45 ℃下旋转蒸发浓缩近干,室温下用N2吹干,加1.0 mL乙腈-水(1∶1)超声溶解,过0.22 μm滤膜至进样瓶,UPLC-MS/MS进样5 μL,基质外标法定量测定。
1.4 标准溶液配制与标准曲线
分别称取0.010 0 g标准品,用乙腈溶解至50 mL容量瓶并定容,配制成200 mg/L的标准储备液,-18 ℃下避光保存。将12种单标储备液,用乙腈稀释混合配制成20 mg/L的中间标准溶液,然后用乙腈-水(1∶1)稀释成2.50、1.0、0.50、0.25、0.10、0.05、0.025、0.010、0.005 mg/L系列混合标准工作溶液,同时用经“1.3”方法得到的空白样品(莲藕、莲叶、莲子肉、莲子壳、田泥和田水)基质配制相应浓度的基质标准溶液,采用UPLC-MS/MS进样5 μL测定,每个样品进样3次,以12种农药的质量浓度为横坐标(X),3次进样提取离子对峰面积的平均值为纵坐标(Y),进行曲线拟合,并计算基质效应结果。
1.5 回收率与相对标准偏差
称取经“1.2”和“1.3”方法处理测定不含所测12种农药残留的空白样品,分别对应添加0.05 mg/L(低)、0.50 mg/L(中)和5.0 mg/L(高)质量浓度的混合标准溶液1.00 mL(相当于莲叶、莲子壳、莲子肉添加0.01、0.10、1.0 mg/kg;莲藕、田泥添加0.005、0.05、0.50 mg/kg),田水中添加水平为0.1 μg/L(低)、1.0 μg/L(中)、10.0 μg/L(高a)和100 μg/L(高b),所有加标样品涡旋混匀后放置2 h,以更接近于实际样品,然后按照“1.3”样品处理方法进行提取净化,每个加标水平重复6次;同时用提取净化后获得的空白样品基质溶液,配制相应浓度的基质标准溶液,基质标准外标法进行测定,计算加标回收率、相对标准偏差及方法定量下限。
1.6 实际样品测定

2 结果与讨论
2.1 色谱-质谱条件优化与裂解分析
本研究利用BEH C18柱进行分离分析,对比了甲醇、乙腈以及加甲酸作为流动相A,纯水、乙酸铵水溶液、甲酸铵水溶液等作为流动相B的效果。结果表明流动相中加入甲酸或铵盐,有助于提高化合物的离子化响应,对于茚虫威等化合物,流动相中加入铵盐比纯水和甲酸更有助于抑制[M+Na]+生成,从而有利于获得二级质谱分析时所需的母离子[M+H]+,提高二级质谱响应[11];乙腈比甲醇洗脱能力强,柱压低更适合快速分析,同时因样品进样溶剂为乙腈-水,乙腈作为流动相时的色谱峰形优于甲醇。实验对比了不同锥孔电压(10、20、30、40、50 V)下,12种化合物准分子离子峰的色谱峰面积,结果表明大部分化合物的响应最大值在20 V或30 V条件下。选择的最佳锥孔电压见表1。


图1 戊菌唑(A)和异丙甲草胺(B)准分子离子峰的二级质谱裂解途径Fig.1 ESI+-MS/MS fragmentation pathways of penconazole(A) and metolachlor(B) quasi-molecular ion peaks
戊菌唑(m/z284.07)和异丙甲草胺(m/z284.14)的分子量接近,在低分辨率的四极杆质量分析器中无法完全通过准分子离子峰[M+H]+质荷比分离定性,而且二者的色谱保留时间一致,依靠保留时间亦无法定性,选择[M+H]+离子m/z284.1进行二级质谱裂解分析,以5 V为间隔,从5 V到50 V不断增加二级碰撞能量,研究戊菌唑和异丙甲草胺在10、20、30、40、50 V碰撞能量下的二级质谱图。通过质谱裂解首次发现戊菌唑[M+H]+m/z284.1在二级碰撞裂解下,生成子离子m/z173、m/z159、m/z123、m/z89和m/z70,推测碎片裂解途径见图1A;异丙甲草胺[M+H]+m/z284.1在二级碰撞裂解下,生成子离子m/z252、m/z176、m/z145、m/z134、m/z133、m/z132、m/z119、m/z91和m/z77,推测碎片裂解途径见图1B。由此可见,戊菌唑和异丙甲草胺虽然母离子一致,但由于化合物结构不同,二级质谱裂解途径不同,子离子碎片存在差别,最终可根据子离子不同,选择不同的母离子-子离子对对两者进行定性定量区分。
最终优化后12种农药的二级质谱分析条件见表1,以不同的母离子-子离子对提取峰面积进行定量。
2.2 样品前处理条件的优化
莲叶、莲子壳所含叶绿素较多,莲藕、莲子肉所含淀粉较多,田泥沉积物较多,且本文所选农药涉及种类多、水溶解度和极性跨度大。12种农药均易溶于乙腈、丙酮等有机溶剂,采用乙腈提取能有效降低淀粉、蛋白向提取液中迁移,而对于色素类杂质,石墨化炭黑填料是最有效的净化手段。因此本文最终采用乙腈与水混合提取,加入氯化钠盐析离心后,取乙腈层经PestiCarb-SPE柱净化,采用乙腈-苯(3∶1)洗脱,每2 mL分段接收,洗脱溶剂中苯的引入,有助于降低石墨化炭黑对含苯环结构农药的吸附,2 mL乙腈上样时,12种化合物均未流出。图2给出了不同体积乙腈-苯(3∶1)洗脱时12种农药在PestiCarb-SPE柱上的回收率,结果表明除苄嘧磺隆在4~14 mL、吡嘧磺隆在2~8 mL、戊菌唑在0~8 mL和咪鲜胺在2~16 mL流出之外,其余8种化合物均在0~4 mL流出。为保证回收率,同时考虑到基质引入后的影响,最终对莲叶、莲藕、莲子肉、莲子壳和田泥样品,采取PestiCarb-SPE柱净化,2 mL乙腈溶解上样,20 mL乙腈-苯(3∶1)洗脱接收。

图2 乙腈-苯(3∶1)不同体积下洗脱PestiCarb-SPE柱上12种农药的回收率Fig.2 Elution recoveries of twelve pesticides in PestiCarb-SPE column by different volumes of acetonitrile-benzene(3∶1)

2.3 线性关系、仪器定量下限与基质效应
在“1.2”条件下进样5 μL测定溶剂标准溶液和基质标准溶液样品,每个浓度重复进样3次,标准溶液的配制及标准曲线的考察步骤见“1.4”。实验结果表明,在0.005~2.500 mg/L(噻虫胺为0.010~2.500 mg/L)范围内,可获得12种农药的溶剂标准曲线、基质标准曲线和相关系数(见表2),相关系数(r2)均大于0.97,以标准曲线最低浓度(S/N>10)为仪器定量下限,可得除噻虫胺的仪器定量下限为0.01 mg/L外,其余农药均为0.005 mg/L。
以12种农药在不同基质中的线性方程斜率与在乙腈-水溶剂中线性方程斜率的比值考察基质效应(ME),结果见表2。在莲叶(0.15≤MEs≤0.71)、莲子壳(0.41≤MEs≤1.26)中基质减弱效应表现较强,在莲藕(0.39≤MEs≤1.08)、莲子肉(0.34≤MEs≤1.04)中基质减弱效应较小,尤其是色谱中较早流出的化合物,如噻虫嗪(0.15≤MEs≤0.49)、噻虫胺(0.34≤MEs≤0.58);相对而言,田泥(0.95≤MEs≤1.44)、田水(0.81≤MEs≤2.17)中未表现出基质效应或存在一定的基质增强效应。因此最终采用相应基质标准溶液进行定量分析。

表2 不同样品中12种农药的相关系数、基质效应、平均回收率及相对标准偏差Table 2 Correlation coefficients(r2),matrix effects(MEs),average recoveries(A.R.) and RSDs for twelve pesticides in different matrices
(续表2)

PesticideNo.Sample matrixr2MEsA.R./% *RSD/%LowMiddle HighLowMiddleHigh9Solvent0.993 4Lotus leaf0.994 50.69103±2.6105±5.6106±3.52.65.33.3Lotus root0.990 50.95116±14.299.0±7.684.6±10.312.27.712.2Lotus seed meat0.993 70.81104±7.7103±3.3103±2.87.43.22.7Lotus seed shell0.991 20.8790.3±3.391.2±1.894.3±3.33.61.93.5Mud0.998 71.1773.5±1.185.0±2.9104±2.71.53.42.6Field water0.992 21.0885.4±5.287.9±3.592.8±2.3a ,87.5±2.0b6.14.02.5a,2.2b10Solvent0.993 0Lotus leaf0.997 70.5081.9±5.588.7±5.293.1±2.86.75.93.0Lotus root0.992 80.9695.3±13.492.3±5.781.9±11.714.16.214.3Lotus seed meat0.991 90.7290.8±6.983.9±5.886.8±2.37.77.02.7Lotus seed shell0.992 30.7577.4±3.775.6±4.076.0±2.94.85.23.7Mud0.998 71.0538.1±2.738.7±3.555.7±3.97.19.16.9Field water0.991 91.1271.2±12.054.0±5.361.2±4.6a,57.8±5.2b16.99.77.5a ,9.1b11Solvent0.996 7Lotus leaf0.997 30.71102±13.1107±7.5105±7.212.97.16.8Lotus root0.991 01.04109±11.598.7±4.593.9±11.510.64.512.3Lotus seed meat0.995 40.94106±3.6103±2.6101±3.03.42.52.9Lotus seed shell0.987 50.98103±8.296.0±11.191.8±8.38.011.69.0Mud0.999 31.1393.9±8.496.6±6.399.2±1.89.06.51.8Field water0.989 41.0576.2±8.565.3±4.655.7±3.1a ,64.5±3.8b11.17.15.5a,5.9b12Solvent0.990 3Lotus leaf0.997 30.54107±3.5102±2.7107±2.63.32.72.4Lotus root0.998 20.6994.8±13.199.2±4.9101±11.213.84.911.1Lotus seed meat0.997 40.73102±6.5104±1.9105±2.66.31.92.5Lotus seed shell0.993 00.9392.9±4.293.2±2.094.1±1.54.52.21.6Mud0.999 41.1692.9±2.991.9±4.699.7±0.83.25.00.9Field water0.991 71.6383.0±2.487.7±3.893.4±1.6a ,85.8±3.5b2.94.31.7a ,4.1b
*spiked concentrations were 0.01,0.10 and 1.00 mg/kg for lotus leaf,lotus seed shell and lotus seed meat,0.005,0.05 and 0.50 mg/kg for lotus root and mud,and 0.1,1.0,10.0 μg/L(a) and 100.0 μg/L(b) for field water;pesticide No. were the same as that in Table 1
2.4 回收率、相对标准偏差与方法定量下限
按照“1.5”进行加标回收率试验,12种农药化合物在不同样品基质中的平均回收率(A.R.)和相对标准偏差(RSD)结果见表2。结果表明:莲叶中12种化合物的A.R.为81.9%~116%,RSD为1.5%~12.9%;莲藕中12种化合物的A.R.为81.4%~116%,RSD为4.4%~25.1%;莲子肉中12种化合物的A.R.为83.9%~107%,RSD为1.3%~14.8%;莲子壳中12种化合物的A.R.为75.6%~103%,RSD为1.6%~11.6%;田泥中除咪鲜胺的A.R.为38.1%~55.7%(<60%)和RSD为6.9%~9.1%外,其余化合物的A.R.为64.6%~104%,RSD为0.9%~9.5%;田水中除噻虫胺在低质量浓度(0.10 μg/L)无法检出,咪鲜胺和茚虫威在中、高加标水平下的A.R.为54.0%~65.3%(<70%),RSD为5.5%~16.9%外,其余化合物和加标水平下A.R.为71.2%~101%,RSD为0.9%~16.9%。根据残留试验标准方法要求,以最低加标水平为方法定量下限(LOQ),结果表明:田水中除噻虫胺的LOQ为1.0 μg/L之外,其余均为0.1 μg/L,12种化合物在莲藕、田泥中LOQ为0.005 mg/kg,在莲叶、莲子壳和莲子肉中LOQ为0.01 mg/kg。
2.5 实际样品的测定

3 结 论
为保证特色小宗作物莲藕的生产和食用安全,本文通过采用乙腈-水混合提取,氯化钠盐析离心,分取乙腈提取液过PestiCarb固相萃取柱净化洗脱,水样采用C18固相萃取柱直接富集净化洗脱,洗脱液浓缩定容后,超高效液相色谱-串联质谱基质外标法定量测定,建立了莲藕、莲叶、莲子肉、莲子壳、田泥和田水中12种农药残留的分析方法,并用于田间残留试验实际样本的测定。本方法符合残留分析标准(RAQCG)的要求[10],能够满足莲叶、莲藕等样品中不同农药残留的检测要求,并对其他农产品及环境样本中12种农药的检测具有参考意义。
