水稻HD-ZipⅢ家族成员OsHox10的功能分析
2018-10-24靳亚军孔晓聪邳瑞雪石雨鹭栾维江
杨 波 ,罗 倩 ,靳亚军 ,熊 炜 ,孔晓聪 ,王 荃 ,邳瑞雪 ,石雨鹭 ,栾维江
(1.天津师范大学生命科学学院,天津300387;2.天津师范大学天津市动植物抗性重点实验室,天津300387)
亮氨酸拉链蛋白(Homeodomain-leucine zipper protein,HD-Zip)是植物特有的一类转录因子,保守性较高,通常含有1个同源异型域(Homeodomain,HD),属于同源异型域转录因子超家族.HD-Zip的异型域由60或61个保守氨基酸残基组成,在空间上形成1个三股螺旋结构,并被1个环和1个转角分开.三股螺旋结构与特异DNA分子的双螺旋大沟相结合,担任该转录因子的DNA结合域,调控基因转录过程[1-2].根据结构域的保守性、空间结构的差异性、与DNA结合的特异性和生物学功能,可以将众多的HD-Zip蛋白分为4个亚家族,即HD-ZipⅠ、HD-ZipⅡ、HD-ZipⅢ和HD-ZipⅣ[3].
HD-Zip家族基因的表达常受低温、激素、光照、逆境等因素的诱导,主要参与光信号和激素信号的介导途径,对植物胚胎形态发生、分生组织形成、侧生器官发生和维管系统发育等多个过程都起到重要调控作用[4].HD-ZipⅢ家族主要参与调控植物胚胎形态发生、分生组织形成等过程.如拟南芥的基因组中含有5个HD-ZipⅢ基因,分别为PHB、PHV、REV、ATHB8及ATHB15.其中PHB、PHV和REV在功能上存在冗余,它们在侧生分生组织以及花器官的分化过程中发挥重要作用,同时还影响叶片的极性,当REV的功能缺失时,植物形成畸形的叶和花器官,当PHB和PHV过量表达时,植物的叶片沿近轴面生长,最终也形成畸形叶;而ATHB8和ATHB15在功能上与PHB、PHV、和REV拮抗,能够抑制rev、phv双突变体植株在生长发育过程中的缺陷[5].在陆生植物中HD-ZipⅢ家族成员是高度保守的,但是由于进化,在不同的物种中,彼此同源的成员在功能上也已经有所分化[6].
单子叶植物水稻(Oryza sativa)的HD-ZipⅢ亚家族中也存在 5个基因,分别为 OsHox9、OsHox10、OsHox29、OsHox32、OsHox33,目前对该家族的研究已取得一定进展.Ai等[7]发现OsHox9的RNAi干扰植株表现出株高变矮、分蘖数减少的表型.Li等[8]研究发现过量表达OsHox32会使植株产生向近轴面卷曲的窄叶,此外由于叶夹角减小导致株型直立,株高变矮.Itoh等[9]发现异位表达microRNA166-resistance的OsHB3(即OsHox33),植株表现出严重的缺陷,包括产生异位的叶缘、芽和辐射状的叶片.Luan等[10]研究发现干扰OsHox33的表达能够加速水稻叶片衰老.本研究采用反向遗传学方法初步探索了水稻HD-ZipⅢ亚家族成员OsHox10的功能,明确了该基因的表达模式和亚细胞定位,并初步了解该成员与植物激素和干旱胁迫的关系.
1 材料与方法
1.1 材料
本研究以粳稻品种中花11(Oryza sativa L.ssp.japonica cv.Zhonghua 11)及其转基因植株为实验材料.所有材料种植于天津市农业科学院试验田和海南陵水南繁育种基地,田间保持常规管理.
1.2 仪器与试剂
1.2.1 仪器
Veriti 9902 PCR仪、7500实时荧光定量PCR系统,美国ABI公司;凝胶成像分析仪,北京Bio-Rad公司;BG-Power 600电泳仪,美国Baygene公司;DM5000B正置荧光显微镜,德国Leica公司.
1.2.2 试剂
PCR试剂、Real-time PCR试剂、反转录试剂盒、T4连接酶等,南京诺唯赞生物科技有限公司;限制性内切酶、DNA Marker,日本Takara公司;DNA凝胶回收试剂盒、质粒小提试剂盒,北京康为世纪生物有限公司;引物合成及DNA测序由武汉金开瑞生物科技有限公司完成.
1.3 过表达载体构建和水稻遗传转化
从生长30d的水稻幼苗中提取总RNA,反转录后,以cDNA为模板扩增OsHox10的全长ORF,所用引物为:OsHox10-F(5′-TACggtaccATTTGGCTTTGGCGAGGTAG-3′)和 OsHox10-R(5′-TACgagctcTGGGATGGTCACACAAAGGA-3′)(小写字母为载体中相应的酶切位点).将扩增的片段酶切回收后,连入pUBI1460空载体中,获得重组载体pUBI1460-OsHox10,通过酶切鉴定及测序确认无误后转入农杆菌中,用农杆菌介导的遗传转化法导入野生型中花11中,获得过表达转基因植株.
1.4 Real-time PCR分析
收集水稻新鲜的幼根、幼嫩叶片、茎顶端分生组织、成熟叶鞘及4~13 cm长的幼穗,用Trizol试剂提取这些组织器官的总RNA.用DNase I去除基因组DNA污染后进行反转录,得到的cDNA作为Realtime PCR反应的模板,OsHox10表达检测所用的引物为 OsHox10-F2(5′-AACTTCCCTTGTCGCCTTAC-3′)和OsHox10-R2(5′-GTGAACATTGCTATCCTCGG-3′),以OsActin1作为内参进行相对定量,引物为ActinF(5′-GACTCTGGTGATGGTGTCAGC-3′)和 ActinR(5′-GGCTGGAAGAGGACCTCAGG-3′).Real-time PCR 反应按照 SYBR Green PCR master mix(Vazyme,南京)试剂盒说明操作,在ABI 7500型实时荧光定量PCR仪上进行扩增反应,并用2-ΔΔCt方法进行相对定量分析,每个反应重复3次.
1.5 OsHox10的亚细胞定位
从生长30 d的水稻幼苗中提取总RNA,反转录后,以cDNA为模板扩增OsHox10的全长ORF(去除终止密码子).所用引物为GFP-Hox10-F(5′-TCA-gagctcATTTGGCTTTGGCGAGGTAG-3′)和 GFP-Hox10-R(5′-TACgtcgacCACAAAGGACCAGTTGACGA-3′).将扩增得到的目的片段经酶切回收后与空载体pCAMBIA35S::GFP进行连接,使OsHox10与GFP融合.测序鉴定正确后,分别将含有融合载体pCAMBIA35S::OsHox10-GFP和空载体的农杆菌注射进烟草(Nicotiana tabacum)叶片,室温下正常培养2 d后,在正置荧光显微镜下观察荧光表达情况.
1.6 植物激素及干旱胁迫处理
激素处理中,分别用0.1 mmol/L的乙烯合成前体1-氨基环丙烷羧酸(ACC)、脱落酸(ABA)及茉莉酸(JA)处理生长40 d的野生型水稻幼苗,然后在预定的时间点收集叶片,提取总RNA,反转录后进行Realtime PCR分析.干旱胁迫处理中,水稻幼苗生长于土培周转箱中,排水后不再浇水,在处理0、2、3、4、5、7 d后分别取样,提取叶片总RNA,反转录后进行Real-time PCR分析.
2 结果与分析
2.1 HD-ZipⅢ家族成员序列分析
分析植物HD-ZipⅢ家族成员的序列,结果如图1所示.
HD-Zip家族成员都含有同源异型结构域HD和亮氨酸拉链结构域 LZ(Leucine-zipper domain)[7],HD区域是由60或61个保守氨基酸构成的,在空间上形成三股螺旋结构,能够识别靶基因启动子5′上游区的特定核苷酸序列,LZ区位于HD区的羧基端,是1个一侧富含疏水氨基酸的双ɑ螺旋,在该区域中每隔7个氨基酸就分布着1个亮氨酸残基,在ɑ螺旋的疏水表面排成一条直线.HD-ZipⅢ家族的成员除了含有HD及LZ保守结构域外,还包含2个附加结构域(START和 MEKHLA)(图1a).START是类固醇敏感的脂质调节蛋白结构域,MEKHLA可能与植物接收光信号调控有关[8].
为了比较不同植物HD-ZipⅢ家族成员间的差异,从NCBI数据库检索了6种不同植物的HD-ZipⅢ家族蛋白质序列信息.小立碗藓(Physcomitrella patens):PpHB11(ABG73236)、PpHB12(ABG73237)、PpHB13(ABG73238)、PpHB14(ABG73239);白云杉(Piceaglauca):PgHB3(ADV04322)、PgHB4(ADV04323)、PgHB5(ADV04324)、PgHB6(ADV04325);拟 南 芥(Arabidopsis thaliana):REV(AED97367)、PHV(O04292)、PHB(AEC09012)、 AtHB15(AEE32762)、AtHB8(AEE86138);水稻(Oryza sativa):OsHox10(A2XBL9)、OsHox9(A2Z8L4)、OsHox32(A2XK30)、OsHox33(A2ZMN9);毛果杨(Populus trichocarpa):PtrHB1(AAX19050)、PtrHB2(AAX19051)、PtrHB3(AAX19052)、PtrHB4(AAX19053)、PtrHB5(AAX19054)、PtrHB6(AAX19055)、PtrHB7(AAX19056)、PtrHB8(AAX19057);玉米(Zea mays):rld1(NP_001296150)、rld2(XP_0086 65074).聚类分析发现,在系统发育中,OsHox9和OsHox10在结构上更相似,而OsHox32和OsHox33相似(图1b、1c),因此它们在功能上可能有冗余.在植物演化上,OsHox9和OsHox10与玉米的rld1和rld2关系更近,OsHox32和OsHox33则与拟南芥的PHB和PHV关系更近.它们和毛果杨及小立碗藓关系较远,小立碗藓中的HD-ZipⅢ成员自成一类.表明HD-ZipⅢ成员在植物进化过程中已有了一定的分化.
2.2 OsHox10的表达特异性分析
为了研究OsHox10在水稻不同组织中的表达情况,分别提取野生型水稻不同组织器官的总RNA,用Realtime-PCR的方法检测OsHox10的表达,结果如图2所示.
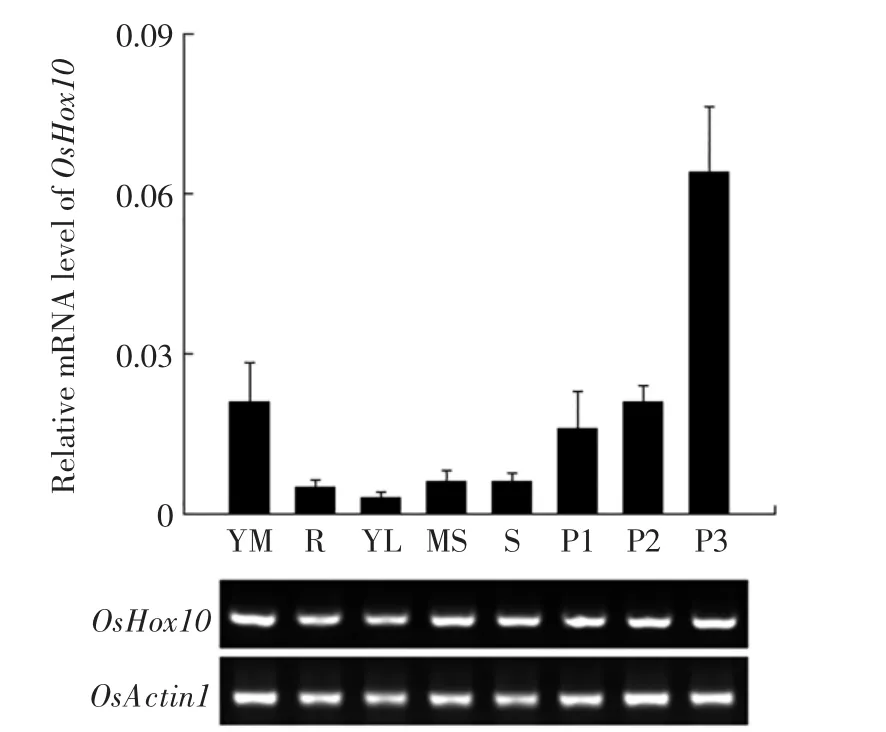
图2 OsHox10的组织特异性表达分析Fig.2 Tissue-specific expression analysis of OsHox10
由图2可以看出,OsHox10在不同组织器官中均有表达,在茎顶端分生组织(YM)和幼穗(P3、P2、P1)中表达量较高,在根、茎、叶及叶鞘中表达较低,表明OsHox10在分裂旺盛部位有较高表达.
2.3 植物激素及干旱胁迫处理对OsHox10表达的影响
分别用ACC、ABA和JA处理同一时期的野生型水稻,取样后,用Realtime-PCR分析OsHox10的表达,结果如图3所示.
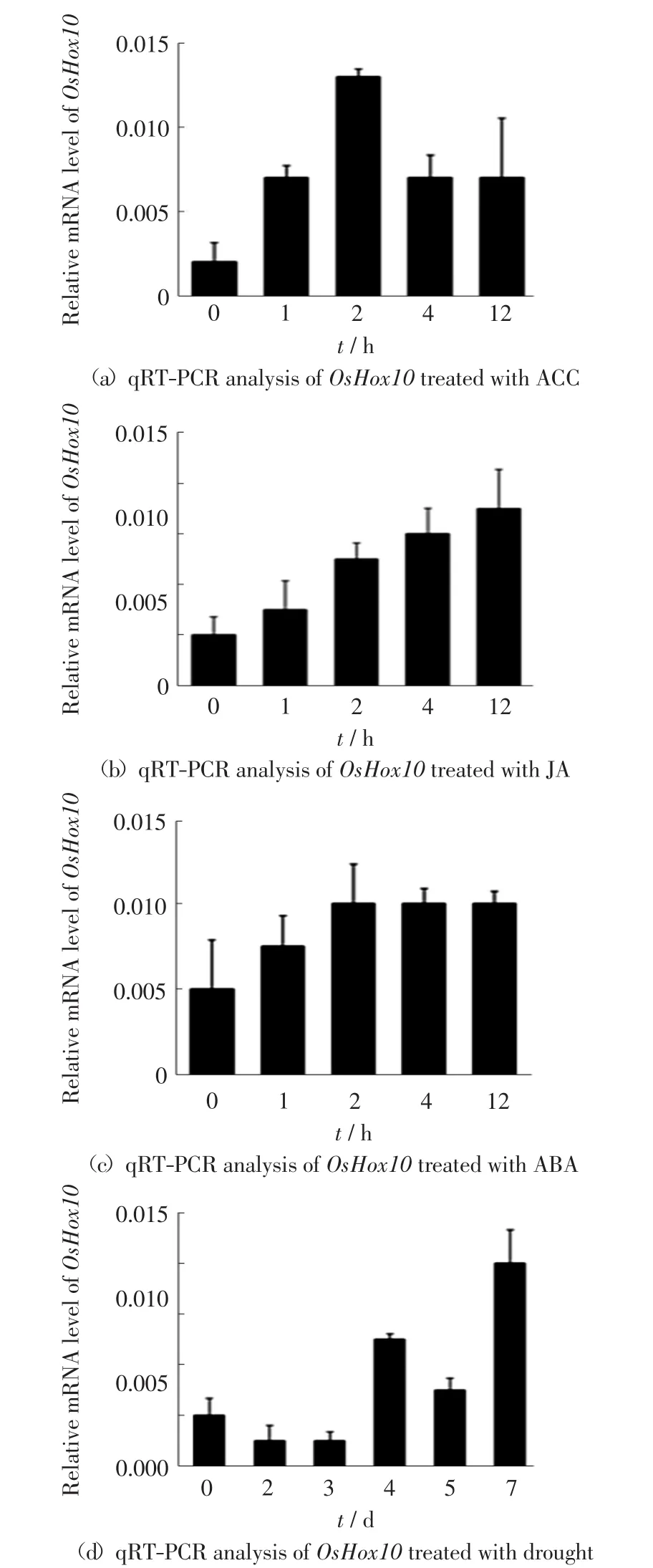
图3 激素和干旱胁迫对OsHox10表达的影响Fig.3 Expression of OsHox10 under the treatment of phytohormones and drought stress
由图3可以看出,3种激素处理后,OsHox10的表达量较野生型相比都有所升高.ACC处理2 h后,OsHox10的表达量达到峰值,之后又下降;JA处理12h后,OsHox10的表达量是对照的3倍;ABA处理4 h后,OsHox10的表达量达到峰值.另外,分析干旱胁迫处理下OsHox10的表达,结果表明处理的前3 d对OsHox10的表达没有明显影响,处理4 d之后,表达量明显上升,表明干旱胁迫诱导了OsHox10的表达(图3d).因此,推测OsHox10可能与外界不良环境刺激及激素信号有关.
2.4 OsHox10的亚细胞定位
为了进一步明确OsHox10的表达模式,构建目的基因与GFP蛋白融合的表达载体(p35S::OsHox10-GFP),对目的基因进行亚细胞定位,以确定OsHox10转录因子在细胞中存在或发挥作用的位置.分别将含有目的基因的融合表达载体和空质粒载体在烟草中进行瞬时表达,结果如图4所示.
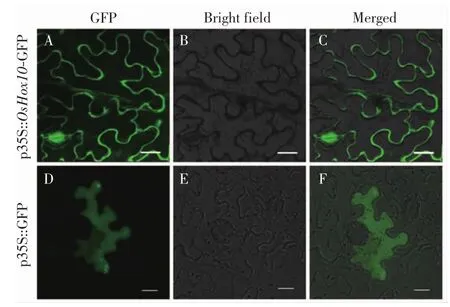
图4 OsHox10的亚细胞定位Fig.4 Subcellular localization of OsHox10
由图4可以看出,OsHox10-GFP融合蛋白在细胞周边有强烈表达.在成熟的植物表皮细胞中,由于液泡的存在,细胞质主要存在于细胞周边,因此OsHox10可能定位于细胞质中或细胞质膜上.空载体对照中,整个细胞中(如细胞膜、细胞核、细胞质)都能检测到强烈的荧光,没有特异性定位.
2.5 OsHox10过表达转基因植株表型分析
为了揭示OsHox10在水稻生长发育中的功能,构建了1个OsHox10的过表达载体,并通过农杆菌介导的遗传转化法,将过表达载体导入野生型水稻的愈伤组织中,再经过分化获得转基因幼苗,最终获得了7个独立株系的T0代过表达转基因植株,共计73株.用载体中特异的NPTII基因引物对T0代植株的基因组DNA进行PCR检测,结果如图5(a)所示.过表达转基因植株中有51株(5个株系)为转基因阳性,阳性率约为70%.种植3个T0代转基因阳性独立株系及对照,获得T1代植株,Real-time PCR分析表明转基因阳性株系中OsHox10明显过量表达,如图5(d)所示.观察田间表型发现,每个株系的过表达植株叶片表现出不同程度的皱缩、卷曲,尤其是靠近叶鞘部分卷曲明显呈锯齿状,如图5(b)和5(c)所示,表明过量表达OsHox10会影响水稻叶片的发育及株型建成.
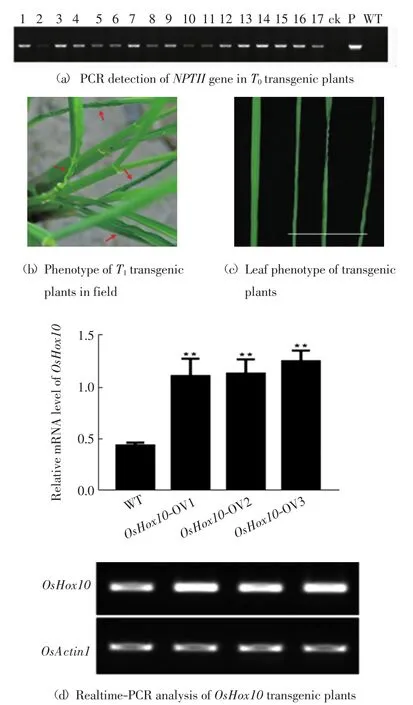
图5 过表达转基因植株的表型Fig.5 Phenotype of overexpressing transgenic plants
3 讨论与结论
本研究通过反向遗传学方法对水稻HD-ZipⅢ家族成员OsHox10的功能进行了分析,发现过量表达OsHox10能使水稻叶片形态异常,表明其对水稻株型建成具有重要作用.在拟南芥中,HD-ZipⅢ家族基因PHB、PHV和REV在功能上存在冗余,影响叶片极性,当REV的功能缺失时,植物形成畸形叶,当PHB和PHV过量表达时,植物的叶片沿近轴面生长,最终也形成畸形叶[5].在水稻中,Itoh等[9]发现过量表达HD-ZipⅢ家族基因 OsHB3、OsHB5(OsHox33)、OsHox29 会导致叶片畸形,形成卷叶或丝状叶;Li等[8]在对OsHox32的研究中也发现过量表达该基因会导致形成狭窄卷曲的畸形叶.这些研究与过量表达OsHox10的结果相互印证,表明水稻HD-ZipⅢ家族基因功能相对保守但又不尽相同.此外,组织特异性分析显示,OsHox10在分裂旺盛的部位表达量较高,表明其可能与器官发生分化有关,这与HD-ZipⅢ家族参与分生组织形成、侧生器官发生等多个生长发育过程的情况相吻合.
拟南芥HD-ZipⅢ的一个成员AtHB8的转录受生长素的诱导[11].Itoh等[9]发现,给水稻施加外源生长素能导致HD-ZipⅢ家族基因的表达量上升.此外,有研究[3]发现,干旱胁迫和外源施加脱落酸(ABA)也能诱导拟南芥HD-Zip家族基因ATHB6、ATHB7和ATHB12的表达.本研究结果表明植物激素及干旱胁迫能诱导OsHox10的表达,说明OsHox10可能与逆境胁迫和激素相关.
细胞核内蛋白质的N端有特殊的核定位信号(Nuclear localization signal,NLS),能够指导蛋白质进入细胞核,一般NLS是由8~10个富含精氨酸、赖氨酸及脯氨酸等带正电荷的氨基酸残基组成,以短肽的形式存在于N端,大多数转录因子具有NLS,定位于细胞核中,但不是所有的转录因子都如此[12].在小麦NAC类转录因子家族中,TaNTL1与GFP融合蛋白就定位在细胞膜上,当TaNTL1的跨膜域缺失后会特异地定位在细胞核中,因此TaNTL1是作为跨膜转录因子行使功能的,此外还发现TaNTL2和TaNTL3也是跨膜转录因子[13].本研究结果表明,OsHox10定位于细胞质或细胞膜上,分析其N端可能是核定位信号的氨基酸序列,但N端NLS的特点不明显,结合定位结果,推测它可能是具有细胞质特性的转录因子.OsHox10的精确功能还有待进行更深入细致的研究.
