利用CRISPR/Cas9系统构建稳定敲除CBX2基因的A549细胞系
2018-10-24董旭张兆域苟芳琳兰蓓
董旭,张兆域,苟芳琳,兰蓓
(天津医科大学生物化学与分子生物学系,天津300070)
多梳蛋白家族(PcG)是重要的表观遗传修饰调控复合物,发挥转录抑制功能[1],在生物进程中具有十分重要的作用,如X染色体失活、维持胚胎干细胞多能性和自我更新、细胞命运决策和发展控制[2]。在哺乳动物中,PcG主要有两种表现形式:多梳抑制复合物 1(PRC1)和多梳抑制复合物 2(PRC2),它们是维持胚胎干细胞和成体干细胞干性必需的重要组分[3],对细胞周期调控、DNA修复、细胞分化、衰老和死亡发挥重要的作用[4]。PRC2依赖于其组分EZH2在转录起始发挥作用。EZH2是甲基转移酶,能特异性三甲基化组蛋白H3K27,从而抑制转录。PRC1通过识别H3K27me3并募集到染色质上,维持染色质的抑制状态。此外,PRC1还能泛素化组蛋白H2A,进一步发挥转录抑制作用[5]。CBX蛋白家族是PRC1的经典组成成分,主要功能为识别H3K27me3并将PRC1定位到染色质。CBX蛋白家族包括CBX2,CBX4,CBX6,CBX7 和 CBX8,其拥有共同的结构域,从而在转录抑制方面功能相似[6]。同时,CBX家族成员之间也存在结构差异,因此功能也有所差别:CBX4拥有SUMO活性[7],这种活性在人类肿瘤细胞增殖和DNA损伤修复过程中发挥作用[8]。CBX6是维持胚胎干细胞多能性和干细胞分化所需的关键因子[9]。CBX7和CBX8能够在癌症中发挥作用。CBX7是研究最广泛的CBX家庭成员,有大量的研究表明它在多种癌症中有特异性活性[10],能够抑制脑癌,结肠癌和肺癌等[11]。CBX8对MLL/AF9白血病发生至关重要[12]。然而,CBX2对癌症的作用及分子机制还并不清楚,有待更为深入的研究。CRISPR/Cas9技术是一种高效、方便、灵活的基因编辑工具[13],是细菌和古细菌演化形成的一种对抗入侵病毒及外源DNA的适应性免疫防御[14]。CRISPR/Cas9系统已被设计成能够在多个真核系统中实现RNA引导基因组修改的工具,使基因编辑更为方便[15]。通过人工设计sgRNA,使外源核酸酶Cas9和基因组靶基因位点相结合并随机剪切,然后通过同源重组等DNA修复过程最终实现基因敲除。本文利用CRISPR/Cas9系统构建稳定敲除CBX2基因的A549细胞系。该细胞系为今后研究CBX2对肺腺癌的作用及分子机制提供了实验基础。
1 材料与方法
1.1 菌株,质粒和细胞系 DH5α购自北京博迈德生物公司,PX459载体购自Addgene公司,A549细胞购自ATCC公司。
1.2 主要试剂耗材 胎牛血清和高糖培养基购自Hyclone公司,胰酶购自Gibco公司,蛋白Marker购自Thermo Fisher Scientific公司,30%丙烯酰胺购自北京索莱宝公司,Opti-MEM购自Gibco公司,CBX2蛋白抗体和β-actin蛋白抗体购自Sigma公司,Lipofectamine®2000转染试剂购自Thermo Fisher Scientific公司,T4 PNK(T4多聚核苷酸激酶)和Bbs I限制性内切酶及T4连接酶购自NEB公司,DNA小提试剂盒购自Tiangen公司,质粒大提试剂盒购自北京庄盟生物公司。
1.3 PX459-CBX2-sgRNA质粒构建
1.3.1 载体酶切和回收 用Bbs I酶切PX459质粒,酶切体系为:PX459 1 μg,Bbs I 1 μL,10X Buffer 2 μL,ddH2O 16 μL,37 ℃反应 1 h。用新鲜的 TAE buffer配置1.5%DNA胶,酶切产物进行琼脂糖凝胶电泳,用DNA胶回收试剂盒将质粒条带切胶回收。
1.3.2 引物退火延伸和添加磷酸根 反应体系为sgRNA 上下游引物(100 μmol/L) 各 1 μL,T4 PNK(T4多聚核苷酸激酶)0.5 μL,T4连接酶 buffer 1 μL,ddH2O 6.5 μL。其中T4 PNK是一种多聚核苷酸5′羟基激酶,可以催化ATP的γ位磷酸基团向单链或双链DNA、RNA、寡核苷酸或带有3′磷酸基团的单核苷酸的5′羟基转移。加完体系后将EP管放入37℃金属浴30min,使引物5′端加上磷酸根。然后在95℃金属浴放置5 min后,缓慢降温到25℃(1℃/min),完成引物退火。
1.3.3 载体和引物连接 反应体系为:经过酶切回收的PX459载体质粒1 μL,磷酸化和退火的引物1 μL,10X T4 连接酶 buffer 1 μL,T4 连接酶 1 μL,ddH2O 6 μL。16℃连接过夜。
1.3.4 转化及重组质粒测序 将连接产物转化到DH5α,挑取单克隆菌落并用质粒提取试剂盒提取质粒DNA。由华大基因公司对重组质粒进行测序。1.4 转染细胞 将A549细胞铺于6孔板,24 h后,使细胞密度达到70%。转染体系为:Optimem200μL,重组质粒 3 μg,Lipofectamine®2000 转染试剂 6 μL。室温静置20 min,形成脂质体后将转染体系加入到6孔板细胞中,轻轻混匀,放入37℃、5%CO2培养箱中培养。细胞转染6 h后换成新鲜培养基,继续培养48 h。
1.5 细胞筛选及分离单克隆细胞 由于PX459载体中带有嘌呤霉素抗性,所以成功转染的细胞将有其抗性。细胞转染48 h后加入含有1 μg/mL的嘌呤霉素的培养基进行筛选,72 h后将存活细胞消化,用细胞计数板计数,稀释为1个/100 μL的细胞浓度,将细胞传入96孔板,每孔加100 μL细胞液,可得到单克隆细胞(每孔只有一个细胞)。将单克隆细胞扩大培养。
1.6 单克隆细胞CBX2蛋白检测 收取转染PX459-CBX2-sgRNA的单克隆和转染空载PX459单克隆细胞,PBS洗两遍,再用200 μL PBS重悬。在细胞悬液中加入50 μL的5X蛋白缓冲液,放于95℃金属浴震荡加热30 min。将蛋白样品进行SDS-PAGE(80 V,120 min),转膜(400 mA,90 min),用 5%脱脂牛奶封闭30 min,CBX2蛋白抗体(1:1 000)结合过夜,结合二抗后曝光。之后将膜用1 mol/L NaOH进行洗脱,再重新结合β-actin抗体,检测β-actin内参蛋白表达量。
2 结果
2.1 sgRNA的设计 在NCBI网站查询CBX2的基因序列,在第一个外显子区域设计针对CBX2敲除的sgRNA(图1A)。sgRNA序列应该位于Cas9蛋白识别的保守区PAM(NGG)之前。将CBX2第一个外显子序列提交于麻省理工大学张峰sgRNA设计网站http://crispr.mit.edu/,得到5条待选序列(图1B)。选出分数最高的序列为CBX2-sgRNA序列,该序列对应CBX2基因的位置如(图1C)所示。在CBX2-sgRNA正向序列5′端添加CACCG碱基,在反向序列5′端添加AAAC碱基,在3′端添加末尾加上C碱基(表1),从而能够与PX459质粒经BbsⅠ酶切后形成的黏性末端互补。
2.2 PX459-CBX2-sgRNA重组质粒的构建和鉴定 将合成的CBX2-sgRNA两条引物退火,形成双链,并用T4 PNK在5′端加磷酸根。PX459质粒用Bbs I酶切并切胶回收,与退火的CBX2-sgRNA连接,构建PX459-CBX2-sgRNA质粒(图2A)。将PX459-CBX2-sgRNA重组质粒测序,测序结果显示CBX2-sgRNA:5′-CACCGCTTGCTCAGGATGCACT CGG-3′序列正确插入到PX459中(图2B)。

表1 CBX2-sgRNA寡核苷酸序列Tab 1 The oligo sequences of CBX2-sgRNA

图1 CBX2-sgRNA的设计Fig 1 Design of sgRNA of CBX2
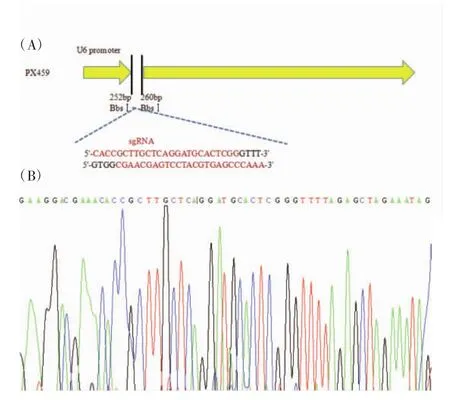
图2 PX459-CBX2-sgRNA重组质粒的构建与鉴定Fig 2 Construction and identification of PX459-CBX2-sgRNA recombinant plasmid
2.3 CBX2敲除细胞系构建及鉴定 将PX459-CBX2-sgRNA重组质粒和空载PX459分别转染入A549细胞中,培养48 h后,加嘌呤霉素筛选转染阳性细胞。经过3 d的嘌呤霉素筛选(正常细胞无存活),将存活的细胞稀释到96孔板中分离单克隆。选择5个单克隆进行扩大培养,并通过Western blot检测细胞系中CBX2的表达情况。结果显示,与转染空载PX459的单克隆细胞系相比,5个敲除细胞系中CBX2蛋白表达明显降低(图3)。
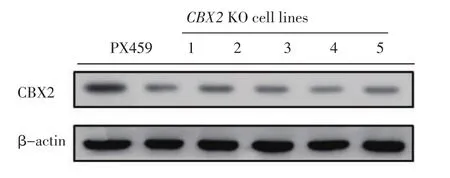
图3 转染PX459-CBX2-sgRNA质粒的5个单克隆细胞系CBX2的表达量显著低于对照组细胞Fig 3 The expression of CBX2 protein in five A549 CBX2 knockout cell lines was significantly lower than that in the control group
3 讨论
PRC1对维持胚胎干细胞干性、调控细胞周期以及癌症的发生和转移有重要的作用。PRC1的经典组分CBX蛋白家族有共同的结构域:C端的PcR box(polycomb repressor box),N 端的染色质区,和靠近N端的DNA结合区。C端结构域主要发挥转录抑制作用,还可以和PRC1另一组分泛素连接酶Ring1B蛋白相互作用。N端的染色质区主要调控异染色质和基因表达,并且可以结合H3K27me3。
虽然CBX能够抑制转录,但是其在癌症中的作用机制还不明确。有研究表明,小鼠CBX2同源基因M33敲低后,可以减弱E2F依赖性的细胞周期进展,使小鼠胚胎成纤维细胞阻滞在G0/G1期[16]。在人类造血干细胞中,CBX2敲低能够促进抑癌基因p21的表达,从而抑制细胞增殖、促进细胞凋亡[17]。由此推测,CBX2极大可能在癌症的发生和转移过程中也发挥着重要作用,但是其具体的作用机制还有待进一步研究。因此我们构建稳定敲除CBX2基因的肺腺癌细胞系对研究CBX2基因在肺腺癌的发生发展机理有重要的意义。
CRISPR/Cas9系统是种高效、方便的基因编辑工具,近年来研究人员对它不断的改进和应用,使得该系统对基因编辑拥有多种优势,包括操作简单,靶向精确性高,基因修饰率高,可遗传,实验成本小,周期短。本实验利用CRISPR/Cas9系统,设计了针对CBX2敲除的sgRNA,并连入PX459载体,构建重组质粒。将重组质粒转染入A549细胞中,采用嘌呤霉素筛选细胞后,分离单克隆细胞,成功构建了敲除CBX2基因的A549稳定细胞系。但是由于肿瘤细胞存在染色体异常导致的多倍体细胞,利用CRISPR/Cas9系统敲除基因,不能同时编辑多个等位基因,往往只能达到敲低的效果。采用CRISPR/Cas9系统构建CBX2敲除的细胞系克服了以往CBX2小干扰RNA(siRNA)效果差和用慢病毒转染细胞引发的突变及不稳定表达的缺点。该细胞系的构建为CBX2在肺腺癌发生和转移的机制研究奠定了实验基础。
