牦牛血抗氧化肽制备方法对比及分离纯化研究
2018-10-23刘爱平冯朝辉刘韫滔范尹译
杜 昕, 李 诚*, 肖 岚,, 刘爱平, 冯朝辉, 刘韫滔, 杨 勇, 范尹译
(1.四川农业大学 食品学院,四川 雅安 625014;2.四川旅游学院 食品科学系,四川 成都610100)
关键字:牦牛血抗氧化肽;发酵;酶解;纯化
牦牛[Yak],偶蹄目,牛科,牛亚科,牦牛属,生活在海拔3 km以上的缺氧高原,抗寒能力强[1]。我国牦牛资源丰富,饲养量占世界牦牛总数的90%以上,具有明显的数量优势[2]。牦牛血中血红蛋白含量较其他动物血液高,是十分宝贵的蛋白质资源,然而在屠宰加工过程中被直接废弃,既浪费资源又污染环境。近年来,人们发现水解动物屠宰血液得到的多肽具有较好的抗氧化活性[3-5],且小分子肽具有无毒[6]、易吸收[7]、溶解性好等特点[8-9],但关于利用牦牛血制备抗氧化肽的研究迄今为止未见报道。
目前,抗氧化肽的主要制备方法是发酵法和酶解法。酶解法制备抗氧化肽反应条件温和、易于控制,安全性高,酶解反应具有高度的专一性,使抗氧化肽序列具有相似性[10]。嗜热蛋白酶酶解乳白蛋白获得5种抗氧化肽,肽序列末端至少含有一个Tyr或Trp残基。木瓜蛋白酶主要酶解疏水性氨基酸与芳香族氨基酸[11],但酶解法易产生苦味肽[12];发酵法制备抗氧化肽,生产成本低,能有效解决酶解过程中产生苦味肽的问题,提高食物的感官品质和营养价值[13-15],但肽得率较低[16];一些学者为改善单一酶解或发酵的不足,采用菌酶联合方式制备抗氧肽,段旭昌等人[17]采用乳酸菌发酵甲鱼酶解液,使其风味明显改善并增加保健功能。王帅楠等人[18]利用酶解-发酵联用技术提高了猪骨泥鲜味氨基酸含量及抗氧化活性。然而,对于同种底物蛋白而言,尚未将3种不同制备方法进行比较,筛选出最适合该底物蛋白制备抗氧化活性肽的方法。此外,抗氧化肽的分离纯化是生产抗氧化肽的关键步骤之一,如何将具有较高抗氧化活性的抗氧化肽从粗提液中分离出来,对其应用前景有重要意义。
本研究采用经前期研究优化后的枯草芽孢杆菌发酵法,碱性蛋白酶酶解法以及菌酶联合法制备牦牛血抗氧化肽(BF、AP、BA);选取 4种体外抗氧化活性实验(·OH、·O2-清除能力、抑制脂质过氧化能力、还原力)综合评价牦牛血抗氧化肽的抗氧化活性,筛选出牦牛血抗氧化肽的最佳制备方法;采用超滤、凝胶层析法对制备产物进行分离,以期获得活性较高的牦牛血抗氧化肽。
1 材料与方法
1.1 材料与试剂
牦牛血:四川省大渡河食品有限公司;枯草芽孢杆菌SICC1.197:四川省微生物资源平台菌种保藏中心;碱性蛋白酶(酶活力为85.61 U/mg):上海Kayon公司;Sephadex G-25:BIORAD 公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
超滤管 (10 kDa、5 kDa): 德国Sartorius公司;1.6×60 cm层析柱:北京索宝生物科技有限公司;WLB-78C型恒流泵:浙江新昌国康仪器厂;THZ-98AB恒温振荡器:上海一恒科学仪器有限公司;HH-6数显恒温水浴锅,国华电器有限公司;UV-3200紫外分光光度计:MAPADA;ULUP-IV-10T超纯水装置:西安优普仪器设备有限公司;移液枪:Thermo;D37520 高速冷冻离心机:Thermo Fisher。
1.3 实验方法
1.3.1 培养基 活化培养基(g/L):葡萄糖10,蛋白胨 10,牛肉膏 10,氯化钠 5,琼脂 20,pH 7.0。种子培养基(g/L):葡萄糖 10,蛋白胨 10,牛肉膏 10,氯化钠 5,pH 7.0。
1.3.3 碱性蛋白酶酶解牦牛血制备抗氧化肽 底物质量浓度为75 g/mL牦牛血,加入碱性蛋白酶酶解,酶与底物比为 3 000 U/g,调节pH 9.5,60℃酶解 3 h,沸水浴 10 min灭酶,6 000 r/min离心15min,取上清液为抗氧化肽粗提液AP,测定其体外抗氧化活性。
1.3.4 菌酶联合制备牦牛血抗氧化肽 采用菌酶分步联合方式,按照1.3.2节方法进行发酵,发酵结束后经121℃、15 min高压灭菌,冷却后按照1.3.3节方法进行酶解(酶与底物比190 U/g),制备产物6 000 r/min离心15 min,取上清液为抗氧化肽粗提液BA,测定其体外抗氧化活性。
1.3.5 牦牛血抗氧化肽的分离纯化
(1)超滤。抗氧化肽粗提液经0.45 μm滤膜过滤,去除菌体及残渣;采用截留分子量为10 kDa、5 kDa的超滤离心管对膜过滤液进行分离(4 000 r/min,10 min),收集各超滤组分冷冻干燥,测定其对·OH 的 IC50。
(2)凝胶层析。对超滤组分中清除·OH能力最强的组分采用Sephadex G-25进行分离。以超纯水为洗脱液,上样量0.4 mL,洗脱流速0.2 mL/min。每10 min收集1管,收集到的样品在214 nm下测定吸光值绘制出洗脱曲线,收集凝胶层析各峰组分冷冻干燥,测定其对·OH的IC50。
1.3.6 多肽含量的测定 参照陈昌琳等人[19]的方法,取4 mL待测样品加入等体积15 g/L的三氯乙酸(TCA),混合均匀后静置,待大分子蛋白沉淀,6 000 r/min离心15 min,采用Lowry法测定上清液蛋白质含量,计为上清液中多肽含量。
1.3.7 体外抗氧化肽活性的测定
(1)3种制备产物的·OH清除率测定。试管中加入 1 mL 样 品溶 液、1 mL 9 mmol/L FeSO4、1 mL 9 mmol/L水杨酸-乙醇溶液混合,最后加入1 mL 8.8 mmol/L H2O2,37℃水浴30 min后,用紫外-可见分光光度计在510 nm波长下测定其吸光度。空白组用超纯水代替样品溶液。样品·OH清除率计算公式为
术前积极进行各种原发病治疗,采取贫血纠正措施,应用可吸收缝合线有助于降低外源性感染发生率,及时给予高烧不退患者抗感染治疗,待患者病情好转后及时将导尿管和氧气管拔除以便于及早下地锻炼[5] 。
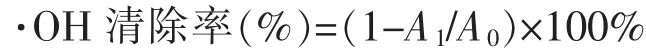
其中,A0为空白组的吸光度;A1为实验组的吸光度。
(2)3种制备产物的还原力的测定。将2 mL样品溶液和2.5 mL 0.2 mol/L磷酸盐缓冲液 (pH 6.6)混合,加入2.5 mL 1 g/L铁氰化钾溶液混合均匀,在50℃水浴20 min。再加入2 mL 15 g/L TCA溶液,混匀,3 000 r/min离心10 min。取2 mL上清液和1 mL蒸馏水混合,再加入0.5 mL的0.1 g/L FeCl3溶液,最后在700 nm下测量吸光度,吸光度越高说明样品的还原能力越强。
(3)3种制备产物的·O2-清除率的测定。取5 mL 50 mmol/L Tris-HCl缓冲液(pH 8.2)与 1 mL 样液,置于25℃水浴预热20 min,分别加入0.2 mL 25 mmol/L邻苯三酚溶液,采取动力学法在325 nm处测定吸光值变化(每30 s测定一次吸光值,共计4 min),对照组以1 mL蒸馏水代替样品测定吸光值变化,以Tris-HCl调零。样品对超氧阴离子的清除率计算为其中,A1为对照组的吸光值变化斜率;A1为实验组的吸光值变化斜率。
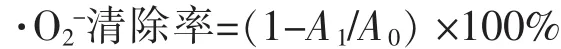
(4)3种制备产物脂质过氧化抑制能力的测定。取200 μL大豆卵磷脂溶液(20 mg卵磷脂,溶于5 mL 0.05 mol/L pH 7.4磷酸盐缓冲液),和1 mL不同浓度的样品溶液混合均匀,加入50 μL 50 mmol/L FeSO4,并以0.1 mmol/L pH 7.4磷酸缓冲液补足至体系总体积为3 mL,37℃水浴40 min,分别加入0.8 mL 15 g/L TCA和1 mL 0.8 g/L TBA,沸水浴15 min后冷却,6 000 r/min离心10 min,取上清液用紫外-可见分光光度计在532 nm波长下测定其吸光度。空白组用磷酸缓冲液代替样品溶液。
脂质过氧化抑制率(%)=(1-A1/A0)×100%
其中,A0为空白组的吸光度;A1为实验组的吸光度。
1.3.8 IC50值的测定 将样品稀释成不同质量浓度(试验点≥5),分别测定其还原力、脂质过氧化抑制率及·OH、·O2-清除率。以样品质量浓度为横坐标,测定值为纵坐标,绘制拟合曲线,从曲线中计算出IC50值。
2 结果与分析
2.1 3种牦牛血抗氧化肽体外抗氧化活性测定结果
2.1.1 还原力 牦牛血抗氧化肽的还原力如图1所示,3种不同方法制备的抗氧化肽均具有还原能力,且吸光值与抗氧化肽浓度呈明显的正相关性。随着牦牛血抗氧化肽质量浓度增加,吸光值增大,还原力越强,但增加速率不同。各质量浓度下,BA的还原力大于BF大于AP;1~4 mg/mL范围内,BF、AP吸光值的增加速率几乎相同;当质量浓度大于4 mg/mL时,BF吸光值的增加速率减小。表1为3种抗氧化肽还原力的吸光值线性回归结果。当A=0.5时,所需3种抗氧化肽质量浓度差异显著(P<0.05)。以上结果表明还原力大小为:BA>BF>AP。

图1 牦牛血抗氧化肽的还原能力Fig.1 Activitiesofreducing power ofYak blood antioxidative peptides

表1 3种抗氧化肽还原力Table 1 Reduing power of three kinds of antioxidant peptides
2.1.2 脂质过氧化抑制能力 图2为3种牦牛血抗氧化肽抑制脂质过氧化能力。脂质过氧化抑制能力与抗氧化肽浓度呈明显的正相关,随着肽质量浓度的增加,3种抗氧化肽脂质过氧化抑制能力都增加;BA与AP的抑制率增加速率差别不大,均大于BF的抑制率增长速率;表2为3种抗氧化肽脂质过氧化抑制能力的线性回归结果。3种抗氧化肽脂质过氧化抑制率的IC50差异显著(P<0.05),由此可知它们脂质过氧化抑制能力大小为:BA>AP>BF。
2.1.3 ·OH清除能力 牦牛血抗氧化肽·OH清除能力如图3所示,3种抗氧化肽均具有清除·OH的活性,且成明显的剂量效应关系。·OH清除率随着抗氧化肽质量浓度的增加而增大,但是增加速率不同。各质量浓度下,BF的·OH清除率均大于BA,AP;1~3 mg/mL浓度范围内,BF的清除率增加速率较大,当质量浓度大于3 mg/mL时,清除率增加速率逐渐减小,此时·OH清除率大于95%;BA的·OH清除率,在低质量浓度时较小,但清除率的增加速率较大,且保持稳定,当质量浓度达到5 mg/mL时,·OH清除率高达90%以上,接近BF的·OH清除率。AP的·OH清除率在1~3 mg/mL范围内极低,当质量浓度大于3 mg/mL时,清除率的增长速率变大。3种抗氧化肽对·OH清除率的IC50如表3所示,差异显著(P<0.05)。以上结果表明,它们对·OH清除能力的大小为:BF>BA>AP。
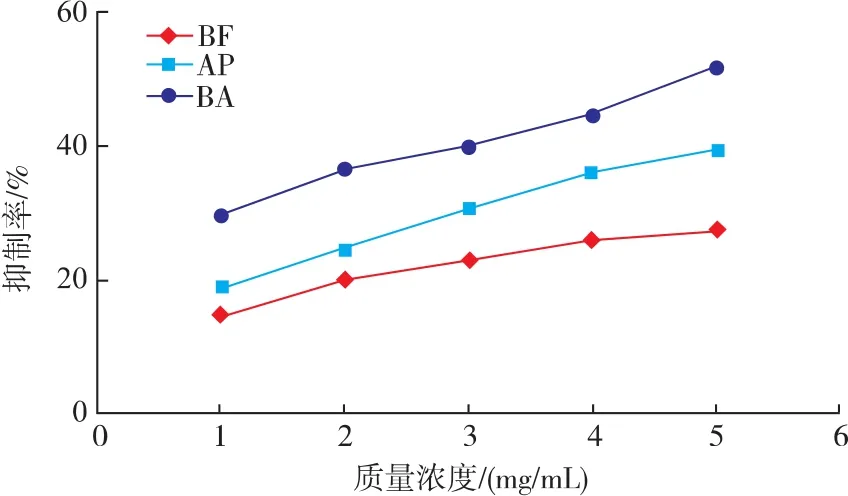
图2 牦牛血抗氧化肽的脂质过氧化抑制能力Fig.2 Activities of lipid peroxidation inhibition of Yak blood antioxidative peptides
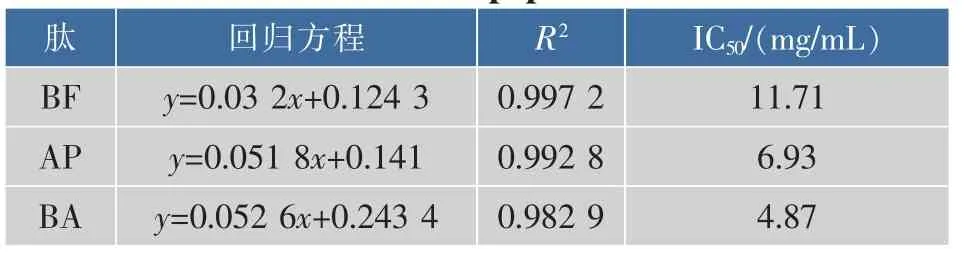
表2 3种抗氧化肽脂质过氧化抑制率的IC50Table 2 Lipid peroxidation inhibition IC50values of three kinds of antioxidant peptides
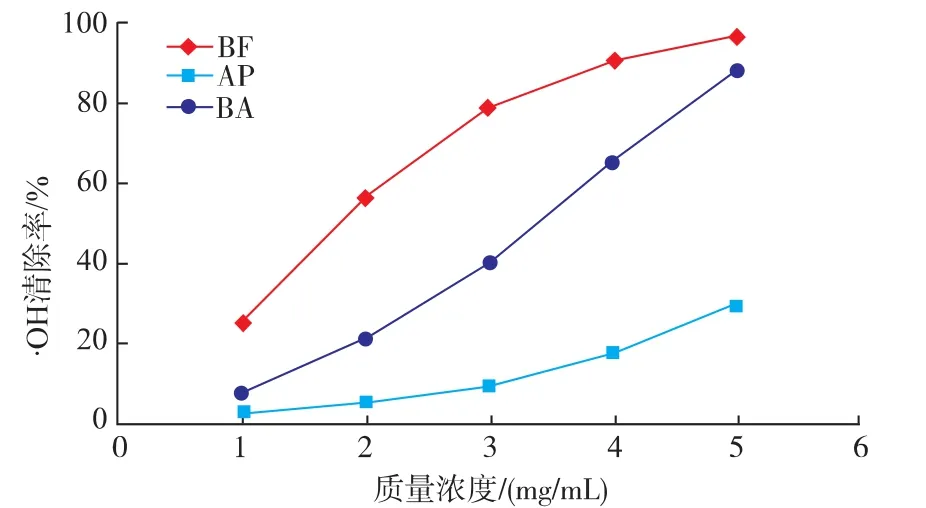
图3 牦牛血抗氧化肽的·OH清除能力Fig.3 Activities of scavenging hydroxyl radical of Yak blood antioxidative peptides

表3 3种抗氧化肽的清除·OH的IC50Table 3 Scavenging hydroxyl radical IC50values of three kinds of antioxidant peptides

图4 牦牛血抗氧化肽的·O2-清除能力Fig.4 Activities of scavenging superoxide anion of Yak blood antioxidative peptides
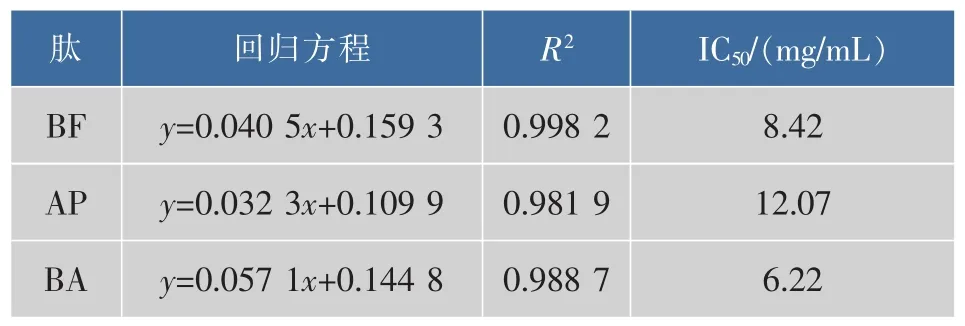
表4 3种抗氧化肽清除·O2-的IC50Table 4 Scavenging superoxide anion IC50values of three kinds of antioxidant peptides
2.2 牦牛血抗氧化肽的分离纯化结果
2.2.1 超滤对牦牛血抗氧化肽的纯化结果 牦牛血抗氧化肽粗提液经10 kD、5 kD超滤离心管超滤分级后,各组分活性测定结果如表5所示。
由表5可知,不同的分子量的肽段都具有清除·OH的能力,分子量大于10 kD的肽段与分子量介于于5~10 kD的肽段对·OH的IC50值差异不明显;分子量小于5 kD的肽段对·OH的IC50值为1.62 mg/mL,说明高活性的牦牛血抗氧化肽分子量集中在5 kD以下,故收集此组分进行凝胶层析。

表5 不同分子量抗氧化肽对·OH的IC50值Table 5 Scavenging hydroxyl radical IC50values of antioxidative peptides in different molecular weight
2.2.2 凝胶层析对牦牛血抗氧化肽的纯化结果对超滤分离所得<5 kD组分进行Sephadex G-25凝胶层析,洗脱曲线如图5所示。
由图5可知,Sephadex G-25能较好地分离牦牛血抗氧化肽得到4个完全分离的峰,组分Ⅰ范围是38~45管,组分Ⅱ是49~57管,组分Ⅲ是58~64管,组分Ⅳ是71~80管。收集并测定各组分抗氧化肽对·OH的IC50值。如图6所示,组分Ⅰ对·OH清除率最高,其IC50值为0.72 mg/mL。而超滤后<5 kD的组分IC50值为1.62 mg/mL,IC50的值下降,说明清除一半·OH活性需要的抗氧化肽质量浓度下降,·OH清除能力提高,抗氧化肽得到进一步纯化。所以,凝胶层析在超滤分级的基础上进一步纯化了抗氧化肽。

图5 凝胶层析色谱图Fig.5 Gel chromatography chromatography
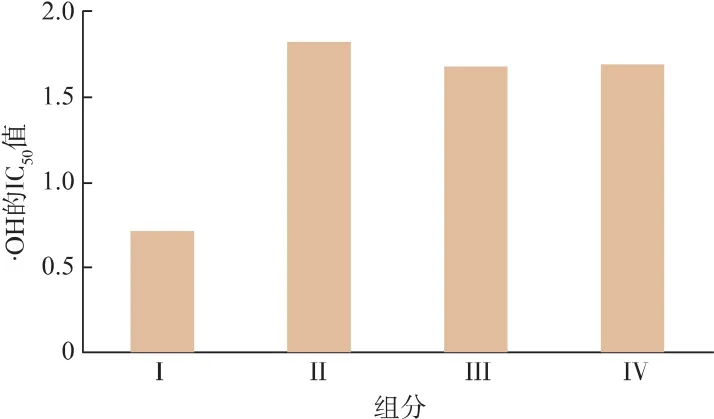
图6 各组分的对·OH的IC50值Fig.6 Scavenging hydroxyl radical IC50values of each component
3 讨论
本实验中酶解法、发酵法以及菌酶联合法都能够制备具有一定抗氧化活性的牦牛血抗氧化肽,与王忠合等人[20]、侯银臣等人[21]研究结果一致,表明制备抗氧化肽方法具有一定相似性。菌酶联合制备法得到的抗氧化肽对·OH、·清除能力、脂质过氧化抑制能力以及还原能力较单一酶解产物分别提高51.2%、48.47%、29.72%、46.86%,较单一发酵产物分别提高-52.08%、26.13%、58.41%、29.72%。与王帅楠等人[18]利用酶解-发酵联用技术提高猪骨的抗氧化功能性结果保持一致:酶解-发酵样品与单一酶解样品相比,对·OH、·清除能力、还原能力分别提高 73.23%、45.32%、164.23%,相比复合酶[22]、超声辅助[23]等方法优化制备抗氧化肽工艺,菌酶联合方式更加显著提高了样品抗氧化活性。然而菌酶联合法制备的牦牛血抗氧化肽对·OH清除能力弱于单一发酵法制得的产物,可能是由于蛋白酶的酶解具有选择性,碱性蛋白酶酶解得到的多肽对羟基自由基的清除作用较弱,但对其他自由基具有较好的清除作用。如姜莉等人[24]采用碱性蛋白酶制备魔芋粉抗氧化肽,清除·OH的IC50为9.03 mg/mL,清除DPPH的IC50为2.82 mg/mL。其次,体外测定抗氧化活性的方法是基于不同抗氧化剂对自由基清除作用、Fe3+还原作用、螯合金属离子能力或是对氧化自由基形成的抑制作用来分析其抗氧化能力的高低,由于抗氧化剂结构差异,往往导致其在不同检测体系中所反映出来的抗氧化能力具有明显差异[25-26],故本实验选取4种体外抗氧化活性测定综合评价抗氧化肽的抗氧化能力。
超滤与凝胶层析法都是根据多肽的分子量大小进行分离纯化。丁顺杰等人[27]超滤得到分子量为200~3 000 kD的缫蚕蛹蛋白抗氧化肽具有较高抗氧化活性。刘旺旺等人[28]超滤得到分子量3~10 kD的羊胎盘多肽抗氧化活性高于分子量<3 kD的多肽。本实验得到分子量小于5 kD的牦牛血抗氧化肽具有最高的抗氧化活性,且经过Sephadex G-25层析后得到4个组分,其中组分Ⅰ抗氧化活性最高,说明抗氧化肽活性与其分子量有一定关系,但并非分子量越小,抗氧化活性越高,抗氧化活性还应与原料蛋白特点及酶切位点等有关[29]。
4 结语
以牦牛血为原料,采用枯草芽孢杆菌发酵牦牛血,碱性蛋白酶酶解牦牛血以及菌酶联合法制备3种牦牛血抗氧化肽。通过考察3种抗氧化肽体外抗氧化活性,菌酶联合法是制备牦牛血抗氧化肽的最佳制备方法,其制备的抗氧化肽清除·O2-能力、脂质过氧化抑制能力以及还原能力最强;菌酶联合制备牦牛血抗氧化肽粗提液经超滤得到不同分子量范围的抗氧化肽,其中分子量<5 kDa的抗氧化肽的·OH清除能力高于分子量>10 kD、介于5~10 kD的抗氧化肽;分子量<5 kD的组分经过Sephadex G-25层析柱后得到4个洗脱峰,其中峰Ⅰ组分的·OH清除能力最强且高于分离前组分活性。
