Dsg4基因在苏博美利奴羊毛囊发育不同时期及不同组织中的表达差异
2018-10-23潘家华徐新明付雪峰田月珍阿布来提苏来曼黄锡霞田可川
朱 桦,潘家华,徐新明,付雪峰,田月珍,阿布来提·苏来曼,黄锡霞*,田可川*
(1.新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2.新疆畜牧科学院畜牧科学研究所,新疆乌鲁木齐 830000)
苏博美利奴羊是以进口澳洲美利奴超细型公羊为父本,以中国美利奴羊、新吉细毛羊和敖汉细毛羊为母本,采用级进杂交方法,经过杂交、横交和纯繁选育3个阶段、历经14年培育出的超细型细毛羊新品种,该品种成年公、母羊肩胛部平均羊毛细度分别可达16.42、17.85 μm[1]。而桥粒是上皮细胞特有的一种细胞连接结构,位于中间连接的深部,角质形成细胞之间借助桥粒相互连接[2]。桥粒芯糖蛋白(Desmoglein,Dsg)属于钙离子依赖型的桥粒钙黏蛋白,它是构成桥粒的重要部分[3]。桥粒芯糖蛋白4(Desmoglein 4,Dsg4)是一个新发现的桥粒钙黏蛋白家族成员,是毛囊角化细胞间黏附的重要介质[4]。Dsg4基因突变会导致局限型常染色体隐性遗传性多毛症(LAH)疾病的发生,其临床症状表现为头皮、躯干和四肢毛发短而稀疏[5-6]。Dsg4基因突变也会导致全身性的先天性毛发营养不良、发干粗细不均的念珠状发(Monilethrix)特征[7]。而且Dsg4基因与辽宁绒山羊的毛色[8]、与绵羊肩胛部毛的长度以及卷曲数相关[9-10]。
目前,国内外关于Dsg4基因在细毛羊毛囊不同发育时期及不同组织的表达差异研究较少。苏博美利奴羊在胎龄65 d初级毛囊开始发生形成毛芽,胎龄85 d次级毛囊开始发生,胎龄105 d时原始次级毛囊大量分化为次级毛囊,胎龄135 d时大多数毛囊基本成熟[11]。因此,本研究采用实时荧光定量PCR检测Dsg4基因在苏博美利奴羊毛囊发育6个时期皮肤组织中的表达,并挑选出毛囊发育的2个关键时期进行不同组织中的差异表达研究,以期进一步揭示细毛羊毛囊发育的生物学过程,为筛选可用于细毛羊毛囊发育相关的候选基因提供理论依据。
1 材料与方法
1.1 实验材料 在新疆科创畜牧繁育中心选取30只2周岁左右健康无病、体况均匀的经产苏博美利奴母羊(羊毛平均纤维直径约17.73 μm),采用同一公羊的精液进行同期受孕,饲养管理条件相同。采集同为公羔的胚胎期 65 d(初级毛囊发生)、85 d(次级毛囊发生)、105 d(次级获得性毛囊发生)、135 d(毛囊成熟)、出生后7 d和出生后30 d的肩胛部皮肤组织,并采集胚胎期 65 d和135 d的心脏、肝脏、脾脏、肺、肾脏、肌肉组织保存于液氮中,不同时期不同组织均为3个生物学重复,用于总RNA的提取实验。
1.2 主要试剂 Trizol、PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR Premix Ex TaqTM购于TaKaRa公司。
1.3 不同组织总RNA提取及cDNA合成 使用Trizol法提取苏博美利奴羊7种不同组织的总RNA。提取的总RNA先利用1%琼脂糖凝胶电泳检测其完整性;另取2 μL总RNA使用核酸检测仪进行浓度测定;最后将提取的总RNA浓度调到400 ng/μL。按照PrimeScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒的说明书进行cDNA第1链合成。
1.4 实时荧光定量PCR检测 根据NCBI中公布的绵羊Dsg4基因序列(登录号:XM_012103430.1)及绵羊GAPDH基因序列(登录号:NM_001190390.1),利用Primer Premier 5.0软件进行引物设计,由上海生工生物工程有限公司合成。引物序列见表1。
以反转录的cDNA作为模板,进行Dsg4基因和GAPDH基因的 PCR 扩增:2×Taq PCR Master Mix 10 μL,上、下游引物各 0.5 μL,cDNA 1 μL,dH2O 8 μL(总体系为 20 μL),扩增程序为95℃ 3 min,94℃ 30 s,61℃ 45 s,35个 循 环,72℃ 5 min。 随 机 挑 选 4个PCR 产物取 3 μL 与2 μL 6×Loading Buffer混匀,用2%琼脂糖凝胶电泳检测,180 V,20 min;后使用凝胶成像系统采集图像,若获得的产物片段大小与预期一致则进行下一步实验。
以反转录的cDNA作为模板,进行Dsg4基因和Gapdh基因的实时荧光定量PCR扩增:SYBR Premix Ex Taq 12.5 μL,上、下游引物各 0.5 μL,cDNA 1 μL,dH2O 10.5 μL(总体系为25 μL),扩增程序为95℃ 30 s,95℃ 5 s,61℃ 30 s,40 个循环,65℃ 5 s,95℃ 5 s。每个样品做3个重复。
1.5 统计分析 获得的Ct值最终以2-△△Ct方法目的基因表达量的计算,ΔCt=Ct目的-Ct内参,ΔΔCt=ΔCt目的组-ΔCt对照组,并用SPSS 19.0软件单因素方差分析中的Duncan´s多重比较对表达量结果进行差异比较。
2 结 果
2.1 不同组织的总RNA检测 提取的总RNA随机抽选4个样品,利用1%琼脂糖凝胶电泳进行其完整性的检测。从图1可明显看出,28S是18S条带亮度的2倍,5S条带不明显,说明提取的总RNA完整性好且无降解;利用核酸检测仪进行总RNA的浓度测定,所有样品浓度均在 350 ng/μL 以上,且 OD260/OD280在 1.8~2.0,表明提取的总RNA浓度高且无蛋白质、DNA等污染,符合后期反转录的要求,可用于后续的反转录实验。

图1 总RNA检测结果
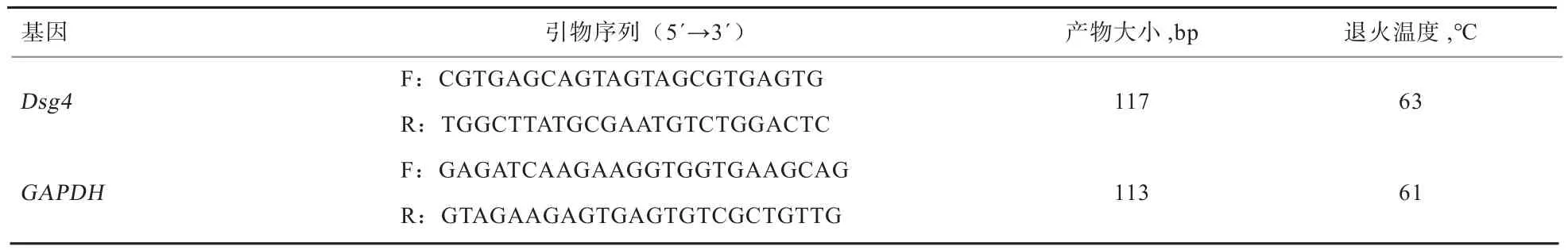
表1 引物信息
2.2 PCR产物检测结果 Dsg4基因和GAPDH基因的PCR扩增产物经2%琼脂糖凝胶电泳检测,可见在117 bp和113 bp处有明显的条带(图2),与预期产物大小一致,表明扩增体系合理,反转录的cDNA可用于后续的定量实验。
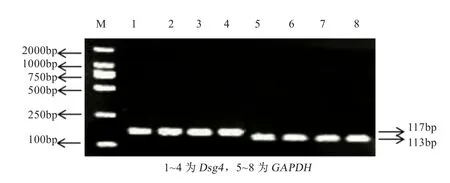
图2 PCR产物检测图
实时荧光定量PCR结果分析(图3),Dsg4基因和GAPDH基因有且只有1个峰,Dsg4基因熔解温度为82.7℃,GAPDH基因熔解温度为84.2℃,熔解温度均一,且扩增曲线指数良好,说明引物设计特异性强,结果真实可靠。

图3 Dsg4和Gapdh的扩增曲线及熔解曲线
2.3 Dsg4在胚胎期65 d各组织中的表达 Dsg4基因在胚胎期65 d不同组织中的表达结果中,肝脏的ΔCt值最小,因此将肝脏作为对照组进行表达量的计算。从图4可以看出,Dsg4基因在肝脏组织中的表达量分别是心脏、脾脏、肺、肾脏、肌肉和皮肤组织中的4.55、12.50、10.00、1.85、11.11和 5.26倍(P<0.01);Dsg4基因在肾脏中的表达量极显著高于脾脏、肺和肌肉的表达量(P<0.01),且显著高于心脏和皮肤的表达量(P<0.05);但Dsg4基因在心脏、脾脏、肺、肌肉和皮肤之间的表达量差异不显著(P>0.05)。
2.4 Dsg4在胚胎期135 d各组织中的表达 Dsg4基因在胚胎期135 d不同组织中的表达结果中皮肤的ΔCt值最小,因此将皮肤作为对照组进行表达量的计算。从图5可以看出,Dsg4基因在皮肤组织中的表达量分别是心脏、肝脏、脾脏、肺、肾脏和肌肉组织中的4.35、5.00、4.35、6.67、16.67和 12.50倍(P<0.01), 且Dsg4基因在心脏、肝脏、脾脏、肺、肾脏和肌肉6个组织间的表达量差异不显著(P>0.05)。
2.5 Dsg4在毛囊发育6个时期皮肤组织中的表达 以胚胎期65 d作为对照组进行毛囊不同发育时期Dsg4基因表达量的计算。从图6可以看出,Dsg4基因的表达量随着毛囊发育的成熟呈逐步上升的趋势,在出生后30 d表达量极显著高于胚胎期65、85 、105 、135 d的表达量(P<0.01);在出生后7 d 的表达量极显著高于胚胎期 65 、85 、105 d 的表达量(P<0.01)。

图4 Dsg4在苏博美利奴羊胚胎期65 d不同组织中的表达量

图5 Dsg4在苏博美利奴羊胚胎期135 d不同组织中的表达量
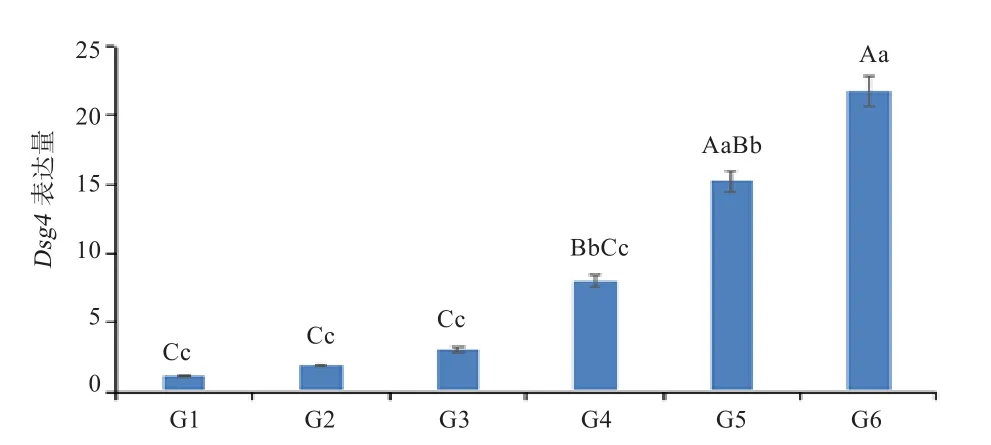
图6 Dsg4在苏博美利奴羊毛囊发育不同时期皮肤组织中的表达量
3 讨 论
中国美利奴羊(甘肃型)在胚胎期84 d时开始出现初级毛囊,胚胎期87 d时开始出现次级毛囊,胚胎期102 d和108 d时在原始次级毛囊开始分化,胚胎期138 d时大部分毛囊发育成熟[12]。本研究利用苏博美利奴羊胚胎期65、85、105、135 d和出生后7、30 d的皮肤组织,以及胚胎期65 d和135 d的不同内脏组织进行Dsg4基因毛囊不同发育时期表达量的研究分析。
本研究采用的荧光定量方法为荧光染料法。荧光染料法主要是利用荧光染料与DNA双链结合,之后检测相结合的荧光强度的一种方法[13]。采用相对定量是在进行目的基因测定的同时还要进行某个内参基因的测定[14]。不同的研究条件需要选择相对应的内参基因,常用的内参基因有GAPDH、β-actin、18S rRNA等[15-16]。本研究中采用GAPDH作为内参基因进行荧光定量PCR实验,该内参基因在不同组织中的表达量一直处于稳定状态,该基因在重复实验间Ct值相近,这与田月珍等[17]研究中国美利奴羊(新疆型)皮肤组织GAPDH基因的实时荧光定量PCR结果一致。
Smad4基因缺失会导致脱发[18],Smad4缺失会导致Dsg4基因的下调,最终会使毛囊发生变性[19];Hoxc13功能缺失亦会导致Dsg4基因的下调,导致无毛症的发生[20];但Dsg4基因突变不仅会导致出现毛发稀少的表型[21],也会造成披针形毛发的表型出现[22],不会引起其他病理症状。这些研究均表明Dsg4基因对毛囊有着十分重要的作用。Bazzi等[23]研究表明,Dsg4基因高度表达在毛发角蛋白的毛干皮层中,这与本研究的Dsg4基因在苏博美利奴羊毛囊发育成熟时期皮肤组织中表达最高的结果一致。Gao等[24]比较绒山羊胎儿皮肤转录组的毛囊形态发生相关关键基因结果分析,表明Dsg4基因从绒山羊胚胎期60 d到胚胎期120 d再到出生后2 h皮肤组织中的表达量逐步上调,这与本研究的Dsg4基因随着毛囊发育逐步的成熟,从胚胎期65 d到出生后30 d表达量上调的结果一致。本研究表明,随着苏博美利奴羊毛囊发育的逐步成熟,Dsg4基因的表达量也随之逐步上调,表明Dsg4基因可能对于毛囊的成熟呈正向的调节作用,为今后研究超细毛羊的毛囊发育提供了重要依据。
4 结 论
Dsg4基因在苏博美利奴羊胚胎期65 d肝脏中表达量极显著高于其他组织,而到胚胎期135 d时皮肤组织中表达量极显著高于其他组织,并且随着毛囊发育的逐步成熟,Dsg4基因在皮肤中的表达量也逐步上调,这表明Dsg4基因可能与毛囊成熟的生理过程密切相关,可为今后进一步研究苏博美利奴羊毛囊发育提供理论依据。
