TACE联合放射性125I粒子植入治疗不宜消融肝癌的安全性及有效性分析
2018-10-23吕维富成德雷周春泽张行明张正峰肖景坤
朱 楠,鲁 东,吕维富*,成德雷,周春泽,张行明,张正峰,肖景坤
(1.安徽省五河县人民医院影像科,安徽 蚌埠 233300;2.中国科学技术大学附属第一医院 安徽省立医院介入放射科,安徽 合肥 230001)
原发性肝癌发生率及死亡率逐年升高[1],患者就诊时多已不能手术切除[2]。TACE是治疗中晚期肝癌的有效手段[3]。射频及无水乙醇消融术可作为TACE治疗的重要补充,但部分肿瘤因乏血供或血供复杂而不利于乙醇弥散,或病灶位于肝表面、膈顶或邻近胆囊等位置,不宜采用无水乙醇消融术和射频消融术[4]。125I粒子植入术是上述不宜消融肝癌介入治疗的重要补充。本研究采用TACE联合125I粒子植入术治疗上述不宜消融肝癌,评价其安全性及有效性。
1 资料与方法
1.1 一般资料 回顾性分析2010年1月—2015年1月序贯收治的82例不宜消融肝癌患者。纳入标准:①符合原发性肝癌诊疗规范(2017版)临床诊断标准[5]或经肝穿刺活检确诊;②无法手术或拒绝手术;③肝功能Child-Pugh A或B级;④无化疗、放疗禁忌证;⑤无明显心、肾、肺等脏器功能损伤。排除标准:①肿瘤体积>70%肝脏或直径>10 cm;②门静脉主干癌栓;③伴严重黄疸、远处转移等;④肝功能Child-Pugh C级;⑤凝血功能障碍。其中联合组40例,接受TACE联合125I粒子植入治疗;对照组42例,仅接受单纯TACE治疗。2组患者术前一般情况差异无统计学意义,见表1。
1.2 仪器与方法
1.2.1 TACE 以Seldinger法穿刺右侧股动脉,将RH导管置于腹腔动脉-肝总动脉。采用高压注射器注入碘海醇(300 mgI/ml)进行造影,流率4 ml/s,总量16 ml,4帧/秒。根据有无门静脉癌栓或动-静脉瘘,行超选择肿瘤供血血管栓塞治疗;如数次TACE后肿瘤染色存在缺损,则于T12水平注入对比剂 (10 ml/s)30 ml行腹主动脉造影,发现异位血供则行超选择化疗栓塞。栓塞剂为吡柔比星30 mg、奥沙利铂 150 mg与碘化油混合剂5~20 ml。
1.2.2125I粒子植入术 TACE后2~4周复查上腹部增强CT,通过治疗计划系统(treatment planning system, TPS)计算相关参数,如粒子数目、剂量、植入路径等。间距1.0~1.5 cm,植入活度为0.5~0.8 mCi的125I粒子,半衰期59.4天,组织间照射距离17 mm,设定靶区剂量(prescribed dose, PD)为120~160 Gy,90%靶体积接受的剂量(D90)>90%PD。局部麻醉后,于CT引导下采用18G引导针穿刺入肝,待针头接近目标病灶最远端约1.0~1.5 cm处时植入粒子,按照外周密、中间疏的原则自远而近依次植入。术后1周内验证TPS计划,及时补种“冷区”。记录术前计划和术后实际D90、100%靶体积接受的剂量(D100)及90%、100%处方剂量覆盖靶体积的百分比(V90、V100)。
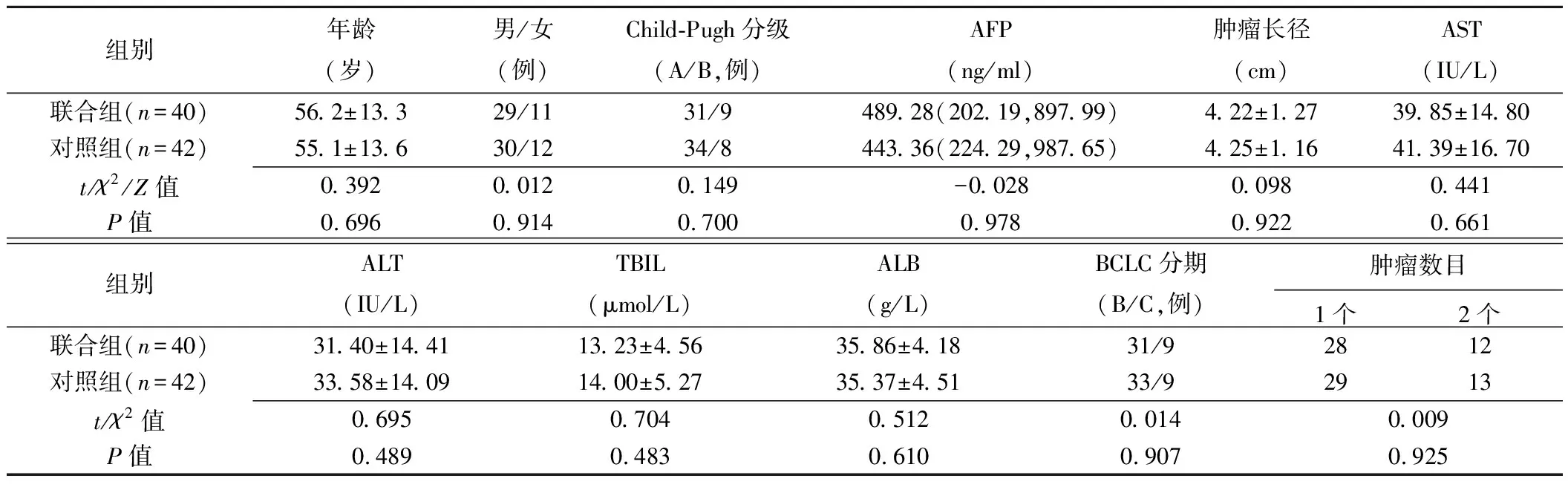
表1 2组患者术前一般情况比较

图1 患者男,45岁,肝癌病灶位于肝表面 A.碘油沉积不佳(箭); B.植入路径; C.术后6个月复查,病灶缩小无强化(箭) 图2 患者女,53岁,肝癌病灶位于右叶边缘 A.肿瘤乏血供(箭); B.碘油沉积不佳(箭); C.术后3个月复查,病灶缩小无强化(箭)
1.3 术后随访 术后第1、3、6个月复查增强CT、MRI及肝功能、血常规、甲胎蛋白(alpha-fetoprotein, AFP)等。随访终止时间为患者死亡或2017年12月1日。
1.4 评价指标 ①粒子植入前后剂量学变化(D90、D100、V90、V100);②采用改良实体瘤疗效评价标准(modified response evaluation criteria in solid tumors, mRECIST)评估局部疗效[6],完全缓解(complete response, CR)为所有靶病灶增强检查动脉期均不显影;部分缓解(partial response, PR)为靶病灶动脉期强化直径总和缩小≥30%;疾病进展(progressive disease, PD)为靶病灶动脉期强化直径总和增加≥20%或出现新病灶;疾病稳定(stable disease, SD)为靶病灶增强显影变化介于PR与PD之间;计算客观有效率,即(CR+PR)/总例数×100%;③评估2组术前和术后1个月肝功能、血常规及术前和术后1、3、6个月AFP水平及术后并发症。
1.5 统计学分析 采用SPSS 22.0统计分析软件,对数据行正态性检验;符合正态分布的资料采用±s表示,不符合正态分布的资料采用中位数(上下四分位数)表示;AFP水平总体比较采用Friedman法,两两比较采用秩和检验,以χ2检验分析计数资料;计量资料的比较采用t检验(两组间比较采用独立样本t检验,治疗前后比较采用配对t检验)或秩和检验。采用Kaplan-Meier法进行生存分析,并通过Log-Rank检验比较两组生存率的差异。P<0.05为差异有统计学意义。
2 结果
2.1 TACE及粒子植入情况 联合组与对照组TACE治疗次数差异无统计学意义[3(2,4)次 vs 3(2,5)次,P>0.05]。联合组肿瘤靶区接受的平均照射剂量为(202.43±28.81)Gy,放射性粒子首次植入成功率97.5%(39/40);1例补种粒子1次,补种后V90、V100均>90%,术前、术后剂量学(D90、D100、V90、V100)差异无统计学意义,见表2,图1、2。
表2 联合组治疗前后TPS剂量学比较(±s)

表2 联合组治疗前后TPS剂量学比较(±s)
时间D90(Gy)D100(Gy)V100(%)V90(%)治疗前135.53±16.9175.79±6.0495.81±1.9398.22±0.89治疗后137.78±14.6877.35±4.6095.29±2.1897.84±2.17t值0.6301.3081.5861.155P值0.5320.1980.1210.255
2.2 局部疗效 联合组客观有效率分别为85.00%(34/40)、67.50%(27/40),对照组分别为61.90%(26/42)、45.24%(19/42);联合组明显高于对照组(χ2=5.567、4.123,P=0.018、0.042),见表3。
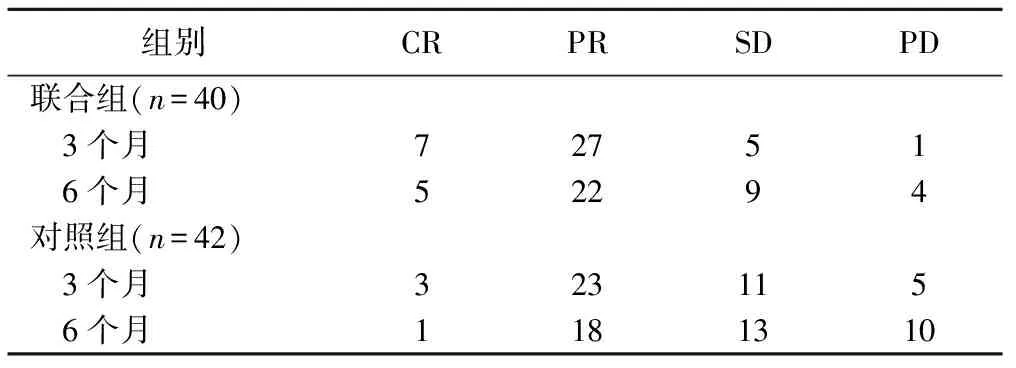
表3 2组术后局部疗效(例)
2.3 生存分析 随访(19.4±12.3)个月,联合组中位生存时间为25.7个月,1、2、3年累积生存率分别为77.50%、54.30%、23.30%;对照组中位生存时间为10.7个月,1、2、3年累积生存率分别为45.20%、32.60%、13.60%。联合组生存时间明显高于对照组(χ2=4.797,P=0.029)。生存函数曲线见图3。

图3 2组患者生存曲线
2.4 AFP水平 联合组、对照组术后1个月[360.54(97.79,470.95) ng/ml、475.05(163.90,716.69) ng/ml]、3个月[144.64(80.42,818.92) ng/ml、231.38(113.07,431.56) ng/ml]、6个月[71.90(23.71,119.22) ng/ml、222.27(109.65,308.54) ng/ml]AFP水平均较术前[489.28(202.19,897.99) ng/ml、443.36(224.29,987.65) ng/ml]降低,2组组内随时间变化总体差异均有统计学意义(P=0.001、0.003)。联合组术后1个月与3个月、1个月与6个月、3个月与6个月间AFP差异均有统计学意义(Z=-2.712、-2.934、-2.263,P=0.008、0.003、0.025);对照组术后1个月与3个月、1个月与6个月间AFP差异均有统计学意义(Z=-2.115、-2.221、P=0.034、0.026),3个月与6个月间AFP差异无统计学意义(Z=-0.564,P=0.573)。
2组间术后1个月AFP水平差异无统计学意义(Z=-1.651,P=0.099);术后3个月及6个月,联合组AFP水平均明显低于对照组(Z=-2.533,P=0.011;Z=-4.369,P<0.001)。
2.5 肝功能、血常规及术后并发症 2组术前、术后1个月肝功能及血常规检查指标差异均无统计学意义(P均>0.05),见表4。联合组及对照组术后分别11例、10例出现发热(体温≤38.5℃);联合组7例出现肝区疼痛,3例出现肝包膜下少量出血,对症处理后好转。2组均未发生穿刺针道转移、气胸及周围脏器损伤等严重并发症。
3 讨论
TACE疗效与肿瘤血供密切相关[7];射频及无水乙醇消融术疗效亦因病灶位置及血供情况而异。植入放射性125I粒子属于内照射治疗,通过粒子衰变释放γ射线产生治疗作用[8],具有高度适形性,不依赖肿瘤血供,已广泛用于治疗肝癌[9]。
本研究联合组术后3个月局部有效率高于对照组,提示联合治疗3个月即可有效控制病灶局部进展;但6个月时有效率下降,可能是因为碘粒子的半衰期为59.4天,前3个月释放50%以上的剂量,有效控制率随时间推移而下降。
表4 2组术前和术后肝功能及血常规检查指标比较(±s)

表4 2组术前和术后肝功能及血常规检查指标比较(±s)
组别AST(IU/L)ALT(IU/L)TBIL(μmol/L)ALB(g/L)PLT(×109/L)WBC(×109/L)RBC(×1012/L)联合组 术前39.85±14.8031.40±14.4113.23±4.5635.86±4.18144.05±46.205.09±1.133.92±0.43 术后1个月41.40±12.2333.02±12.4314.28±4.2036.35±3.46142.13±42.424.90±1.243.89±0.46 t值0.4950.5781.0610.6560.1730.7580.319 P值0.6230.5670.2950.5160.8640.4530.752对照组 术前41.39±16.7033.58±14.0914.00±5.2735.37±4.51154.43±45.355.04±0.9641.39±16.70 术后1个月42.69±12.6832.70±13.8414.49±5.1036.46±2.98144.85±39.434.85±1.3442.69±12.68 t值-0.4840.303-0.427-1.6181.063-0.713-0.484 P值0.6310.7630.6710.1130.2940.4800.631
本研究联合组累积生存率明显高于对照组,与既往研究[10-11]结果相似。分析原因:①TACE后残余肿瘤迅速进入分裂期,对放射线更敏感,且125I粒子照射可使肝癌细胞处于对化疗敏感的G2-M期[12];②TACE后肿瘤缩小,可减少植入粒子数量并提高有效照射,且内放射治疗可减少化疗栓塞药物用量及TACE次数;③TACE后血管内皮生长因子高表达,刺激肿瘤血管生长,125I粒子可抑制肿瘤血管生成。但联合组患者15个月后生存曲线陡降,考虑除肿瘤进展外,亦由于125I粒子为局部内照射,有效控制率随时间推移而下降,使远期生存率亦逐渐下降。
AFP是评价肝癌患者预后的重要指标[13]。本研究2组术后AFP水平均较术前降低,但术后1个月2组间无明显差异,可能因125I粒子为低剂量照射,作用较温和;术后3、6个月,联合组AFP水平明显低于对照组,提示随时间推移,联合治疗可更有效控制AFP水平。
目前内放射治疗肝癌的剂量尚无统一标准。中国人正常肝组织耐受剂量为23 Gy[14],而外放射治疗肝癌的有效剂量需达60 Gy以上。125I粒子植入靶区累积剂量可达140 Gy,而周围剂量陡降[15]。本研究联合组125I粒子植入后V90、V100均>90%,术前、术后1个月肝功能及血常规变化差异均无统计学意义,提示联合治疗未加重肝功能损害,且无严重骨髓抑制[15]。治疗过程中所有患者均未发生严重并发症,与TACE后碘油沉积使粒子植入更准确、有利于降低误穿率,以及125I植入采用18G穿刺针,较射频穿刺针更细,减少了穿刺脉管所致大出血或胆漏风险有关。
本研究的不足:①为回顾性研究,且样本量较少;②关于125I粒子是否可用于治疗直径>10 cm巨块型肝癌、患者安全性及愈后是否获益尚无统一共识,有待更深入研究。