奶牛乳房炎主要致病菌耐药性研究进展
2018-10-22邢萌茹刘慧敏孟璐董蕾郑楠韩荣伟王加启
邢萌茹,刘慧敏,孟璐,董蕾,郑楠,韩荣伟,王加启
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.青岛农业大学食品科学与工程学院,青岛 266109;3.中国农业科学院北京畜牧兽医研究所,农业部奶产品质量安全风险评估实验室(北京),北京 100193)
0 引 言
奶牛乳房炎是奶牛养殖过程中最普遍和最重要的疾病之一[1]。奶牛乳房炎主要是由多种病原菌所引起的,一般情况下奶牛乳房炎最高发病率在第五次哺乳期左右,约为26%,是危害奶牛生产的一种多发病[2]。全世界约有1/3的奶牛患有乳房炎,是造成牛奶产量、质量降低以及奶牛死亡和淘汰率增加的重要原因,会造成牛场严重的经济损失[3]。美国每年每头奶牛约需花费182美元用于治疗乳房炎,每年约损失20亿美元[3]。澳大利亚乳品行业每年因乳房炎影响乳品质量而产生的损失超过1.3亿美元[4]。
目前,国内外多使用抗生素药物对奶牛乳房炎进行治疗,牛场用药不规范极易导致抗生素的乱用和滥用,从而导致不同程度的致病菌耐药及抗生素药物残留。长期不规范使用抗生素治疗乳房炎可能会导致抗生素耐药菌株的出现,对奶牛乳房炎疾病的治疗带来影响,耐药菌株也有一定几率进入人类的食物链当中对人体健康造成危害[5-7]。本文对奶牛乳房炎的危害、主要致病菌的耐药现状及耐药机制、耐药性检测方法以及抗生素耐药性的防治措施等方面进行综述,旨在为奶牛乳房炎的治疗和新型抗生素的开发提供参考。
1 奶牛乳房炎的分类及危害
1.1 分类
奶牛乳房炎是乳房在受到物理、化学因素等致病因子的刺激、多种微生物感染以及机械性损伤而导致奶牛乳房及乳头出现炎症变化,产生红肿、热痛等现象的一种疾病(见图1[8])。根据奶牛乳房和乳汁的变化情况,美国乳房炎联合会(National Mastitis Council,NMC)将乳房炎分为临床乳房炎和亚临床乳房炎,临床乳房炎可以看见明显的乳房和乳汁变化,包括乳房红肿、乳汁稀薄发黄有絮状物产生等现象;亚临床乳房炎也称隐性乳房炎,不表现临床症状,可通过体细胞计数(Somatic Cell Count,SCC)、乳汁电导率检测(Electrical Conductivity,EC)或加州乳房炎试验(California Mastitis Test,CMT)等来诊断。此外根据其病原菌的来源分为传染性乳房炎和环境性乳房炎,微生物是导致牛乳房炎的主要原因,对奶牛来说,很多导致乳房炎产生的病原体都是常见的,通常会出现在奶牛乳头或者饲养环境中,从乳头管进入并移动到乳房。
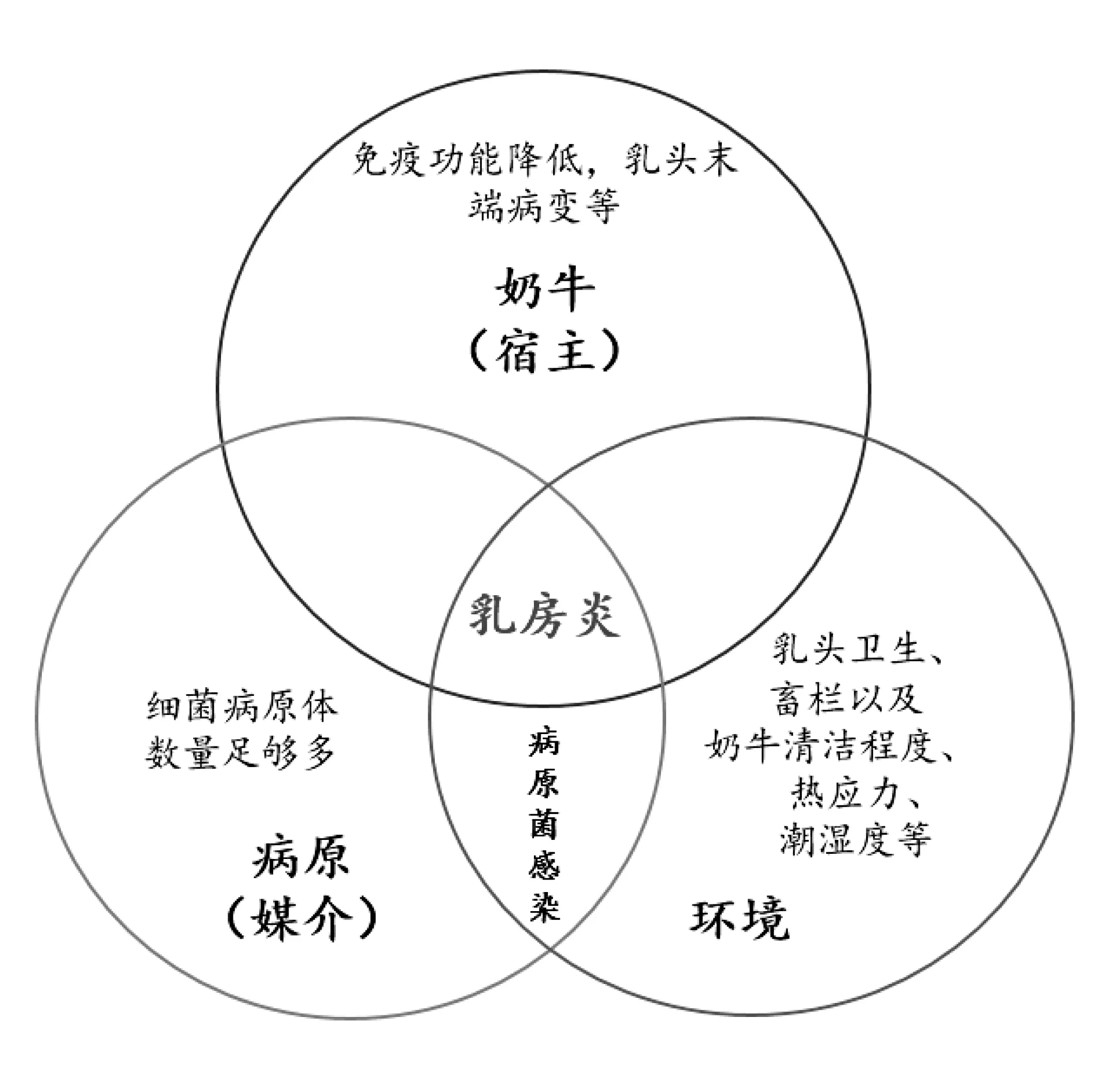
图1 牛乳房炎发病因素[8]
1.2 危害
奶牛患乳房炎后会引起牛场的成本增加,主要是病牛的治疗、牛奶品质降低、奶牛提前淘汰等[9]。临床乳房炎能够被饲养人员观察到产奶减少、牛奶质量下降等明显变化,可以尽早进行治疗避免产生更严重的损失。而隐性乳房炎因无明显临床反应,不易被察觉,因此不能及时治疗,是造成经济损失的主要原因[10]。无论是临床乳房炎或隐性乳房炎均会造成乳房损伤,使得这些奶牛面临淘汰或死亡的风险。波兰有36.7%的奶牛因金黄色葡萄球菌和真菌感染而患有隐性乳房炎面临淘汰[11],在我国也有报道称50%以上的奶牛患有乳房炎[12-13]。微生物感染引发的牛乳房炎会导致牛奶中的致病菌数量增加,可能直接或间接传染给人类,引起食物中毒现象,对消费者安全也造成极大影响。
2 牛乳房炎主要致病菌及耐药状况
2.1 主要致病菌
病原菌的感染是引起牛乳房炎的主要原因。总共有100多种微生物可引起乳房炎,这些微生物可分为常见病原体(包括主要病原体和次要病原体)以及非常见病原体,常见病原菌约有20多种[14]。如表1所示,主要病原体中包括归属为传染性病原菌的金黄色葡萄球菌(Staphylococcus aureus)、无乳链球菌(Streptococcus agalactiae)和支原菌(Mycoplasma spp.)(大部分为牛支原体(Mycoplasma bovis)),以及归属为环境性病原菌的大肠菌群(包括大肠杆菌(Escherichia coli)和克雷伯菌属(Klebsiella spp.))、乳房链球菌(Streptococcus uberis)和停乳链球菌(Streptococcus dysgalactiae),化脓隐秘杆菌(Arcanobacterium pyogenes)、凝固酶阴性葡萄球菌(Coagulase negative staphylococcus)和牛棒杆菌(Corynebacterium bovis)等是次要病原体,此外酵母菌(Yeast)、真菌、肠球菌属(Enterococcus spp.)、芽孢杆菌属(Bacillus cohn)、沙雷氏菌属(Serratia spp.)和原壁菌属(Prototheca)等为非常见病原体[15-18]。有报道提出,次要病原菌如牛棒杆菌或凝固酶阴性葡萄球菌引起的奶牛乳房炎感染可以帮助抵抗主要病原菌导致的乳房炎的发生[18]。

表1 牛乳房炎主要病原菌
据报道,付静涛等[15]对北京某郊区奶牛场的隐性乳房炎奶样主要病原菌进行分离鉴定,结果显示传染性病原菌以金黄色葡萄球菌(规模牛场、小区和散养户分别为9.98%、15.99%和11.96%)为主,环境性病原菌以停乳链球菌(小区高达10.41%)、沙雷氏菌(小区高达31.51%)和大肠杆菌为主。Bi等[16]检测了894份中国不同地区的乳房炎样品,其中检出传染性病原菌分别包括50.1%、92.2%和72.3%中的金黄色葡萄球菌、无乳链球菌和停乳链球菌,检出环境病原菌包括28.6%、8.9,%、35.7%、20.0%、1.3%、17.0%和67.2%的大肠杆菌、乳房链球菌、肠球菌属、克雷伯氏菌属、粘质沙雷氏菌、牛棒状杆菌和化脓杆菌,并且内蒙古、黑龙江和河北不同地区的奶样之间的病原菌检出存在明显差异;此外Bouari等[18]收集了罗马尼亚204份乳房炎奶样,其中检出葡萄球菌54.9%、链球菌属20.1%、大肠杆菌10.78%、克雷伯氏菌属8.34%、芽孢杆菌属5.88%,此外在62.7%的样本中,最常见的关联是由葡萄球菌-链球菌代表。综上可知,目前国内外乳房炎奶样中流行率较高的是金黄色葡萄球菌、大肠杆菌、链球菌属等。
2.2 国内外牛乳房炎主要致病菌耐药现状
奶牛乳房炎的治疗主要使用抗生素,而在不明确病原菌及其耐药史的情况下滥用或不合理使用抗生素,极易产生耐药菌株,严重影响治疗效果。
2.2.1 金黄色葡萄球菌耐药现状
金黄色葡萄球菌属于葡萄球菌属,是导致奶牛临床乳房炎最主要的细菌之一。治疗过程中抗生素的使用很容易使其产生耐药性甚至形成多重耐药,且抗生素耐药性一旦形成则很难根除。Zhang等[40]在2016年的报告中分析了江苏省200例乳房炎奶样,分离出58株(分离率29.0%)金黄色葡萄球菌,其中有11株是耐甲氧西林金黄色葡萄球菌(Methicillin Resistant Staphylococcus aureus,MRSA),耐药结果显示氨苄青霉素和青霉素的耐药率最高(91.4%),其次是环丙沙星(53.4%),对头孢噻吩和万古霉素全敏感,有55株金葡菌分离株(94.8%)对至少一种抗生素具有耐药性,约22.4%(n=13)的分离株对5种以上抗生素具有耐药性。
Aslanta等[41]检测了从土耳其南部330头患有亚临床乳房炎的奶牛中采集的牛奶样本,分离出了112株金黄色葡萄球菌,在其中发现5株耐甲氧西林金黄色葡萄球菌,检出率为4.5%;青霉素耐药率为45.5%,氨苄青霉素39.3%,恩氟沙星和阿莫西林-克拉维酸的耐药率最低(0.9%),对万古霉素和庆大霉素全部敏感。Martini等[42]分析了巴西米纳斯吉拉斯州的6个市中分离得到的90株乳房炎源金黄色葡萄球菌,其中69株(76.7%)耐氨苄青霉素,75株(83.3%)耐青霉素,64株(71.1%)耐四环素。
2.2.2 大肠杆菌耐药现状
大肠杆菌也是全世界牛乳房炎的主要致病因素之一,通常与急性临床乳腺炎有关,感染周期较短,通常为1~2天,会造成严重损失。Pehlivanoglu等[43]从土耳其地中海沿岸的安塔利亚市的750个乳房炎奶样中分离出的三株大肠杆菌,对氨基糖苷类(包括庆大霉素,卡那霉素和链霉素),喹诺酮类(包括环丙沙星,恩氟沙星,和萘啶酸),氯霉素,四环素和5种β-内酰胺类(包括氨苄青霉素,头孢喹啶,头孢噻呋,头孢呋辛和头孢噻吩)均耐药,对头孢西丁、氟苯尼考和亚胺培南敏感。Hinthong等[44]从泰国萨拉布里省采集了38份乳房炎奶样,分离出26株大肠杆菌,其对头孢类耐药率为18.2%,氨基糖苷类耐药率为18.2%,β-内酰胺酶抑制剂组合耐药率为5.2%,氟喹诺酮耐药率为14.3%以及碳青霉烯类为1.3%,84.6%(22/26)的菌株表现出多重耐药性。武军元等人[45]对新疆阿克苏地区的85份疑似患乳房炎病牛的奶样中大肠杆菌进行了分析,结果显示对氨苄西林的耐药率最高(50.0%),对多西环素、四环素和链霉素的耐药率次之(40.0%),对环丙沙星、氧氟沙星和氟苯尼考的耐药率最低(15.0%)。
2.2.3 链球菌属耐药现状
在引起牛乳房炎的所有微生物中,链球菌属是与乳腺内感染(Intramammary Infection,IMI)相关的较大微生物群体,并且与临床和亚临床乳房炎相关[46]。链球菌属主要包括无乳链球菌、乳房链球菌和停乳链球菌,它们都是导致奶牛乳房炎的主要病原菌。Vélez等[47]通过全基因组测序(Whole-Genome Sequencing,WGS)研究了加拿大样品中分离出的66株乳房链球菌的耐药性,结果显示在两株分离株中都发现了11种抗生素耐药基因。Boonyayatra等人[48]分析了56株来自泰国清迈的亚临床乳腺炎和临床乳腺炎奶样无乳链球菌分离株,检测了其对氨苄青霉素、氯沙西林、头孢氨苄、庆大霉素和四环素的耐药性,并提出耐药机制假设(1)通过生物膜降低抗生素的渗透;(2)降低生物膜细胞的生长速度,减少抗生素的影响;(3)产生“持续”生物膜细胞遗传突变为高耐药性。相较国外而言,国内关于链球菌导致牛乳房炎的报道较少。杜琳等[49]检测了内蒙古不同地区的298份隐性乳房炎病牛奶样,分离得到22株无乳链球菌,四环素的耐药率最高(77.3%),而对青霉素G、万古霉素、红霉素等抗生素,敏感率从90%~100%不等。Ding等[50]分析了内蒙古地区360份临床乳房炎奶样,试验结果显示共分离出81株链球菌(22.5%),其中包括无乳链球菌57株(70.4%)、乳房链球菌15株(18.5%)和停乳链球菌9株(11.1%);所有分离株均表现出不同程度的耐药性,其中β-内酰胺类耐药率最高,分别为青霉素(95%)、阿莫西林(91.4%)、氨苄青霉素(81.5%)、头孢拉定(86.4%)和头孢噻吩(85.2%),有50%以上的菌株对红霉素、克林霉素和四环素耐药,没有全部敏感的菌株,有14株分离株表现出多重耐药,其中有3株耐7种以上抗生素。
2.2.4 其他致病菌耐药现状
除了常见的金黄色葡萄球菌、大肠杆菌以及链球菌以外,其他致病菌导致牛乳房炎也时有报道。早在1980年,Gitter等人[51]就从乳房炎奶样中分离出单增李斯特氏菌。Sambyal等[52]对来自查谟和周边的295份样品进行分析(包括乳房炎奶样110份和乳制品185份),从奶样中分离出3株单增李斯特氏菌,分离率为2.7%,所有分离株对阿莫西林+舒巴坦、氨苄青霉素、红霉素和恩氟沙星、左氧氟沙星、庆大霉素敏感,对阿米卡星、头孢氨苄、头孢匹肟、头孢呋辛和氨曲南耐药。Taponen等[53]则报道了芬兰的29969头奶牛中有四分之一确定为乳房炎感染,感染病原菌包括凝固酶阴性葡萄球菌(CNS)、金黄色葡萄球菌、乳房链球菌、乳酸链球菌、牛棒杆菌和大肠杆菌等6种。Ghazy等人[54]收集了150份乳房炎奶样,从中分离出20株铜绿假单胞菌(13.3%),这些菌株对9种供试抗生素均表现耐药,包括环丙沙星(5.0%),万古霉素(6.7%),头孢噻肟钠、庆大霉素、阿莫西林-克拉维酸、氨苄西林、磺胺甲恶唑、氯霉素和丙甲菌素(10.0%)。由此可见,随着对奶牛乳房炎研究的不断深入,越来越多病原微生物表现出的不同耐药情况被发现。
3 耐药机制
抗生素是国内外治疗奶牛乳房炎的重要药物,自从发现抗生素以来,其耐药性便被人们所发现并警惕其存在[55]。抗生素的矛盾之处在于通过使用可以抑制感染,但亦会使细菌产生耐药性,耐药性可通过不同方式进行传播,甚至直接抵消其长期疗效[56]。目前关于微生物耐药机制的研究主要分为遗传学机制和生化机制。
细菌遗传学耐药机制分为固有耐药(Intrinsic resistance)和获得性耐药(Acquired resistance)。固有耐药又称天然耐药,由细菌自身携带的耐药基因决定,且具有稳定的遗传特性,一般不会改变。获得性耐药则是在长期使用抗生素后,细菌通过自发突变和水平基因转移获得专门的耐药基因以保证自身生存。一旦获得了耐药基因或突变,细菌可以在抗生素存在下继续生长,而敏感细菌的生长停止[56],如果抗生素的压力解除,那么这些耐药基因将自行消除或者由细菌的非染色体转化为可遗传因子,最终形成固有耐药。可转移遗传因子包括质粒、转座子和整合子等。质粒(Plasmid)是最早发现的除细菌染色体以外的一种独立的、可自我复制的遗传元件,其特性导致可在细菌间转移并传播耐药基因[57],质粒介导喹诺酮类药物的耐药机制中编码喹诺酮耐药性的质粒pMG252的EcoRI的酶切片段(见图2)[58]。转座子(Transposon)是一段可以从基因组的一个位点移动至另一个位点的DNA序列,它是比质粒更小的DNA片段,可以携带耐药基因在细菌不同的基因组之间“跳跃”,从而导致耐药性的多样化[59,60]。研究发现,多数革兰氏阴性细菌的耐药基因通常位于转座子或质粒的基因元件——整合子(Integron)上,是一类对耐药基因进行天然整合和表达的载体,且随着转座子或质粒的移动而转移[61-62]。除此以外融合偶联元件(Integrating conjugative elements,ICEs)也是在细菌群体中传播抗生素耐药性基因的移动遗传因子,可以通过细胞-细胞接触转移并整合耐药基因至新宿主的染色体中,譬如SXT是源于霍乱弧菌的ICE并编码赋予氯霉素、磺胺甲恶唑、甲氧苄啶和链霉素等抗生素耐药基因,“SOS反应”增强了SXT转移所必需的基因表达[63](见图3)。
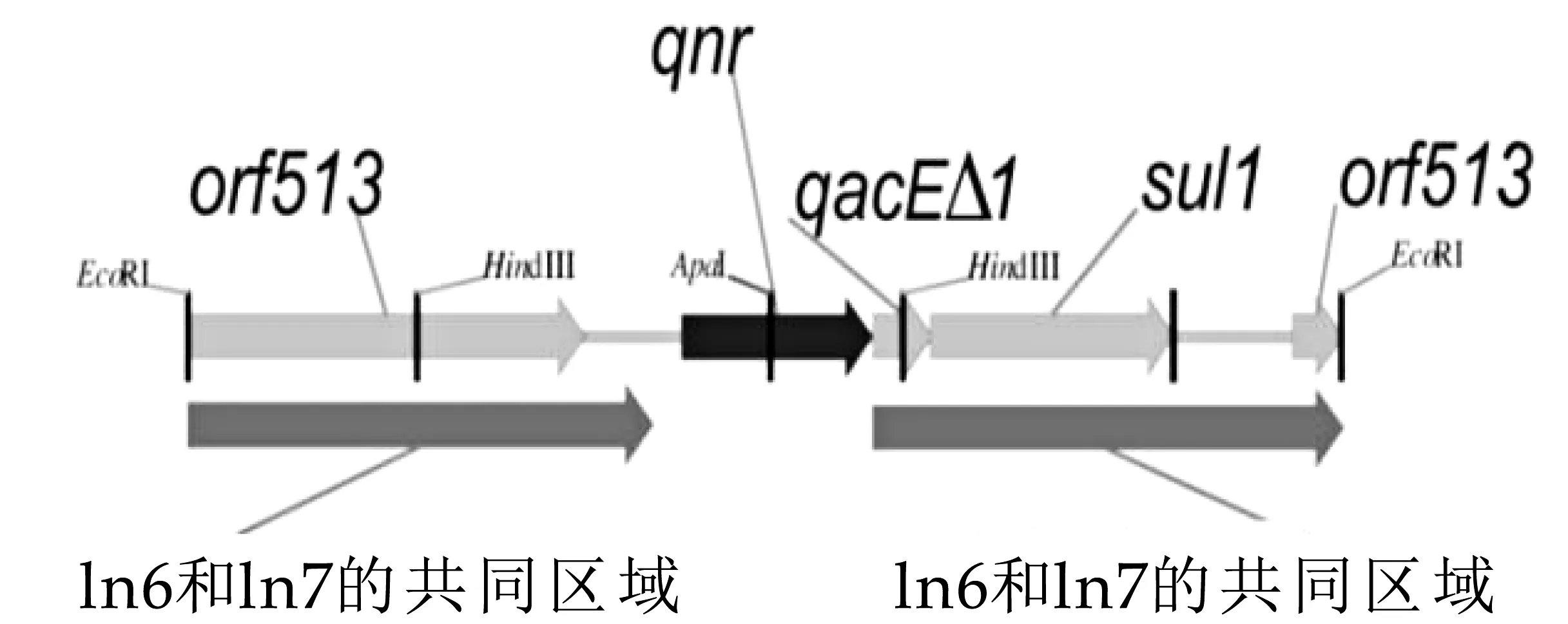
图2 编码喹诺酮耐药性的质粒pMG252的Eco RI的酶切片段图

图3 SOS反应增强SXT转移的调节途径模型
细菌耐药的生化机制包括:(1)酶解作用。当抗生素进入细菌细胞后,细菌可以产生使抗生素结构破坏的灭活酶或钝化酶,使其不能发挥抑菌作用,图4为β-内酰胺酶在青霉素到达革兰氏阴性细菌的细胞质膜中的PBP靶位点之前将其水解[64];(2)细胞壁通透性的改变和主动外排机制。细菌细胞壁上的孔蛋白是抗生素进入细胞的“通道”,蛋白质的主动外排系统有时会将抗生素排出胞外,如果孔蛋白基因突变使自身降低其表达,也可导致细菌对抗生素的耐药性增强[65]。如图5所示,四环素或红霉素等抗生素通过外排泵蛋白排出细胞外,维持胞内药物浓度低于治疗水平[64];(3)药物作用靶位改变。当细菌上能与抗生素结合的靶位点结构发生改变,抗生素无法与细菌结合也会使细菌产生耐药性。通过对耐药机制产生的原因进行简单分析发现,细菌耐药是由于内源性基因的突变,以及外源耐药性决定因子的基因转移而产生的[66]。

图4 抗生素通过由耐药细菌制成的酶进行化学修饰来破坏

图5 抗生素通过细胞壁外排泵蛋白排出细胞外
微生物耐药性的产生除基因转移或突变和生化机制外还存在生物膜的产生引起耐药的情况。生物膜(Biofilm)是指附着于生物或非生物表面的微生物群落,生物膜内的细胞被包裹在自产基质中[67]。根据最近的全基因组分析结果表明,包括人类肠道和土壤等在内的许多自然生态系统,都含有大量的基因,其功能可以被选择赋予抗生素耐药[68]。自然界中的细菌均可在一定条件下形成生物膜,这是细菌在自然条件下在物体表面生长时形成的一种自我保护状态[69]。生物膜的形成可以减少抗生素的进入并使其水解,从而提高耐药能力,生物膜基质的组分可以形成机械屏蔽,也可抑制抗生素作用,例如在铜绿假单胞菌生物膜中产生的Pel和Psl多糖可提高抗生素耐药性[70]。
4 耐药性检测方法
在使用抗生素治疗乳房炎的过程中,耐药菌株特别是多重耐药菌株的出现给乳房炎的有效防治带来了巨大的挑战。快速且准确地开展耐药性的检测对控制细菌感染、临床合理用药提供参考,为保证奶牛健康养殖,提高奶及奶制品质量安全以及保障消费者健康提供研究基础和技术支撑。目前,国内外在微生物药物敏感性试验方面主要参照美国临床试验室标准委员会(CLSI)推荐的《抗微生物药物敏感性试验执行标准》(Performance standards for antimicrobial susceptibility testing),该标准最新版本是2017年一月份更新的M 100-S27[71]。在该标准中规定进行药敏试验的传统方法包括纸片扩散法、肉汤稀释法、琼脂稀释法3种,药敏试验结果应报告为敏感(S)、中介(I)、耐药(R),其中最常使用的是纸片扩散法。对三种传统方法进行比较,纸片扩散法的可重复性好、操作简便,但是易出现假耐药,并且受人为因素影响[72];肉汤稀释法可精确测定最低抑菌浓度,但经验依赖性强、耗时长、无法肉眼判定微量肉汤法中是否存在杂菌[73];而琼脂扩散法的优点是重复性好、可肉眼观测是否有杂菌,缺点是费时费力[74]。除此以外还有在稀释法与扩散法基础上建立的新型耐药性检测方法——E-test法[75,76]和快速测定方法——全自动微生物鉴定/药敏分析系统[77],E-test法重复性好、检测方便可试验所需试纸条成本高,快速测定法相对而言更简便、快速、受人为影响小且可靠性高,但是仪器昂贵不利于普及。
近年来,利用分子生物学技术直接对细菌的耐药基因进行检测的方法也被广泛使用。与其他方法相比,PCR法是基于微生物中耐药基因的分子检测方法,具有快速、高效等特点。常见的PCR耐药性检测方法包括多重PCR以及实时荧光定量PCR。Pyatov等人[78]使用多重PCR测定了捷克共和国乳房炎奶样中分离出的病原菌的(包括大肠杆菌、金黄色葡萄球菌、乳房链球菌、无乳链球菌和无乳链球菌)耐药基因,有氨基糖苷类[str(A)、str(B)],磺胺类(sulI、sulII),四环素类[tet(A)、tet(B)、tet(K)、tet(M)、tet(O)],大环内酯类和林可酰胺类[msr(A)、erm(A)、erm(B)、erm(C)、mef(A/E)],多重PCR耐药检测结果可用来替代或补充所述病原体中表型耐药的结果。Steele等人[79]则用实时荧光定量PCR检测哺乳期乳房炎奶样中的乳房链球菌和金黄色葡萄球菌。Sartori等[80]开发了一种新的qPCR方法来检测牛乳房炎病原体金黄色葡萄球菌B型。用PCR检测方法与常规耐药性检测方法相比更省时、可靠,可是常见的PCR检测方法均局限于已知的耐药基因,无法发现新的基因[81]。用多重PCR以及实时荧光定量PCR固然检测便捷,大大缩短了检测时间,可是检测局限于已知的耐药基因和小批次样本。
依托于第二代基因测序技术出现的全基因组分析极大的扩展了对微生物耐药情况的研究,并且可以预测耐药性、解释耐药机制。Vélez等人[82]对91株乳房炎源乳房链球菌和停乳链球菌进行了全基因组测序,检测结果发现在细菌基因组中存在23种独特的抗生素耐药基因序列。然而全基因组测序预测耐药性需要高质量的基因文库作支持,无法对未知的耐药基因进行解析。因此,为了得到准确的抗生素耐药性以及耐药机制,我们仍需要对细菌的表型耐药情况进行检测。表2为不同种类抗生素耐药性检测方法的优缺点比较。

表2 牛乳房炎致病微生物抗生素耐药性检测方法优缺点比较
5 耐药性防控措施
准确快速的检测病原体以及确定其耐药性有助于确定出有效的治疗方法。为了避免奶牛乳房炎病原菌产生更强的耐药性,我们应该积极主动进行预防,从而避免牛乳房炎疾病的出现。
首先,应对饲养者和管理者展开针对奶牛健康养殖方面的知识和技术培训,避免因饲养管理不当造成感染;其次,要定期检测奶牛健康水平,避免罹患隐性乳房炎的奶牛因未察觉而感染牛群,减少奶牛应激反应;最重要的是要对养殖环境卫生进行严格消毒杀菌,从源头消除感染源。除此以外,在乳房炎疾病多发季节应严密监控牛群避免疾病发生。
针对已经出现乳房炎源病原菌耐药的牛群,建议首先采用广谱抗生素控制病情,再通过药物敏感性试验结果针对性地使用抗生素治疗,解决病原菌对原抗生素产生的耐药性。而在对临床患病奶牛进行用药之前,应对奶牛感染的致病菌进行分析鉴定,根据致病菌的情况科学用药。
为了应对日益严峻的奶牛乳房炎致病菌耐药形势,全球各个国家均建立了相关机构来监测乳品安全。1996年美国还成立了国家抗菌药物耐药性检测系统(NARMS)用以监测食源性致病菌的抗生素耐药性,目前重点监测的是沙门氏菌、弯曲杆菌属、大肠杆菌和肠球菌[83]。欧洲耐药性检测系统始建于1998年,主要负责人医、兽医及食品的抗生素耐药性监测[84]。1998年澳大利亚也成立了抗生素耐药性联合专家技术咨询委员会(Joint Expert Technical Advisory Committee on Antibiotic Resistance,JETA-CAR),主要职责是评估可食用动物抗生素的使用以及监测耐药菌的出现和转移[85]。国际乳品联合会[86](the International Dairy Federation,IDF)早在17年前便开始研究、审查及评估致病性大肠杆菌在乳品生产中的重要性的和对消费者身体健康的影响[87]。2001年,世界卫生组织(World Health Organization,WHO)制定了《遏制微生物抗生素耐药性全球战略》,用以控制耐药菌的出现和扩散[88]。此外日本、韩国、加拿大、瑞典和挪威等国家也建立了抗菌药物耐药性监测系统,用来控制甚至消除抗生素耐药性问题。我国细菌耐药监测系统起步较晚始建于2005年,2008年覆盖全国的细菌耐药监测网(MOH National Antimicrobial Resistance Investigation Net,Mohnarin)成立并开始监测动物源细菌耐药性[89],2017年2月农业部正式颁布了《2017年动物源细菌耐药性监测计划》并在全国范围内开展对动物源细菌耐药性的监测工作[90]。
综上所述,国内外细菌耐药性监测网络的日益完善和强化,关于乳房炎奶样中致病菌耐药性监测力度也进一步加大,这对于预防和控制奶牛乳房炎有着重要意义。
展 望
奶牛乳房炎病原菌越来越高的耐药率已经引起了世界各国的广泛关注,然而我国在相关领域的研究仍有一定差距。今后我国乳房炎耐药性的研究应该主要集中在乳房炎源细菌耐药机制及产毒能力、特异性菌株全基因组测序分析,并形成相关的风险评估报告,建立切实可行的预警防控体系等几方面。此外还应该关注临床治疗中抗生素的规范使用,为提升乳房炎的治疗效果提供参考。
