泡菜中高效氨氮降解菌的筛选及鉴定
2018-10-22冯爱娟朱美娟陈美娟苏莉莎叶茂
冯爱娟,朱美娟,陈美娟,苏莉莎,叶茂*
(1.广东轻工职业技术学院 食品与生物技术学院,广州 510300;2.广东高校特色调味品工程技术开发中心,广州 510300)
近年来,由于工业的快速发展,排出的废水急剧增加,导致水污染的原因有很多,如有机污染物、无机污染物等,其中废水中氨氮含量严重超标导致水体富营养化,危害环境。氨氮是水相环境中氨的主要形态,是造成水体富营养化的主要污染物。因此,氨氮的含量可以作为污水水质的重要指标。水体污染给环境和人类的生活造成了威胁[1,2]。根据搜查的相关资料,氨氮含量的排放量剧增,造成氮循环不规律[3],为保证水资源的可持续发展,开发出更高效的氨氮处理技术成为目前迫在眉睫的事情。现今,国内外对高氨氮废水处理方面也展开了较多研究,除了传统的方法外,还有现推行的方法生物脱氮技术[4],生物脱氮是利用从自然界中获得的有益微生物降解氨氮,生物脱氮技术具有无污染、经济和安全等优点,因此更加备受关注。生物脱氮技术的核心是筛选能高效降解氨氮的微生物,所以前人对这方面进行了大量的研究工作。近十几年来,很多学术上的学者从研究河虾等水殖产业的污水、某工业地的淤泥中筛选出能降解废水中氨氮的菌株,相关文献报道过的有硝化细菌、反硝化细菌、高效脱氮除磷菌等降解氨氮的菌株[5],在这方面也有了一定的进展。众多研究结果表明,高氨氮污水及污泥中筛选高效菌株是最为有效的优良菌剂获取方法,但尽管目前投入了大量的尝试性研究,还远远未达到有效、节约地处理污水氨氮的程度。因此,应对目前全国范围内各种污染类型水体中普遍发生的氨氮超标问题,筛选出高效菌株并对其性能进行优化仍是当前及未来的主要研究方向。我们也向着这个方向出发,研究以市售泡菜为原材料,使用富集与分离的方法筛选氨氮降解菌,通过测定其氨氮降解率以获得1株高效的氨氮降解菌株,并对其降解条件进行优化,期望能为我国处理水体的氨氮提供一条新途径。
1 实验材料与方法
1.1 泡菜样品
泡菜样品:市售。
1.2 培养基
1.2.1 富集培养基
葡萄糖5.0 g,(NH4)2SO42.5 g,NaCl 2.0 g,FeSO4·7H2O 0.4 g,K2HPO41.0 g,pH值7.2~7.4,MgSO4·7H2O 0.5 g,水1000 mL。取200 mL富集培养基放入1000 mL锥形瓶中,115 ℃灭菌30 min。
1.2.2 分离平板培养基
葡萄糖5.0 g,(NH4)2SO42.5 g,NaCl 2.0 g,FeSO4·7H2O 0.4 g,K2HPO41.0 g,pH值7.2~7.4,MgSO4·7H2O 0.5 g,琼脂20 g,水1000 mL,115 ℃灭菌30 min。
1.2.3 活化培养基
蛋白胨5 g,葡萄糖5 g,K2HPO42 g,NaCl 5 g,水1000 mL,pH值7.0~7.2,过滤分装后于115 ℃灭菌30 min。
1.2.4 斜面培养基
采用Luria-Bertani (LB)琼脂培养基,其组成如下:蛋白胨10 g/L,酵母膏5 g/L,NaCl 10 g/L和琼脂20 g/L。将pH调至7.5,121 ℃灭菌20 min。
1.2.5 摇瓶种子培养基
采用LB液体培养基,将pH调至7.5,121 ℃灭菌20 min。
1.2.6 筛选培养基
葡萄糖5.0 g,(NH4)2SO42.5 g,NaCl 1.0 g,K2HPO40.5 g,pH值7.2~7.4,MgSO4·7H2O 0.25 g,去离子水定容至1000 mL,此时NH4-N含量为500 mg/L,分装于1000 mL三角瓶中,每瓶200 mL,115 ℃灭菌30 min。
1.3 分离筛选出氨氮降解菌
1.3.1 氨氮降解菌的富集
配制好190 mL富集培养基,灭菌、冷却后,从混合均匀的泡菜样品中取出30 g,接入装有富集培养基的1000 mL三角瓶中,摇匀,再放入150 r/min,28 ℃的恒温摇床培养24 h。培养结束后测定pH值;然后取出10 mL上清菌液,加到新鲜富集培养基中在相同条件下再次富集培养,培养结束后再测定pH值,观察从培养基到富集2次后的pH值的变化情况。
1.3.2 氨氮降解菌的分离纯化
配制好分离平板培养基,灭菌、分装、冷却后,取第2次富集培养基中的上清菌液1 mL,在无菌操作条件下将培养液稀释、涂布于分离平板培养基上,于28 ℃恒温培养箱培养2~3天,至平板长出单菌落为止;挑取各个单菌落至新的平板上划线,28 ℃下培养2~3天,至平板上长出单菌落为止,以进一步纯化;挑选各个单菌落于斜面培养基上,于28 ℃下培养24 h;待斜面长出菌苔后,分别以斜面固态保藏于4 ℃冰箱和中制成甘油管保藏于-20 ℃冰箱中。
1.3.3 制备菌悬液及测定细胞浓度
将活化后的各菌种接入摇瓶种子培养基;各接入1环,于150 r/min、28 ℃恒温摇床培养24 h;在4 ℃、10000 r/min下离心15 min并弃上清液,收集菌体;将湿菌体加至无菌的生理盐水中洗涤3~4次[6],测定OD600=1,并将其配制成细胞浓度约为109个/mL的菌悬液备用。
1.3.4 筛选高效降解菌
制备摇瓶筛选培养基190 mL加入1000 mL的三角瓶中,灭菌、冷却后,分别接入各菌株的细胞浓度相等的菌悬液;置于150 r/min、28 ℃恒温摇床中培养72 h;采用《水杨酸分光光度法》分析经各菌种降解后的培养基中的氨氮残留量(24,48,72 h各测1次);用未接种的摇瓶做参照,记录数据并计算氨氮降解率。参照文献[7]中提出的方法,并按式(1)计算菌株的氨氮降解率:

(1)
综合数据,根据降解率的大小,优选出降解效率最高的目的菌株。
1.3.5 高效降解菌菌株最大吸收波长的测定
配制好100 mL活化培养基,灭菌、冷却后,将优选出的菌株在活化培养基中活化24 h(将斜面保藏的菌种接1环到活化培养基中,置于28 ℃和150 r/min条件下培养24 h),取培养液用紫外-可见光分光光度仪在340~600 nm的波长下以未接种的培养基为参比测定其OD值,以波长为横坐标,以OD值为纵坐标画图,确定该优选菌株的最大吸收波长。
1.3.6 高效降解菌菌株的生长曲线测定
将活化好的优选菌株,接1环至新鲜的活化培养基,在28 ℃、150 r/min恒温振荡培养,在该优选菌株的最大吸收波长处,每隔2 h取一定量培养液测定其OD值,以培养时间为横坐标,以最大吸收波长处的OD值为纵坐标绘制生长曲线。
1.3.7 氨氮降解菌菌株的初步鉴定
对优选菌种进行平板培养、革兰氏染色,观察其菌落形态及革兰氏属性。同时,参照文献[8-10],如《伯杰氏细菌鉴定手册》的方法,对生理生化特征等方面进行初步鉴定,如葡萄糖发酵试验、需氧性试验等。
1.3.8 菌株的16S rDNA测序
氨氮降解菌菌株的16S rDNA PCR扩增引物采用通用引物:正向引物27F为5′-AGAGTTTGATCC-
TGGCTCA-3′,反向引物1492R为5′-GGTTACCTTG-
TTACGACTT-3′(由上海生物工程有限公司合成),扩增产物电泳检测后送上海生物工程有限公司测序,将测得序列通过NCBI(http://www.ncbi.nlm.nih.gov)网站的GenBank核酸序列数据库内进行BLAST比对,找出核酸数据库中与氨氮降解菌菌株同源性较高的菌株序列,下载这些菌株的DNA序列,然后用生物软件MEGA4进行CLUSTAL比对并构建氨氮降解菌菌株的系统发育树。
2 实验结果
2.1 分离筛选高效氨氮降解菌的结果
富集实验的情况如下:第1天富集后pH为6.10;第2天为4.5,说明富集的菌株是产酸的;分离纯化试验:从泡菜原材料中共筛选了25株能降解高浓度氨氮的菌株;最后对这25株菌进行了氨氮降解率的测定实验。结果表明:在氨氮浓度为500 mg/L的液体培养基下,24 h内这些菌株氨氮降解率的范围为3.85%~29.81%;48 h的氨氮降解率范围为13.46%~43.64%,72 h的氨氮降解范围为35.72%~64.85%。由于硫酸铵在培养基灭菌过程中会出现高温分解,从而导致NH4-N的浓度降低,因此在培养基的配制过程中采用先不加硫酸铵灭菌后,通过过滤除菌将硫酸铵加入到培养基中后接种培养。试验表明:LJK8菌株的降解率最高为 64.85%,因此对LJK8菌株做进一步的研究。
2.2 LJK8菌株最大吸收波长的测定
LJK8菌株吸收波长实验结果见图1。
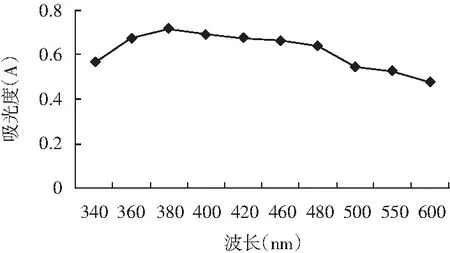
图1 LJK8菌株吸收波长Fig.1 The maximum absorbing wavelength of LJK8 strain
由图1可知,在波长340~600 nm之间,LJK8菌株在380 nm处有最大吸收峰,由此在380 nm处测其生长曲线,以研究其生长量与氨氮降解率之间的关系。
2.3 LJK8菌株的生长曲线测定
LJK8菌株的生长曲线测定结果见图2。
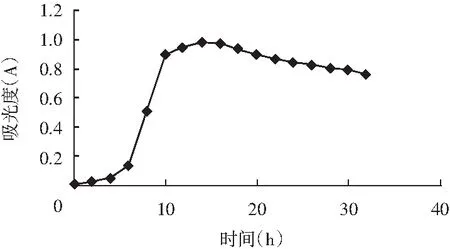
图2 LJK8菌株的生长曲线Fig.2 The growth curve of LJK8 strain
由图2可知,LJK8菌株在0~6 h为生长的适应期;在6~14 h为对数生长期;在14~36 h为生长的稳定期;在36 h之后才有所衰亡。LJK8菌株达到最大生长量是在培养第20 h。
2.4 LJK8菌株的初步鉴定
观察LJK8菌株的平板培养情况,(见图3),菌落为乳白色但不透明,圆形,边缘整齐。菌株经革兰氏染色后于显微镜下观察(见图4),细胞完全是细杆状,均为紫色,因此属于革兰氏阳性菌且无芽孢。
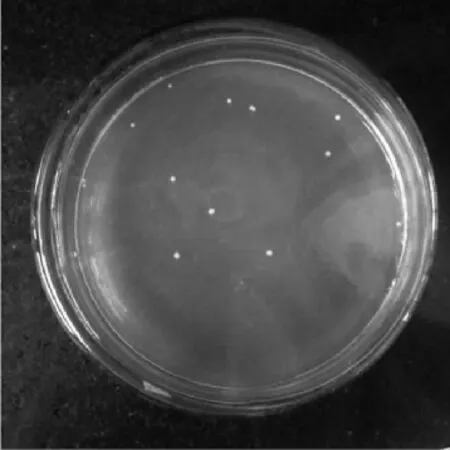
图3 LJK8菌株的菌落形态Fig.3 Colony of LJK8 strain

图4 LJK8菌株的革兰氏染色图Fig.4 Gram staining of LJK8 strain
2.5 LJK8菌株的生理生化试验
经过一系列的生理生化试验,观察结果,见表1。

表1 生理生化试验结果Table 1 The results of physiological and biochemical test
2.6 LJK8菌株的16S rDNA测定结果
将LJK8菌株的16S rDNA序列提交到GenBank数据库并构建菌株的系统发育树,见图5。可以初步鉴定LJK8菌株属于Rheinheimeraaquatica(水莱茵海默氏菌),扩增的16S rDNA与Rheinheimeraaquatica序列相似性达到99.99%,序列同源性为98%,所以初步确定该菌株为Rheinheimeraaquatica。
LJK8菌株的16S rDNA序列:
CGTAGGAAGCTACCCGATAGAGGGGGATACCAGTTGGAAACGACTGTTAATACCGCATAATGTCTACGGACCAAAGTGTGGGACCTTCGGGCCACATGCTATCGGATGCGCCTACGTGGGATTAGCTAGTTGGTGAGGTAATGGCTCACCAAGGCAACGATCCCTAGCTGGTTTGAGAGGATGATCAGCCACACTGGAACTGAGACACGGTCCAGACTCCTACGGGAGGCAGCAGTGGGGAATATTGGACAATGGGCGCAAGCCTGATCCAGCCATGCCGCGTGTGTGAAGAAGGCCTTCGGGTTGTAAAGCACTTTCAGTTGGGAGGAAGGGTTGTGTGTTAATAGTACACAGCCTTGACGTTACCAACAGAAGAAGCACCGGCTAACTCTGTGCCAGCAGCCGCGGTAATACAGAGGGTGCAAGCGTTAATCGGAATTACTGGGCGAAGCGCACGTAGGCGGTTTTTTAAGTCAGATGTGAAAGCCCCGGGCTCAACCTGGGAATTGCATTTGAAACTGGAAAACTAGAGTGTGTGAGAGGGGGGTAGAATTCCAAGTGTAGCGGTGAAATGCGTAGAGATTTGGAGGAATACCAGTGGCGAAGGCGGCCCCCTGGCACAACACTGACGCTCAGGTGCGAAAGCGTGGGGAGCAAACAGGATTAGATACCCTGGTAGTCCACGCCGTAAACGATGTCTACTAGCTGTTCGTGACCTTGTGTCGTGAGTAGCGCAGCTAACGCACTAAGTAGACCGCCTGGGGAGTACGGTCGCAAGATTAAAACTCAAATGAATTGACGGGGGCCCGCACAAGCGGTGGAGCATGTGGTTTAATTCGACGCAACGCGAAGAACCTTACCTACTCTTGACATCCAGAGAAGACTGCAGAGATGCGGTTGTGCCTTCGGGAACTCTGAGACAGGTGCTGCATGGCTGTCGTCAGCTCGTGTTGTGAAATGTTGGGTTAAGTCCCGCAACGAGCGCAACCCTTATCCTTAGTTGCCAGCGCGTAATGGCGGGAACTCTAGGGAGACTGCCGGTGATAAACCGGAGGAAGGTGGGGACGACGTCAAGTCATCATGGCCCTTACGAGTAGGGCTACACACGTGCTACAATGGTATGTACAGAGGGAGGCAAGCTGGCGACAGTGAGCGGATCTCTTAAAGCATATCGTAGTCCGGATCGCAGTCTGCAACTCGACTGCGTGAAGTCGGAATCGCTAGTAATCGCAAATCAGAATGTTGCGGTGAATACGTTCCCGGGCCTTGTACACACCGCCCGTCACACCATGGGAGTGGGTTGCAAAAGAAGTAGGTAGCTTAACCTTCGGGAGGGCGCTTACCACTTTGTGATTCATGACTGGGGTGAAGTCGTAA。
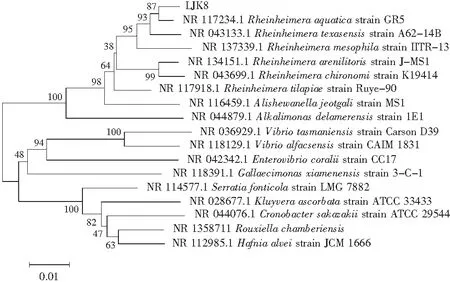
图5 LJK8的16S rDNA序列比对结果Fig.5 16S rDNA sequence comparison results of LJK8 strain
3 讨论
从盐含量高的泡菜为原料,以硫酸铵为唯一氮源的筛选培养基,筛选出具有氨氮降解能力的微生物,再进行分离和纯化,筛选出1株对高氨氮含量水相具有较高降解效率的菌株LJK8。经过测定,LJK8的最大波长及生长曲线、革兰氏染色及对其进行的一系列生理生化试验,可以初步了解LJK8菌株的基本属性。LJK8菌株的最适吸收波长在380 nm处,由其生长曲线可以看出,LJK8菌株在培养14 h时达到最大生长量;当以氨氮初始含量为500 mg/L的培养基培养时,并测定其氨氮降解率,在24~72 h内的降解效率达到64.85%,通过对LJK8菌株生长量及氨氮含量变化的检测,表明菌株生长与降解氨氮是同步进行的,说明其可在较长时间内发挥降解作用。
目前对能处理水体或者土壤中氨氮的文献报道还比较少,而我们研究从泡菜中筛选出来的高效氨氮降解菌LJK8菌株属于Rheinheimeraaquatica(水莱茵海默氏菌),还未见该菌用于氨氮降解的报道,LJK8如果应用于水体污染的处理方面还有很大的发展潜力,因此可对其在养殖污水、工业污水或者土壤中氨氮的深度净化处理上的应用再进一步进行研究。不过筛选出来的LJK8菌株相对于同一时段筛选的其他菌株的氨氮降解效率虽然较高,但是在如此高浓度的氨氮条件下仍然还有相当量的氨氮残留,因此我们后期将会研究该菌的降解工艺,并对其降解条件进行优化,增强菌株对高浓度氨氮污水的净化能力。期望LJK8能在后期的养殖污水及水体污染处理方面发挥一定的作用。
