不同加工方法牡丹皮中7种指标性成分的含量测定及质量评价
2018-10-19张洪坤王其丰郭长达吴韶辉路丽莫毛燕高贯彪
张洪坤 王其丰 郭长达 吴韶辉 路丽 莫毛燕 高贯彪

摘 要 目的:建立同時测定不同加工方法牡丹皮中7种指标性成分含量的方法,并评价其质量。方法:采用高效液相色谱法(HPLC)测定不同加工方法牡丹皮中7种指标性成分的含量,色谱柱为ZORBAX Eclipse XDB-C18,流动相为甲醇-0.1%磷酸溶液(梯度洗脱),检测波长为230、258 nm,流速为1 mL/min,进样量为10 μL,柱温为30 ℃。按《中国药典》的方法测定醇溶性浸出物的含量。采用灰色关联度法以7种指标性成分及醇溶性浸出物含量为指标,以相对关联度为测度,构建牡丹皮药材/饮片质量评价模型并进行质量评价。结果:没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚、苯甲酰芍药苷的进样量线性范围分别为0.002~0.034 μg(r=0.999 9)、0.003~0.045 μg(r=0.999 9)、0.013~0.189 μg(r=0.999 8)、0.019~0.291 μg(r=0.999 9)、0.002~0.030 μg(r=0.999 9)、0.050~0.752 μg(r=0.999 9)、0.005~0.076 μg(r=0.999 8);定量限分别为1.213、1.380、1.307、1.178、0.275、1.538、0.870 ng,检测限分别为0.364、0.414、0.392、0.354、0.083、0.461、0.261 ng;精密度、稳定性、重复性试验的RSD均小于3%;加样回收率分别为101.00%~105.20%(RSD=1.69%,n=6)、96.01%~104.14%(RSD=2.77%,n=6)、93.60%~99.87%(RSD=2.15%,n=6)、95.84%~97.39%(RSD=0.61%,n=6)、95.74%~99.31%(RSD=1.45%,n=6)、98.65%~100.80%(RSD=0.69%,n=6)、100.87%~107.07%(RSD=2.44%,n=6)。不同加工方法牡丹皮的相对关联度范围为0.396~0.590,质量高低排序依次为留皮留心药材(0.590)>去皮去心药材(0.532)>留皮去心鲜切片(0.523)>留皮去心药材(0.522)>留皮留心鲜切片(0.502)>去皮留心药材(0.420)>去皮留心鲜切片(0.409)>去皮去心鲜切片(0.396),留皮药材/饮片样品质量整体优于去皮药材/饮片样品。结论:HPLC法准确、可靠、重复性好,可用于同时测定不同加工方法牡丹皮中7种指标性成分的含量;灰色关联度法可用于评价不同加工方法牡丹皮的质量,牡丹皮产地加工时可选择“留皮去心药材”“留皮去心鲜切片”两种加工方法。
关键词 牡丹皮;产地加工;高效液相色谱法;灰色关联度法;含量测定;质量评价
中图分类号 R282.4;R927 文献标志码 A 文章编号 1001-0408(2018)22-3063-06
DOI 10.6039/j.issn.1001-0408.2018.22.09
ABSTRACT OBJECTIVE: To establish a method for simultaneous determination of 7 indicator components in Cortex Moutan by different processing methods, and to evaluate the quality of them. METHODS: HPLC method was adopted to determine the contents of 7 indicator components in Cortex Moutan by different proessing methods. The determination was performed on ZORBAX Eclipse XDB-C18 column with mobile phase consisted of methanol-0.1% phosphoric acid solution(gradient elution) at the flow rate of 1 mL/min. The detection wavelengths were set at 230 and 258 nm. The sample size was 10 μL and the column temperature was 30 ℃. The content of ethanol-soluble extract was determined by the method included in Chinese Pharamacopoeia. The quality evaluation model of Cortex Moutan material/decoction piece was established using 7 kinds of indicator components and ethanol-soluble extract as evaluation index, relative correlation degree as measurement. The quality of Cortex Moutan was evaluated. RESULTS: The linear range of gallic acid, catechin, oxidation paeoniflorin, paeoniflorin, benzoic acid, paeonol and enzoyl paeoniflorin were 0.002-0.034 μg(r=0.999 9), 0.003-0.045 μg(r=0.999 9), 0.013-0.189 μg(r=0.999 8), 0.019-0.291 μg(r=0.999 9), 0.002-0.030 μg(r=0.999 9), 0.050-0.752 μg(r=0.999 9) and 0.005-0.076 μg(r=0.999 8). The limits of quantitation were 1.213, 1.380, 1.307, 1.178, 0.275, 1.538, 0.870 ng, respectively. The detection limits were 0.364, 0.414, 0.392, 0.354, 0.083, 0.461, 0.261 ng, respectively. RSDs of precision, stability and repeatability test were all less than 3 %. The recovery rates were 101.00%-105.20%(RSD=1.69%,n=6), 96.01%-104.14%(RSD=2.77%,n=6), 93.60%-99.87%(RSD=2.15%,n=6), 95.84%-97.39%(RSD=0.61%,n=6), 95.74%-99.31%(RSD=1.45%,n=6), 98.65%-100.80%(RSD=0.69%,n=6), 101.87%-107.07%(RSD=2.44%,n=6), respectively. The relative correlation of Cortex Moutan by different processing method was 0.396-0.590. The order of the quality of all processed samples was: the original medicinal materials of Cortex Moutan that retained both cork and xylem(0.590) > the original medicinal materials of Cortex Moutan that removed both cork and xylem(0.532) > the fresh-cut slice of Cortex Moutan that retained cork but romoved xylem(0.523) > the original medicinal materials of Cortex Moutan that retained cork but removed xylem(0.522) > the fresh-cut slice of Cortex Moutan that removed both cork and xylem(0.502) > the original medicinal materials of Cortex Moutan that removed cork but retained xylem(0.420) > the fresh-cut slice of Cortex Moutan that removed cork but retained xylem(0.409) > the fresh-cut slice of Cortex Moutan that removed both cork and stayed xylem(0.396). As a whole, the quality of the samples of Cortex Moutan which had retained cork was higher than the quality of the samples of Cortex Moutan which had removed cork. CONCLUSIONS: HPLC method is accurate, reliable and repeatable for simultaneous determination of 7 indicator components in Cortex Moutan by different processing methods. Grey correlation degree method can be used for evaluating the quality of Cortex Moutan by different processing methods. The two methods of “fresh-cut slice of Cortex Moutan that retained cork but removed xylem” and “original medicinal materials of Cortex Moutan that retained cork but removed xylem” can be used to process fresh Cortex Moutan in habitats.
KEYWORDS Cortex Moutan; Field processing; HPLC; Grey correlation degree method; Content determination; Quality evaluation
牡丹皮系毛茛科植物牡丹(Paeonia suffruticosa Andr.)的干燥根皮,性微寒,味苦、辛,归心、肝、肾经,具有清热凉血、活血化瘀之功效,可用于治疗热入营血、温毒发斑、吐血衄血、夜热早凉、无汗骨蒸、经闭痛经、跌扑伤痛、痈肿疮毒等症[1]。有研究发现,牡丹皮中含有丹皮酚及其衍生物、芍药苷及其衍生物、挥发油、植物甾醇、有机酸类、香豆素类、多糖类、黄酮类等多种化学成分[2-5]。
中药材产地加工是药材生产与品质形成的重要环节,不同的加工方法对牡丹皮中药效成分的影响不同。2015年版《中国药典》(一部)[1]收载的牡丹皮加工方法为:秋季采挖根部,除去细根和泥沙,剥取根皮,晒干,或刮去粗皮,除去木心,晒干;前者习称连丹皮,后者习称刮丹皮。目前,市场上牡丹皮的产地加工品主要为刮丹皮、连丹皮、骨丹皮(不去木心)、丹皮根须等。有研究显示,与传统切制工艺比较,牡丹皮趁鲜切制具有省工省时的特点,可避免在中间流通环节中因长期贮存而导致的有效成分损失,从而保证牡丹皮饮片质量的稳定性[6-8]。
李静[9]采用不同方法加工亳州牡丹皮,以水分、总灰分、浸出物、4种主要指标性成分含量等因素为指标,考察了不同加工方法对其主要指标性成分的影响,并优选出最佳产地加工方法。刘威等[10]的研究以指标性成分、微量元素含量及指标性成分与微量元素综合的相对关联度为测度,建立牡丹皮灰色关联度模型以评价不同产地牡丹皮药材的质量。上述研究均采用常规的分析方法对其指标性成分进行考察,而本研究以7种指标性成分含量和醇溶性浸出物含量为指标,采用灰色关联度法评价不同加工方法对牡丹皮质量的影响,旨在为其质量控制提供参考。
1 材料
1.1 仪器
UltiMate-3000型高效液相色谱(HPLC)仪,包括柱温箱、自动进样系统、二极管阵列检测器[赛默飞世尔科技(中国)有限公司];RHP-100型高速多功能粉碎机(浙江荣浩工贸有限公司);MX5型百万分之一电子分析天平、XS204型万分之一电子分析天平(瑞士Mettler-Toledo公司);DHG-9245A型电热鼓风干燥箱、HWS-28型电热恒温水浴锅(上海市一恒科学仪器有限公司)。
1.2 试剂
没食子酸对照品(批号:110831-201605,纯度:90.8%)、儿茶素对照品(批号:110877-201604,纯度:99.2%)、芍药苷对照品(批号:110736-201539,纯度:96.4%)、苯甲酸对照品(批号:100419-201302,纯度:100.0%)、丹皮酚对照品(批号:110708-201407,纯度:99.9%)均由中国食品药品检定研究院提供;氧化芍药苷对照品(批号:MUST-16021505,纯度:99.93%)、苯甲酰芍药苷对照品(批号:MUST-16061803,纯度:99.28%)均由成都曼斯特生物科技有限公司提供;甲醇、磷酸为色谱纯,其余试剂均为分析纯,水为超纯水。
1.3 药材
鲜牡丹根于2017年9月采挖于安徽省亳州市魏岗镇,经广州市香雪制药股份有限公司连林生高级工程师鉴定为毛茛科植物牡丹(P. suffruticosa Andr.)的根。8批牡丹皮药材/饮片样品采用不同方法进行加工,详见表1。
2 方法与结果
2.1 色谱条件
色谱柱:ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.1%磷酸溶液(B)(梯度洗脫程序见表2);检测波长:230、258 nm;流速:1 mL/min;进样量:10 μL;柱温:30 ℃。在该色谱条件下,没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚和苯甲酰芍药苷的分离度均大于1.5,理论板数以丹皮酚峰计不低于5 000,详见图1。
2.2 混合对照品溶液的制备
精密称取没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚、苯甲酰芍药苷对照品各适量,分别置于10 mL量瓶中,加甲醇定容,摇匀得没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚、苯甲酰芍药苷质量浓度分别为0.5、0.5、0.3、1.0、0.5、1.0、0.5 mg/mL的单一对照品贮备液。分别精密吸取上述单一对照品贮备液各适量,置于同一100 mL量瓶中,加50%甲醇定容,摇匀,得没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚、苯甲酰芍药苷质量浓度分别为0.002 3、0.003 0、0.012 6、0.019 4、0.002 0、0.050 1、0.005 1 mg/mL的混合对照品溶液。
2.3 供试品溶液的制备
取药材/饮片样品粉末(过3号筛)约0.5 g,精密称定,置于具塞锥形瓶中,精密加甲醇50 mL溶解,称定质量,回流提取1 h,放冷,再次称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液1 mL,置于10 mL量瓶中,加50%甲醇定容,摇匀,即得。
2.4 线性关系考察
分别精密吸取“2.2”项下混合对照品溶液1、3、5、7、10、15 μL,按“2.1”项下色谱条件进样测定,记录峰面积。以各待测成分进样量(x,μg)为横坐标、峰面积(y)为纵坐标进行线性回归,回归方程与线性范围见表3。
2.5 定量限与检测限考察
分别精密吸取“2.2”项下混合对照品溶液适量,倍比稀释,按“2.1”项下色谱条件进样测定,以信噪比10 ∶ 1、3 ∶ 1分别计算定量限、检测限。结果,没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚、苯甲酰芍药苷的定量限分别为1.213、1.380、1.307、1.178、0.275、1.538、0.870 ng,检测限分别为0.364、0.414、0.392、0.354、0.083、0.461、0.261 ng。
2.6 精密度试验
取“2.2”项下混合对照品溶液适量,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚、苯甲酰芍药苷峰面积的RSD分别为0.50%、0.79%、0.23%、0.37%、0.36%、0.18%、0.47%(n=6),表明仪器精密度良好。
2.7 稳定性试验
取“2.3”项下供试品溶液(批号:S9)适量,分别于室温下放置0、3、6、9、12、15、18、21、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚、苯甲酰芍药苷峰面积的RSD分别为0.66%、1.34%、1.66%、0.68%、1.57%、0.42%、0.86%(n=9),表明供试品溶液在室温下放置24 h内基本稳定。
2.8 重复性试验
精密称取药材/饮片样品(批号:S9)粉末0.5 g,共6份,分别按“2.3”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量。结果,没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚、苯甲酰芍药苷的平均含量分别为0.138%、0.065%、0.511%、0.901%、0.062%、2.523%、0.212%,RSD分别为1.20%、2.89%、2.23%、0.96%、2.22%、0.50%、1.83%(n=6),表明本方法重复性良好。
2.9 加樣回收率试验
取已知含量的药材/饮片样品(批号:S9)粉末0.25 g,共6份,分别加入没食子酸对照品0.305 mg、儿茶素对照品0.145 mg、氧化芍药苷对照品1.133 mg、芍药苷对照品2.113 mg、苯甲酸对照品0.140 mg、丹皮酚对照品5.594 mg、苯甲酰芍药苷对照品0.471 mg,按“2.3”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表4。
2.10 样品含量及醇溶性浸出物含量测定
分别取8批药材/饮片样品粉末各适量,按“2.3”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,平行测定3次,记录峰面积并计算样品含量,结果见表5。另外,按照2015年版《中国药典》(四部)通则“2201醇溶性浸出物测定法”[11]测定醇溶性浸出物含量,平行测定3次,结果见表5。
2.11 灰色关联度分析
2.11.1 数据来源 以药材样品中没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚、苯甲酰芍药苷及醇溶性浸出物为指标性成分,基于表5的数据建立牡丹皮质量灰色模式识别数据集。
2.11.2 灰色关联度法参考序列选择 设有n个样品,每个样品有m项评价指标,由此组成评价单元序列:{Xik}(i=1,2,3……n;k=1,2,3……m;本研究中n=8,m=8)。用相对关联度作为评价测度时,应选择参考序列,一般应确定最优参考序列(Ysk)和最差参考序列(Ytk)[12]。将最优参考序列的各项指标对应n个样品的对应指标的最大值,记为{Xsk}=max(1≤i≤n){Xik},最差参考序列的各项指标对应n个样品的对应指标的最小值,记为{Xtk}=min(1≤i≤n){Xik}。
2.11.3 原始数据规格化处理 由于各评价指标间存在测度单位不统一的问题,因此需对原始数据按公式Yik=[XikXk] (式中,Yik为第n个药材样品的第k个指标经规格化处理后数据,Xik为原始数据,Xk为该指标的均值)作规格化处理,结果见表6。
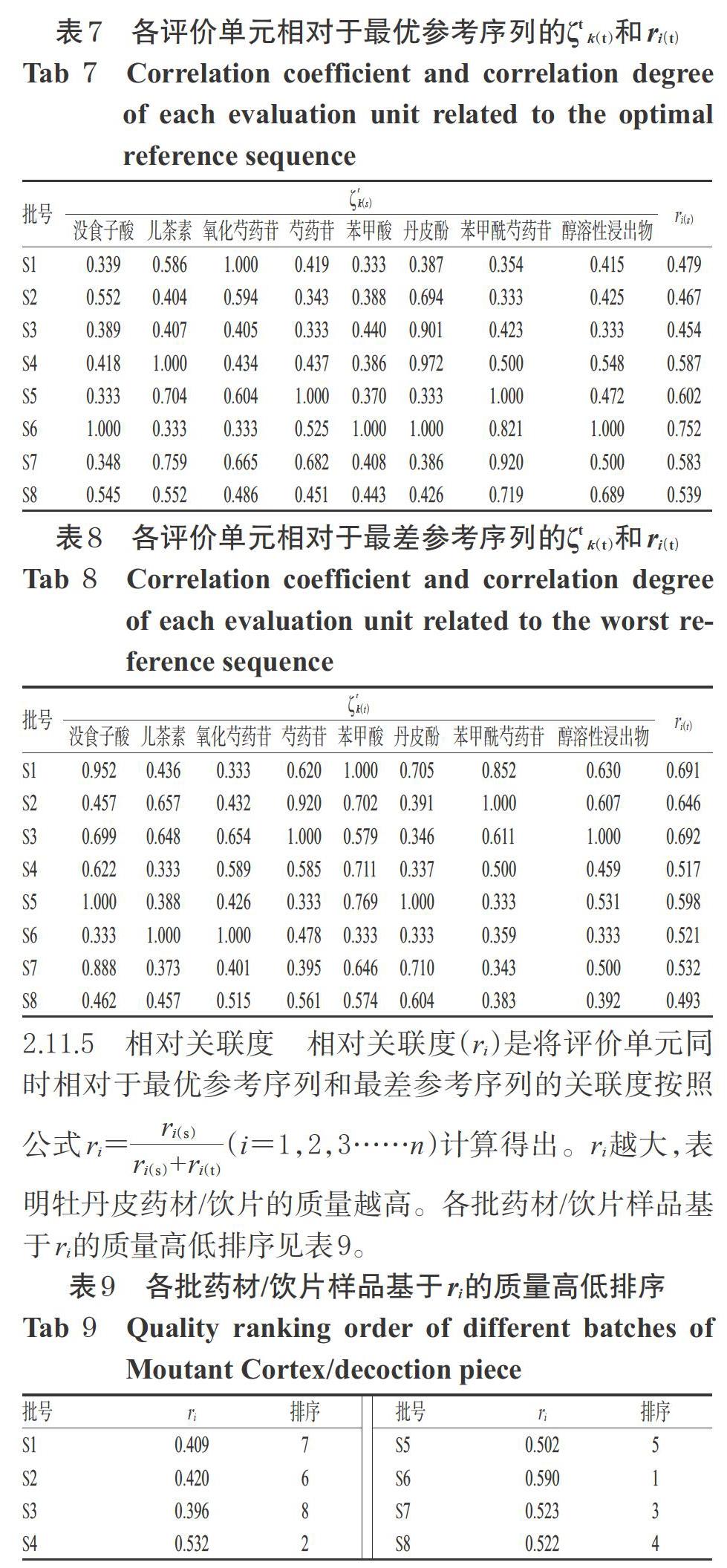
于最优参考序列和最差参考序列的[i][ζ k(t)]和ri(t),结果见表7、表8。
由表9可知,留皮留心药材样品(S6)的质量最高,药材在去栓皮或去木心后其指标性成分和醇性溶出物含量均有所减少,这可能与栓皮、木心中也含有上述成分有关[13]。而木心是牡丹皮传统的非药用部位,2015年版《中国药典》(一部)[1]要求在加工过程中需抽去木心,以利于缩短加工中的干燥时间。但从本研究结果来看其木心是否能够入药尚有待相关研究进一步验证。另本研究中发现,留皮药材样品(S6、S8)的质量整体优于去皮药材样品(S2、S4),提示牡丹皮药材以不去栓皮的质量较好,与相关文献研究结果[14]一致。因此,建议牡丹皮产地加工时保留栓皮部,以保证其质量。
3 讨论
本研究建立了同时测定不同加工方法牡丹皮中没食子酸、儿茶素、氧化芍药苷、芍药苷、苯甲酸、丹皮酚、苯甲酰芍药苷含量的HPLC法,该方法准确可靠、重复性好。
中药一般在产地加工成药材后进入流通环节,由于其贮存期长,有效成分含量必然会发生变化,特别是含挥发性成分的药材,药效降低更快;加之饮片生产中需经浸润、切制、炮炙、干燥等过程,使得有效成分进一步损失,药效进一步减弱。因此,减少饮片加工环节,短缩贮存时间,是保证饮片质量的有效方法。本研究中,牡丹皮留皮去心鲜切片(S7)与留皮去心药材(S8)的ri相近,提示牡丹皮趁鲜切制工艺可行。因此,牡丹皮可考虑在产地直接加工成饮片,并干燥使水分达到要求后密封包装,并于适宜条件下贮存,可减少二次加工造成的有效成分流失,同时可大大缩短其干燥时间。
灰色关联度法可利用已知的信息去揭示未知的信息,适合于分析成分复杂的中药材。本研究以7种指标性成分和醇溶性浸出物含量为指标,采用灰色关联度法建立牡丹皮的灰色关联模型,以ri为测度,评价了不同加工方法牡丹皮的质量,为牡丹皮的综合质量评价提供了新的方法。本研究结果显示,牡丹皮产地加工时可选择“留皮去心药材”“留皮去心鲜切片”两种加工方法,既能简化产地加工的烦琐过程,又能保证药材/饮片的质量。另外,通过对趁鲜切制工艺参数的优化,还可能进一步提高牡丹皮饮片的质量;牡丹皮经产地趁鲜切制加工成饮片可替代其传统的“产地加工-炮制两步法”切制工艺。
参考文献
[ 1 ] 国家药典委员会. 中华人民共和国药典:一部[S]. 2015年版. 北京:中国医药科技出版社,2015:172.
[ 2 ] 曹春泉. 牡丹皮的化学成分研究进展[J]. 广州化工,2013,41(12):44-45、51.
[ 3 ] 张艳,范俊安. 中药材牡丹皮研究概况Ⅲ:丹皮化学成分研究概况[J]. 重庆中草药研究,2008(2):24-31.
[ 4 ] 许舜军,杨柳,张勉,等. 牡丹皮化学成分的液相色谱-飞行时间串联质谱分析[J]. 药学学报,2006,41(9):852-856.
[ 5 ] 王子堯,陈彦,孙文秀,等. 超滤法分离丹皮多糖的研究[J]. 膜科学与技术,2009,29(4):98-100、116.
[ 6 ] 龙全江,王晓阁,周宙,等. 趁鲜切制法对牡丹皮饮片中丹皮酚含量的影响研究[J]. 中药材,2012,35(6):883-886.
[ 7 ] 龙全江,王晓阁,周宙,等. 趁鲜切制法对牡丹皮饮片中芍药苷含量的影响研究[J]. 现代中药研究与实践,2012,26(2):46-48.
[ 8 ] 王军,张雨凤,方成武,等. 趁鲜加工对凤丹皮的适用性研究[J]. 中国现代中药,2016,18(8):1039-1041、1047.
[ 9 ] 李静. 亳州牡丹皮产地加工、储藏方法及不同商品规格等级综合质量评价研究[D].合肥:安徽中医药大学,2016.
[10] 刘威,王振中,胡军华,等. 不同产地牡丹皮中微量元素与多指标成分灰色关联度评价及相关性分析[J]. 中国实验方剂学杂志,2017,23(1):34-41.
[11] 国家药典委员会. 中华人民共和国药典:四部[S]. 2015年版. 北京:中国医药科技出版社,2015:202.
[12] 刘思峰,杨英杰,吴利丰. 灰色系统理论及其应用[M]. 7版. 北京:科学出版社,2014:63-83.
[13] 周刚,吕庆红. 牡丹皮不同部位有效成分含量测定及指纹图谱化学成分研究[J]. 中国中药杂志,2008,33(8):2070-2073.
[14] 吕文海,张欣,宋磊,等. 山东荷泽牡丹皮产地加工品的定量分析[J]. 中成药,2005,27(10):1162-1165.
(收稿日期:2018-05-13 修回日期:2018-09-17)
(编辑:陈 宏)
