花生秸秆与青贮玉米搭配对湖羊瘤胃发酵特性的影响
2018-10-19华金玲付佳伟郁冯艳
华金玲,郭 亮,付佳伟,郁冯艳
(安徽科技学院动物科学学院,安徽 凤阳 233100)
花生秸秆产量较高,富含粗蛋白质,作为饲料来源应用于畜禽生产前景广阔[1],其作为安徽省肉羊生产优质豆科粗饲料来源,饲喂方式尚需深入研究。潘月红等发现花生秸秆富含钙、磷、铜、锰、锌和硒等矿物质,不仅具有一般粗饲料饲养效果,还可弥补日粮中矿物质不足[2]。Abdou等以80%、60%、40%、20%花生秸秆与浓缩料混合饲喂尼洛尔羊,日增重分别为40.3、58.8、71.9和86.6 g,可作为反刍动物主要日粮来源[3]。王笑笑等研究结果表明,花生秧和青贮玉米适宜配比有利于奶牛氮代谢和产奶性能提高[4]。Fernandes等利用花生秧替代禾本科牧草不同比例(0、30%、60%和100%)饲喂绵羊,瘤胃pH、总挥发性脂肪酸随花生秧比例增加,各处理组和不同时间点差异不显著,干物质降解率和粗蛋白降解率随花生秸比例增加呈线性增加,其中花生秧替代比例60%处理组试验羊日增重、瘤胃挥发性脂肪酸含量均优于其他试验组,适宜添加量利于反刍动物瘤胃消化率和生产性能提高[5]。
豆科和禾本科合理搭配利于反刍动物瘤胃健康和生产性能提高[6]。青贮玉米为优质禾本科粗饲料,研究花生秸秆与青贮玉米合理搭配对解决花生秸秆科学利用,拓展优质粗蛋白饲料资源渠道具有重要意义。本研究以花生秸秆作为粗饲料来源,探讨其与青贮玉米搭配对瘤胃发酵特性影响,为肉羊生产中花生秸秆高效利用提供参考。
1 材料与方法
1.1 试验设计
采用ANKOMRFS体外模拟瘤胃发酵系统对花生秸秆(购自安徽固镇县争华羊业有限公司)和青贮玉米(购自蚌埠和平乳业有限公司)搭配,分析湖羊瘤胃发酵特性。根据花生秸秆与青贮玉米添加比例(以干物质为基础),分为试验Ⅰ组(100:0)、试验Ⅱ组(75:25)、试验Ⅲ组(50:50)、试验Ⅳ组(25:75)和试验Ⅴ组(0:100);试验以标准羊草(试验Ⅵ组)作为对照,每组每个时间点设5个重复。分别于3、6、9、12、24、36和48 h测定各试验组瘤胃产气量和甲烷气体产气量;测定各试验组24、48 h瘤胃pH、氨态氮(NH3-N)和微生物菌体蛋白(MCP)产量。
1.2 样品采集及分析方法
1.2.1 样品预处理
依据Menke Syringe系统瘤胃液与人工唾液1:9配制微生物培养液,各试验组样品准确称取500 mg(干物质基础)无损耗转移置相应培养瓶,每个培养瓶中添加人工唾液90 mL,持续通入CO2气体至饱和,密封,置于(39±0.5)℃培养箱中过夜,用于添加瘤胃液。
1.2.2 瘤胃液采集与处理
3只具有瘘管成年湖羊,粗饲料以羊草为主,日粮精粗比为3:7,每日饲喂3次,晨饲前采集瘤胃液。瘤胃液保温瓶调节温度至(39±0.5)℃,充入CO2气体备用。利用真空采样装置采集供试湖羊瘤胃液,保温瓶带回实验室。
瘤胃液六层纱布过滤置于(39±0.5)℃水浴中,持续通入CO2气体,利用注射器针头将过夜培养瓶中多余气体放尽,注入5 mL瘤胃液,置于(39±0.5)℃恒温箱培养。
1.2.3 瘤胃产气量和甲烷气体产量测定
ANKOMRFS体外模拟瘤胃发酵系统自动记录相应时间点瘤胃产气量。气相色谱仪(GC-2010)测定培养时间为3、6、9、12、24、36和48 h甲烷气体产量。
色谱条件:色谱柱(HP-INNOWAX(19091N-133);气化室温度100℃,检测室温度120℃,注温80℃,柱流量2.7 mL·min-1,载气为高纯度氮气,总流量46.2 mL·min-1,压力179.5 kPa,流量30 mL·min-1,进样量20 μL,H2流量40 mL·min-1,空气流量400 mL·min-1。
1.2.4 瘤胃pH和挥发性脂肪酸(VFA)测定
利用酸度计直接测定各试验组24 h和48 h培养液作为瘤胃pH。
各试验组分别取培养24、48 h发酵液1 mL于离心管中,加入0.2 mL 8.2%偏磷酸,于4℃高速离心(20 000 g)10 min,取上清液,利用GC-2010气相色谱仪测定VFA中乙酸、丙酸、丁酸含量。
色谱条件:检测室温度与气化室温度分别为220、200 ℃;检测室中H2流量为40 mL·min-1;空气流量为400 mL·min-1,进样量2μL;柱温先升至80℃持续1 min,再以15℃·min-1升温至170℃后维持1.5 min;载气为高纯氮,压力100 kPa,柱流量 1.19 mL·min-1,总流量 63.8 mL·min-1,分流比50,吹扫流量3 mL·min-1,循环流量30 mL·min-1。
1.2.5 瘤胃NH3-N浓度和MCP产量测定
分别将培养24和48 h的培养瓶从恒温培养箱中取出放置于4℃冷藏室内稳定3 h,用于瘤胃NH3-N浓度和MCP产量测定。
利用比色法测定各试验组培养液中NH3-N浓度(700 nm)。吸取混合液1.5 mL置于2 mL离心管内,在3 500~4 000 r·min-1下离心10 min,取上清液0.4 mL,向上清液中加入1.6 mL 0.2 mol·L-1HCl,摇匀,取0.08 mL混合液,加入0.4 mL E液(2 mL次氯酸钠溶液混于100 mL 0.3 mol·L-1氢氧化钠溶液)摇匀,静置10 min后上机测定。
采用嘌呤法测定各试验组体外微生物蛋白产量(260 nm)。取8 mL均匀发酵液于3个10 mL离心管,在20 000 g,4℃条件下离心20 min;弃上清液后加入2.104 mL 0.6 mol·L-1HClO4,水浴1 h,冷却,参照标准曲线处理方法;以0.5 mol·L-1HCl溶液作比,在260 nm下比色,根据光密度值和标准曲线求出RNA测定值。
微生物蛋白(mg·mL-1)=RNA测定值(mg·mL-1)×RNA含氮量/细菌氮中RNA含氮量×6.25/5
其中,RNA含氮量为17.83%,细菌氮中RNA含氮量为10%。
1.3 数据分析
采用SAS9.1.3软件处理,作Duncan多重分析。
2 结果与分析
2.1 对瘤胃产气量和甲烷气体产量影响
花生秸秆和青贮玉米搭配体外培养各时间点瘤胃产气量见图1。
由图1可知,随培养时间增加,各处理组瘤胃产气量随之增加。随花生秸秆添加比例增加,各培养时间点瘤胃气体产量呈下降趋势。除试验Ⅴ组产气量在体外培养36 h后低于标准羊草组产气量外,其他各组产气量均高于标准羊草组。
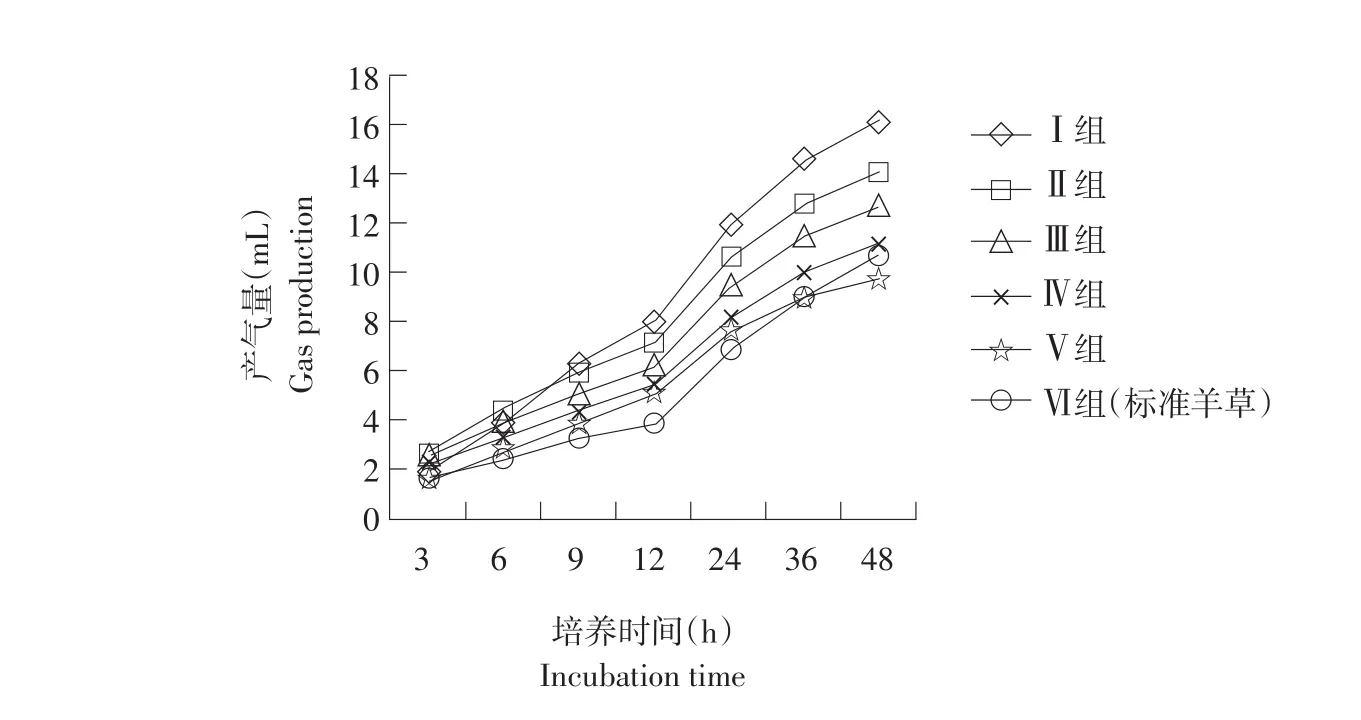
图1 各处理组体外培养时间瘤胃产气量变化Fig.1 Changes of gas production from treated groups at different timesincubation
由表1可知,未添加花生秸秆试验Ⅰ组体外培养24和48 h,瘤胃产气量显著高于其他试验组(P<0.05)。体外培养24 h,添加花生秸秆试验Ⅱ、ⅢⅣ、Ⅴ组瘤胃产气量与标准羊草组间差异显著(P<0.05),分别比标准羊草组提高53.87%、36.78%、18.53%、9.7%;体外培养48 h,添加花生秸秆试验Ⅱ、Ⅲ组瘤胃产气量显著高于标准羊草组(P<0.05),分别提高31.56%、19.31%,Ⅳ、Ⅴ组与标准羊草组间差异不显著(P>0.05)。
花生秸秆和青贮玉米搭配体外培养各时间点瘤胃甲烷气体含量见图2,表1。由图2、表1可知,各处理组瘤胃甲烷气体含量均随培养时间不断增加,随花生秸秆比例增加,瘤胃甲烷气体含量各培养时间点呈下降趋势,但均高于标准羊草组。体外培养24 h,添加花生秸秆试验Ⅱ、Ⅲ、Ⅳ和Ⅴ组瘤胃甲烷气体含量均显著高于标准羊草组(P<0.05),分别提高 17.90%、18.33%、6.99%、6.00%。体外培养48 h,各试验组瘤胃甲烷气体含量均高于标准羊草组;添加花生秸秆试验Ⅱ、Ⅲ组瘤胃甲烷气体含量与标准羊草组间差异显著(P<0.05),分别提高13.37%、13.28%;试验组Ⅳ、Ⅴ组瘤胃甲烷气体含量与标准羊草组差异不显著(P>0.05)。
随体外培养时间增加,48 h各处理组瘤胃产气量和甲烷气体浓度均高于24 h各处理组,且差异显著(P<0.05)。

表1 体外培养24 h和48 h各处理组瘤胃产气量和甲烷气体含量Table 1 Changes of gasproduction and CH 4 composition from treated groups at 24 and 48 h in vitro
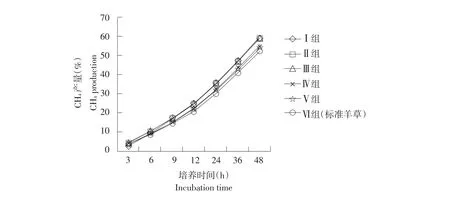
图2 各处理组体外培养时间瘤胃甲烷气体含量变化Fig.2 Changes of CH 4 concentration from treated groups at different timesincubation
2.2 对瘤胃pH和VFA影响
2.2.1 对瘤胃pH影响
花生秸秆和青贮玉米搭配体外培养瘤胃24和48 h各处理组瘤胃pH见表2。随花生秸秆添加比例增加,瘤胃pH呈增加趋势。体外发酵培养24 h,试验Ⅴ组瘤胃pH显著高于其他试验组(P<0.05);试验Ⅵ组(标准羊草)与Ⅳ组瘤胃pH差异不显著(P>0.05),与试验Ⅰ、Ⅱ组差异显著(P<0.05);试验Ⅲ和Ⅳ组瘤胃pH差异不显著(P>0.05),与试验Ⅰ、Ⅱ组差异显著(P<0.05);试验Ⅰ、Ⅱ组瘤胃pH差异不显著(P>0.05),与其他试验组间差异显著(P<0.05)。体外发酵培养48 h瘤胃pH变化情况一致,其中试验Ⅴ组瘤胃pH显著高于其他试验组(P<0.05);试验Ⅲ、Ⅳ、Ⅵ组瘤胃pH差异不显著(P>0.05),且与其他试验组差异显著(P<0.05);试验Ⅱ组瘤胃pH与各处理组差异显著(P<0.05);试验Ⅰ组瘤胃pH与各处理组差异显著(P<0.05)。
随体外培养时间延长,瘤胃pH呈下降趋势,体外培养48 h瘤胃pH均低于体外培养24 h。其中试验Ⅱ和Ⅲ组,体外培养24和48 h瘤胃pH差异不显著(P>0.05);试验Ⅰ、Ⅳ、Ⅴ和Ⅵ组,体外培养24和48 h瘤胃pH差异显著(P<0.05)。

表2 体外培养24 h和48 h各处理组瘤胃p H和VFA含量Table 2 p H and VFA concentration from treated groups at 24 and 48 h in vitro (μmol·mL-1)
2.2.2 对瘤胃VFA的影响
随着花生秸秆添加比例增加,各处理组VFA含量均呈不同程度下降(见表2)。体外培养24 h,瘤胃乙酸含量均显著高于标准羊草组(P<0.05);丙酸含量试验Ⅴ组与标准羊草组差异不显著(P>0.05),其他试验组丙酸含量均显著高于标准羊草组(P<0.05);丁酸含量试验Ⅴ组含量最低,且与其他试验组之间差异显著(P<0.05),添加花生秸秆试验Ⅱ和Ⅲ组显著高于标准羊草组(P<0.05),试验Ⅳ组高于标准羊草组,但差异不显著(P>0.05)。体外培养48 h,乙酸、丙酸含量各处理组间差异不显著(P>0.05),添加花生秸秆各试验组之间丁酸含量差异显著(P<0.05)。
随着体外培养时间增加,48 h各处理组瘤胃乙酸产量显著高于24 h(P<0.05);48 h各处理组瘤胃丙酸产量均高于24 h,其中试验Ⅱ、Ⅲ组瘤胃体外培养24和48 h丙酸产量之间差异不显著(P>0.05),其他各处理组间差异显著(P<0.05);48 h各处理组瘤胃丁酸产量均高于24 h瘤胃丁酸产量,除试验Ⅴ组外,其他各试验组之间瘤胃丁酸含量差异显著(P<0.05)。
2.3 对瘤胃NH 3-N浓度和MCP产量的影响
花生秸秆和青贮玉米搭配对瘤胃NH3-N浓度和MCP产量影响见表3。

表3 体外培养24和48 h各处理组瘤胃NH 3-N浓度和MCP产量变化Table 3 NH 3-N concentration and MCPproduction from treated groups at 24 and 48 h in vitro
随花生秸秆添加比例增加,瘤胃NH3-N浓度总体呈增加趋势。体外培养24 h,标准羊草组NH3-N浓度显著高于添加花生秸秆各试验组(P<0.05);添加花生秸秆各试验组间,花生秸秆添加比例为100%的试验Ⅴ组瘤胃氨态氮浓度最高,显著高于试验Ⅲ组(P<0.05),但与试验Ⅱ组和试验IV组之间差异不显著(P>0.05)。体外培养48 h,试验V组与标准羊草组(对照组)瘤胃NH3-N浓度相近,差异不显著(P>0.05);试验Ⅴ组与试验Ⅰ、Ⅱ、Ⅳ组之间差异显著(P<0.05),与试验Ⅲ组差异不显著(P>0.05);试验Ⅰ、Ⅱ、Ⅲ、Ⅳ组间差异不显著(P>0.05)。
瘤胃MCP产量见表3。体外培养24 h,全部为青贮玉米的试验Ⅰ组瘤胃MCP产量最高,且与其他各组差异显著(P<0.05);添加花生秸秆各试验组瘤胃MCP产量差异不显著(P>0.05);花生秸秆与青贮玉米比例为50%:50%(试验Ⅲ组)时,瘤胃MCP产量分别比标准羊草组、试验Ⅱ组、Ⅳ组及Ⅴ组MCP产量高8.95%、4.22%、5.30%、7.25%;花生秸秆添加比例为100%(试验Ⅴ组)时,瘤胃MCP产量与标准羊草(试验Ⅵ组)相近(P>0.05),较试验Ⅱ、Ⅲ、Ⅳ减少相应比例;标准羊草组(试验Ⅵ组)瘤胃MCP产量最低;瘤胃MCP产量排序为Ⅰ>Ⅲ>Ⅱ>Ⅳ>Ⅴ>Ⅵ组。体外培养48 h,瘤胃MCP产量试验Ⅰ、Ⅳ、Ⅵ组差异不显著(P>0.05);试验Ⅰ组瘤胃MCP产量最高,与试验Ⅱ、Ⅲ、Ⅴ组瘤胃MCP产量差异显著(P<0.05),与试验Ⅳ和Ⅵ组(标准羊草)瘤胃MCP产量差异不显著(P>0.05);添加花生秸秆各试验组瘤胃MCP产量间差异不显著(P>0.05);瘤胃MCP产量排序为Ⅰ>Ⅵ>Ⅳ>Ⅲ>Ⅱ>Ⅴ组。
随着培养时间增加瘤胃NH3-N浓度变化,除试验VI组24 h瘤胃NH3-N浓度显著高于48 h NH3-N浓度外(P<0.05),其他试验组48 h瘤胃NH3-N浓度显著高于24 h NH3-N浓度(P<0.05);随培养时间增加MCP产量下降,24 h瘤胃MCP产量显著高于48 h(P<0.05)。
3 讨 论
3.1 对瘤胃产气量和甲烷气体产量影响
Zhao和Sebata等研究发现饲料有机物质发酵程度与瘤胃产气量间相关性较高[7-8]。花生秸秆添加比例25%~50%时,瘤胃产气量高,随花生秸秆比例增加,产气量减少。袁翠林等利用体外发酵系统评价豆秸、花生秧和青贮玉米搭配瘤胃发酵特性,添加豆秸或花生秧试验组产气量高于单一青贮玉米组,豆秸和花生秸添加比例20%~60%,产气量随着豆科饲草增加而增加[9],与本试验结果一致。金海等利用瘤胃体外发酵体系综合评价泌乳牛饲粮配方发现,干玉米秸秆搭配青贮玉米组产气量高于单一青贮组,苜蓿搭配青贮玉米产气量最高,表明粗饲料搭配优于单一饲喂,豆科和禾本科搭配饲喂效果更好[10]。本试验中花生秸秆粗蛋白含量较高,为花生秸秆和青贮玉米搭配发酵提供较充足氮源,青贮玉米制作时营养价值较高,易发酵碳水化合物较多,搭配发酵程度好,产气量高,但花生秸秆木质化程度较高,随着花生秸秆比例增加瘤胃微生物可利用发酵底物减少,表现为产气量随着花生秸秆比例增加呈下降趋势。Beauchemin等研究表明,日粮中细胞壁含量升高导致瘤胃中发酵类型趋向于乙酸发酵,增加甲烷气体产量,而可溶性碳水化合物发酵较细胞壁碳水化合物发酵产生甲烷少[11]。本试验花生秸秆中可降解纤维物质含量较高,瘤胃发酵乙酸发酵类型向丙酸发酵类型转变,甲烷气体产量随着花生秸秆添加比例增加呈下降趋势。
3.2 对瘤胃p H和VFA的影响
瘤胃pH反映瘤胃发酵程度,一般在pH 6.0~7.0,过高或过低均影响粗饲料中纤维物质正常降解[12]。吴仙等研究发现瘤胃pH与饲粮中粗纤维和粗蛋白含量密切相关,粗蛋白含量高粗纤维含量较低的饲粮结构易导致瘤胃pH不变或稍增加[13]。本试验各处理组瘤胃pH 6.54~6.87,符合反刍动物瘤胃发酵环境,随花生秸秆比例增加,瘤胃pH呈增加趋势。刘大程等和胡红莲等报道粗饲料品质改变瘤胃发酵特性,随着结构性碳水化合物增加,呈现乙酸产量增加丙酸产量下降趋势[14-15]。袁庆启等通过奶牛瘤胃VFA代谢研究发现,饲粮纤维结构与瘤胃中微生物数量、种类及其活性有关,是影响瘤胃内VFA浓度主因[16]。花生秸秆收获期结构性碳水化合物含量较高,本试验花生秸秆添加比例为25%~50%时,乙酸、丙酸及丁酸产量均高于其他添加组,有利于瘤胃微生物活性、生产性能提高。
3.3 对瘤胃NH 3-N浓度和MCP产量的影响
瘤胃NH3-N浓度与日粮中结构性碳水化合物特性、粗蛋白水平密切相关[17-19]。Dung等和Ghorbani等研究发现饲粮中粗蛋白水平提高,瘤胃NH3-N浓度随之升高,NH3-N浓度随着瘤胃微生物摄取、瘤胃壁吸收及食糜外排逐渐降低[20-21]。本试验花生秸秆比例增加日粮中粗蛋白水平提高,瘤胃NH3-N浓度随之增加。张吉鹍等研究发现,瘤胃NH3-N浓度与MCP产量密切相关,适宜NH3-N浓度有利于MCP合成,苜蓿添加比例25%~75%时,奶牛瘤胃MCP合成效率提高[22]。Chung等提出瘤胃微生物生长适宜NH3-N浓度为6~30 mg·100 mL-1,过高则反刍动物将消耗能量,多余NH3通过肝脏转化为尿素[23]。本试验NH3-N浓度为12.30~25.525 mg·100 mL-1,可为瘤胃微生物合成微生物蛋白提供正常环境。本试验花生秸秆添加比例为25%~50%时,瘤胃MCP合成效率提高,与上述结果一致。48 h瘤胃MCP产量低于24 h瘤胃MCP产量可能与瘤胃食糜外排有关。
4 结 论
花生秸秆与青贮玉米搭配对湖羊瘤胃发酵特性影响显著。随着花生秸秆添加比例从0~100%变化,瘤胃产气量和甲烷气体浓度、VFA以及NH3-N浓度、MCP产量均呈下降趋势,表明花生秸秆不宜单一利用作为湖羊的粗饲料来源;各处理组体外培养48 h瘤胃发酵指标均较24 h显著增加,表明粗饲料适宜瘤胃发酵,有利于提高瘤胃微生物活性。综上,花生秸秆添加比例为25%~50%,与青贮玉米搭配,可增加瘤胃微生物活性,提高湖羊生产性能。
