利用CRISPR-Cas9系统高效创制水稻品系“17318”的OsGW2、OsGN1a基因定向突变体
2018-10-19周建平吉琳艺郑雪莲蔡光泽
周建平,吉琳艺,何 瑶,郑雪莲,罗 樊,蔡光泽*,张 勇*
(1.电子科技大学生命科学与技术学院信息生物学中心,成都 610054;2.西昌学院,四川 西昌 615013)
传统创制突变体的方法主要有辐射诱变、化学诱变剂处理、转座子插入及T-DNA插入等[1]。尽管这些诱变方法都能够使植株发生突变,但是其突变位点是随机产生,由此也增加了突变体的筛选难度。近几年来,基因编辑技术成为一种新兴的创制突变体的方法。其主要是运用特异的核酸酶定向使目标基因产生DNA双链断裂(double-strand break,DSB),断裂的DNA能够激活细胞内固有的非同源末端连接(Non-homologous-ending-joining,NHEJ)或同源重组(Homologous recombination,HR)两种不同的修复机制对其进行修复[2-3],从而实现对基因组的定点编辑。
早期的基因编辑技术主要包括锌指核酸酶(Zinc-finger nucleases,ZFNs)和转录激活因子样效应物核酸酶(Transcription activator-like effector nucleases,TALENs),它们都是由特异性的DNA识别结构域和具有DNA剪切功能的Fok I核酸内切酶组成。ZFNs的DNA识别结构域由3~4个Cys2-His2锌指蛋白(zinc-fingers)串联组成,每个锌指蛋白识别并结合一个特异的三联体碱基[4]。TALENs的DNA识别结构域由一系列植物病原菌黄单胞菌(Xanthomonas)自然分泌的TAL效应子蛋白串联重复组成,每个TAL效应子只能识别一个碱基[5]。近几年来,ZFNs和TALENs被应用于植物基因组的编辑中[6],这为植物突变体创制和育种提供了新的思路。但是ZFNs和TALENs这两项实验技术操作难度大,载体的构建较为复杂,耗时长,且效率低,一般实验室很难有效利用。
2013年,多个研究组相继发表了应用CRISPR/Cas9 (Clustered regularly interspaced short palindromic repeats)作为一种新的基因编辑工具对基因进行改造的文章[7-12]。CRISPR/Cas系统结构早在1987年就已经被发现[13],但是直到2007年才被首次证明该系统与细菌免疫系统相关[14],是细菌保护机体免受病毒或质粒DNA入侵的一种免疫机制。这种免疫保护主要是通过细菌体内具有的序列特异性小RNA沉默外来入侵的核苷酸来完成的[15]。
CRISPR-Cas9系统因其设计操纵简便、编辑高效与通用性广等优势而广泛应用于动物、植物、微生物基因组的定向修饰及遗传改良中[16-21]。最近,研究者发展了新的Ⅱ型CRISPR-Cas系统—CRISPR/Cpf1系统[22-23],它主要优点是删除片断比较大(大多为6~13 bp),目前已经在植物中加以应用[24-26]。
水稻籽粒大小和穗粒数是与产量直接相关的重要性状,同时与水稻的品质有密切关系。到目前为止,一些控制籽粒大小和穗粒数的基因被成功克隆并用于育种中[27-28]。GW2是一个控制粒宽和粒重的主效基因,GW2编码一个环型E3泛素连接酶,GW2功能缺失会加快水稻籽粒灌浆速率,导致粒宽增大、粒重和产量增加。另外,虽然增大了粒宽,但对籽粒外观品质影响很小,而且几乎没有影响到蒸煮和食味品质[29]。GN1a是第一个被克隆的控制穗粒数的QTL,位于第1染色体的短臂,编码细胞分裂素氧化酶/脱氢酶2,能够降解细胞分裂素。GN1a表达量的下降或者功能缺失,使得颖花分生组织中细胞分裂素大量积累,增加二次枝梗数,引起颖花数目的增加,最终增加了每穗粒数,进而提高了产量[28]。运用现代生物技术手段快速创制并聚合这些基因的突变体,将大大加速水稻育种的进程。
本文利用CRISPR-Cas9系统定向创制并获得了水稻品系“17318”OsGW2、OsGN1a基因的突变体,不仅可以为水稻育种储备更多的遗传资源,还可以为加速水稻育种进程提供新的方法和思路。
1 材料与方法
1.1 材料
水稻品系“17318”。
1.2 实验方法
1.2.1 载体构建
以pZHY988质粒作为模板,用引物OsGW2-sgRNA1-P1F(caccggtctcAgtgtGGTGTAAA GACAAAGGgttttagagctagaaata) 和 General-P1R(CGCCAATATATCCTGTCAAA)进行扩增。
以pZHY988质粒作为模板,用引物General-P2F(tttgacaggatatattggcgAGGATccgcGGAT CATG)和 OsGN1a-sgRNA1-P2R(CGATGGTCTC CAAACCCCTG CAGGCGGCCG AGCGACACAC AAGCGACAGC GC)进行扩增。
将上述两个PCR产物回收,等量混合,并以此为模板,用OsGW2-sgRNA1-P1F,OsGN1a-sgRNA1-P2R为引物,做融合PCR。将融合PCR产物直接回收,通过Golden Gate反应与pZHY988进行连接。
连接产物转化大肠杆菌,菌落PCR验证,挑选阳性克隆摇菌,提质粒,测序,最后转化农杆菌。
1.2.2 农杆菌介导的遗传转化
根据文献[30]提供的方法进行。
1.2.3 再生苗转基因阳性检测
水稻苗DNA提取采用CTAB法,利用引物TX067-ZmUbi-F:CATATGCAGCAGCTATATGTG GA;ZY295-Cas9-HP-2:TCTTCTCACCAGGGAGC TGAGCA进行PCR的方法鉴定阳性植株。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃30 s(35 cycles);72 ℃ 5 min;10 ℃ 10 min。
1.2.4 突变体的鉴定
对于OsGN1a基因位点,采用限制性片段长度多态性聚合酶链反应(Polymerase Chain Reaction-Restriction Fragment Length Polymorphism ,PCR-RFLP)技术进行初步鉴定。用引物OsGN1a-PstI-F2:GCCTCCTTCCTCGACGACCT 和OsGN1a-PstI-R3:GGTGAGGTGGAGGTAGTCTGT进行PCR后,取10 μL PCR产物用Pst I酶切,后琼脂糖凝胶电泳检测扩增效果。
对于OsGW2基因位点,采用PCR-SSCP进行突变体的初步筛选,具体方法见文献[31]。首先用引物 OsGW2-SSCP-F1:CTCACACTGCTCAGCC TACAC和OsGW2-SSCP-R1:GTGCTTCTATGACT TTCTGCTCT进行PCR扩增目标片段,然后将PCR产物变性,通过聚丙烯酰胺凝胶电泳进行突变体的初步筛选。对初步筛选的突变体材料OsGN1a、OsGW2基因位点的PCR产物送交擎科生物公司测序验证。
2 结果
2.1 载体构建
经过2次PCR扩增,一次融合PCR,将OsGN1a-gRNA1和OsGW2-gRNA1两个靶位点装载到pZHY988上,构建了载体pZJP049(图1),并通过测序证实载体构建正确。

图1 OsGN1a和OsGW2双位点敲除突变载体示意图
2.2 阳性检测
将构建的载体通过农杆菌介导的水稻遗传转化方法转化水稻愈伤,获得水稻再生苗。随机挑选9株再生苗,采用CTAB法提取水稻基因组DNA,通过PCR扩增的方法进行转基因阳性检测。结果显示9株均能扩出目的条带,说明均为阳性植株,其阳性率为100%。

图2 转基因T0代阳性植株检测电泳图
2.3 突变体的鉴定
选取转基因阳性检测为阳性的单株,首先通过引物OsGN1a-PstI-F2和OsGN1a-PstI-R3从水稻基因组DNA中扩增出包含靶位点的一段序列,扩增片段长度为456 bp。然后将PCR扩增产物通过限制性内切Pst I酶切。最后通过琼脂糖凝胶电泳分离酶切条带,野生型会被切成311 bp和145 bp的两条带。如果阳性植株出现未被切割的抗性带,即为突变植株。结果(图3,图5,表1)显示9株中有7株在OsGN1a基因位点产生抗性带,突变效率为77.7%。

图3 PCR-酶切检测OsGN1a基因位点敲除突变体
同时,对这9株阳性植株引物OsGW2-SSCP-F1和OsGW2-SSCP-R1从水稻基因组DNA中扩增出包含靶位点的一段序列,扩增片段长度为299 bp。然后将PCR扩增产物通过SSCP进行鉴定,如果出现与野生型不同的条带,则为突变体。结果(图4,图5,表1)显示这9株中有9株在OsGW2基因位点与野生型的条带不一致,表明突变效率为100%。
2.4 突变体种子大小
突变T0植株在人工气候室中显示:株型与野生型没有明显差异,分蘖也没有明显差异,双基因聚合突变体(gw2gw2gn1agn1a)的主穗长达30.5 cm,而野生型的主穗长约22 cm。双基因聚合突变体T0植株4-1所结种子在长度和宽度均有明显增加(图6),这与预期结果一致。

图4 PCR-SSCP检测OsGW2基因位点敲除突变体
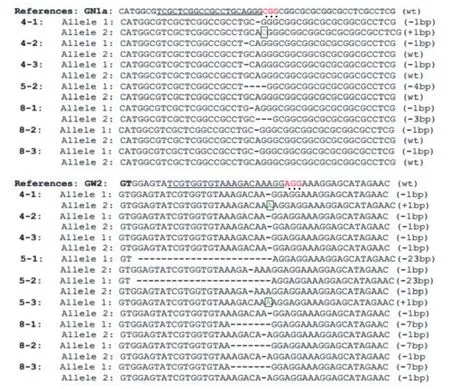
图5 突变体GN1a和GW2基因位点测序比对图

表1 转基因植株突变效率统计表

图6 突变体植株4-1所结种子大小。
3 讨论
自CRISPR/Cas9技术在植物中开始应用以来,针对它的剪切效率报道表明其远远高于ZFNs和TALENs,但却因物种、靶基因、靶位点、脱靶效应、转化方式等因素的影响,Cas9的剪切效率也不尽相同。Li[16]发现Cas9在拟南芥原生质体中的效率为1.1%~5.6%,而在烟草原生质体中效率大大增加,为37.7%~38.5%。Yang等[32]在拟南芥中应用Cas9敲除一个位点的效率为50%~89%,同时敲除2个位点的效率为68%~74%。相反,Cas9在水稻原生质体中的效率为14.5%~38%,而稳定转化的效率却只有7.1%~9.4%[18]。Zhang[33]实验室应用Cas9在水稻中靶向了11个基因,单位点敲除效率为22.1%~66.7%,双位点敲除效率为为5.7%~33.3%。除此之外,Cas9还被应用于其他的模式植物中,在大豆中的剪切效率为70%[34],番茄中的剪切效率为75%[35],玉米中的剪切效率为16.4%~19.1%[36]。从我们的实验结果中可以看出,CRISPR/Cas9在水稻中的工作效率很高,单位点敲除效率在OsGN1a、OsGW2基因位点的突变效率分别为77.7%和100%(表1),而双位点敲除效率为77.7%。
近来,研究者将CRISPR/Cas9系统应用于水稻功能基因的功能研究、性状改良与分子设计育种之中。刘耀光课题组利用CRISPR/Cas9系统研究了水稻雄性不育机制[37],高彩霞课题组利用CRISPR-Cas9系统获得了对草甘膦具有抗性的材料[16],王克剑研究组利用CRISPR/Cas9系统定向改良不同水稻品种的GN1a,DEP1,GS3,IPA1等基因[38-39]。我们利用CRISPR/Cas9系统在水稻品系“17318”中定向、高效创制、并快速聚合GN1a,GW2基因,实现了目标性状的精确改良,为水稻定向育种提供了新的高效方法。
