油橄榄叶提取物对酒精性肝损伤大鼠肝组织转化生长因子-β1水平的影响*
2018-10-18王昱
王 昱
(陇南师范高等专科学校农林技术学院,陇南特色农业生物资源研究开发中心, 甘肃 成县 742500)
长期大量饮酒会导致多系统脏器的损害,肝脏是酒精代谢的主要器官,也是最容易受损的器官.随着我国酒的消耗量增加,临床所见酒精性肝病在逐年增多.研究表明,发生酒精性肝病后,可在短期内发展为不可逆的肝损伤,肝细胞肿大压迫肝血窦造成窦间隙变窄,使肝细胞缺氧,长时间就会导致肝细胞变性和坏死,并促进肝纤维化的发生[1-2].因此,开发并筛选对酒精性肝病有确切防治作用的中药新药并应用于临床,是当前面临的重要课题.多酚、黄酮及橄榄苦苷是油橄榄叶主要活性成分,课题组前期已证实油橄榄叶提取物在排铅、海洛因脱毒、预防糖尿病、抗衰老、减轻缺血再灌注损伤等方面表现出突出的效果[3-12],具有调节肝脏抗氧化能力、抑制脂代谢调控因子(固醇调节元件结合蛋白-1c)表达的作用[13-14].为进一步阐明其作用机制,本研究拟以大鼠为实验动物建立酒精性肝损伤动物模型,探讨OLE对TGF-β1信号通路的影响,以揭示OLE防治酒精性肝损伤的作用机制.
1 材料与方法
1.1 材 料
油橄榄叶提取物(陇南田园油橄榄科技开发有限公司);TGF-β1 ELISA试剂盒(购自上海源叶生物科技公司);兔抗TGF-β1抗体、免疫组织化学试剂盒和DAB(购自武汉博士德生物工程有限公司).
酶联免疫检测仪(ELx800,美国BioTek公司);高速台式冷冻离心机(Beckman美国TGL-16 M)等.50只健康雄性SD大鼠,SPF级,购于兰州大学实验动物中心,许可证号:SCXK(甘)2005-0007,体质量200~250 g.
1.2 方 法
1.2.1动物模型的建立与给药
50只大鼠随机分为5组,即正常组、模型组、OLE低剂量组(Ⅰ)、OLE中剂量组(Ⅱ)和OLE高剂量组(Ⅲ),每组10只.参照文献[15],除正常组外,其他各组采用剂量递增法灌胃乙醇:1—4周5.0 g/kg,5—8周7.0 g/kg,9—12周9.0 g/kg,13—24周9.5 g/kg,每日1次.造模同时,Ⅰ、Ⅱ、Ⅲ治疗组分别用OLE灌胃250 mg/kg、500 mg/kg、1 000 mg/kg,每日1次,连续24周.
1.2.3肝组织TGF-β1蛋白含量测定
取100 mg湿肝,加入1 m L PBS缓冲液,冰浴中匀浆(10 000 r/min)20 s,重复2次,将匀浆液4 ℃(3 600 r/min)离心20 min,取上清液,ELISA试剂盒检测.
1.2.4免疫组织化学
免疫组化SP法(链霉菌抗生物素蛋白-过氧化物酶连结法).末次给药后,取大鼠肝脏数块置于4%多聚甲醛固定,经脱水、石蜡包埋后冠状位切片,厚6 μm.脱蜡、抗原修复后,用3% H2O2室温孵育10 min,正常兔血清室温封闭30 min,然后用兔抗鼠TGF-β1多克隆抗体(1∶200),4 ℃孵育过夜;次日取出切片以PBS冲洗后,再依次滴加生物素化羊抗兔IgG孵育30 min,SABC工作液孵育30 min,最后DAB显色,苏木素复染,阴性对照以PBS代替一抗.常规乙醇脱水、二甲苯透明、中性树胶封片,在显微镜下观察并拍照.
1.2.5图像分析
用美国Image-proplus 5.0 专业图像分析软件进行图像分析.从TGF-β1阳性反应的切片中各选3 张,检测活性物质在肝脏中表达的强度.测量时保证光源的稳定,并且取图之前预热20 min以上,采图时各项设置包括光源、光圈大小、白平衡、曝光强度、敏感度、对比度等均改为手动调节且固定,以保证每次取图系统的设置值一样.取平均光密度和积分光密度两个指标,测量值的平均值为最终灰度值.
1.2.6数据处理

2 结 果
2.1 OLE对肝损伤大鼠肝组织TGF-β1蛋白含量的影响
由图1可知,与正常对照组相比,模型组大鼠肝组织TGF-β1蛋白含量显著增加(P<0.01);与模型组比较,Ⅰ、Ⅱ、Ⅲ治疗组肝组织TGF-β1蛋白含量显著降低(P<0.05,P<0.01).

图1 OLE对大鼠肝组织TGF-β1蛋白含量的影响注:同列数据肩标不同小写字母表示差异显著(P<0.05);肩标不同大写字母表示差异极显著(P<0.01);肩标相同字母或无字母标注表示差异不显著(P>0.05).下同.
2.2 OLE对肝损伤大鼠肝组织TGF-β1表达的影响
免疫组织化学显示:TGF-β1在各实验组大鼠肝脏中都有不同程度的阳性表达,阳性表达部位被染成棕黄色(图2: A-E),阴性对照组无TGF-β1阳性表达(图2: F).与正常组相比,模型组大鼠肝脏TGF-β1的表达水平增强、阳性细胞数增加(P<0.01).各给药组与模型组比较,大鼠肝脏TGF-β1的表达减弱、阳性细胞数减少(P<0.05,P<0.01,图3).
3 讨 论
关于酒精性肝损伤的发病机制,近年来的研究表明,细胞因子、自由基损害、脂代谢调控因子等在酒精性肝损伤发病机制中起重要作用[15].但目前,仍然缺乏有效的治疗手段,采用的治疗药物大都有明显的副作用.本实验的研究对象—油橄榄叶,其主要活性成分是多酚、黄酮及橄榄苦苷,既往已证实油橄榄叶提取物具有良好的防治酒精性肝损伤的药效学效应[13-14].
研究表明,TGF-β1 属于TGF-β 超家族,对细胞的生长、分化和免疫功能都有重要的调节作用,也是目前公认的致纤维化的最强细胞因子[16].酒精致肝损伤时,肝枯否细胞、窦内皮细胞以及坏死的肝细胞等通过自分泌或旁分泌方式产生大量TGF-β1,TGF-β1通过自身调节机制,刺激上述细胞产生更多的TGF-β1,形成级联放大效应,导致大量的TGF-β1生成和激活,与细胞膜上的相应受体结合后,将信号传递到细胞内,从而调节靶基因表达,导致细胞外基质大量积聚,使肝细胞死亡、组织纤维化[17,18].因此,抑制肝组织TGF-β1的表达,是对酒精性肝损伤保护作用的重要环节.本实验结果显示,模型组大鼠肝组织TGF-β1含量均明显升高,提示肝损伤大鼠TGF-β1信号通路明显被激活.OLE干预后,肝组织TGF-β1含量均显著降低,提示OLE对TGF-β1表达具有明显的抑制作用.
综上所述,OLE可通过调节TGF-β1表达水平,缓解酒精性肝损伤的进展.该实验为研发OLE制剂防治肝损伤相关疾病提供了理论与实验依据,但有关其药理作用机制和量效关系等尚需进一步研究.

图2 TGF-β1在大鼠肝脏的表达注:A.正常组, 标尺示100 μm(下同); B.模型组; C.Ⅰ组; D.Ⅱ组; E.Ⅲ组; F.阴性对照
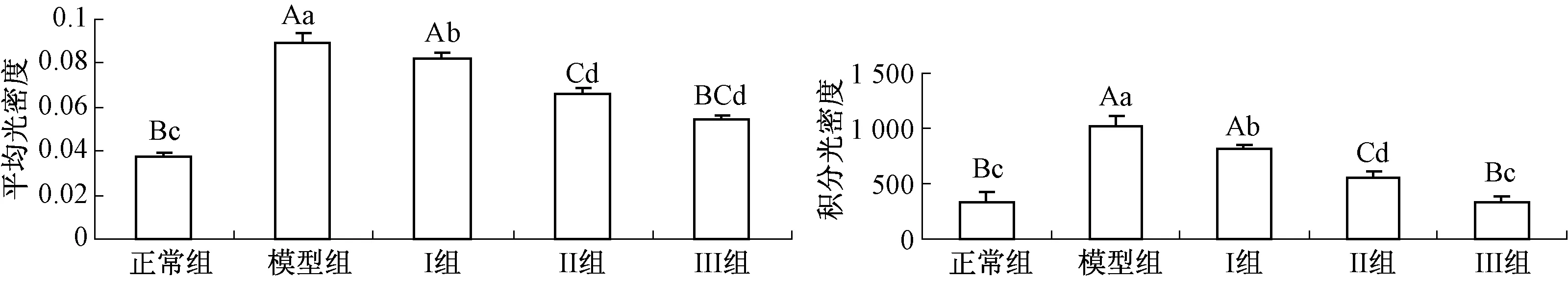
图3 各组大鼠肝脏TGF-β1表达的比较
