氧化石墨烯促进NIH3T3细胞在石墨烯/明胶纳米膜上的增殖与粘附的实验研究*
2018-10-18孙岩峰刘伟沈远杨皛宁朱惠敏马金旭周瑾
孙岩峰,刘伟,沈远,杨皛宁,朱惠敏,马金旭,周瑾△
(1.军事医学科学院 基础医学研究所 前沿交叉学科研究室,北京 100080;2.武警总医院 儿科 临床肿瘤,北京 100080)
1 引 言
近年来,纳米生物材料已广泛用于生物医学研究领域[1-2]。氧化石墨烯(graphene oxide,GO)作为石墨烯的衍生物,在医学相关领域的研究得到高度重视。同时因其表面富含-OH、-COOH、-C=O等大量亲水含氧官能团,因此,具有良好的水溶性及生物相容性[3-4]。
氧化石墨烯在生物应用方面也越来越广泛。新近研究表明,氧化石墨烯可与多种生物分子结合,通过携带小分子药物、基因、抗体、蛋白等,最终实现药物递送[5-7]。其作为组织工程的支架材料等方面同样具有一定优势[8],已有报道证实氧化石墨烯对骨细胞的粘附、分化及增殖有一定的影响[9-11]。且石墨烯作为新的涂层材料可加速人间充质干细胞向成骨的分化[12-13]。然而目前成纤维细胞在氧化石墨烯涂覆基材上的生长、粘附行为的相关研究较为少见。成纤维细胞作为组织工程研究中一种重要的种子细胞,具有较好的增殖、胶原沉积、细胞因子的分泌等能力,一定程度上决定着基质的重塑和组织构架的形成质量。因此,探索该材料对成纤维细胞的生物学行为的影响对未来氧化石墨烯在组织工程修复及重建方面的研究至关重要。
本研究选取氧化石墨烯作为涂层材料,与明胶混合,制备氧化石墨烯/明胶涂覆材料,并将小鼠成纤维细胞系NIH3T3细胞接种在材料上。本研究旨在探索氧化石墨烯对NIH3T3细胞的活性,增殖及粘附等相关特性的影响,为后续纳米材料在组织工程构建方面的生物安全性及生物相容性研究提供参考。
2 材料和方法
2.1 实验细胞系和试剂
小鼠胚胎成纤维细胞系NIH3T3。氧化石墨烯(TIME Nano),高糖DMEM培养液 (HyClone),0.25%胰蛋白酶(含EDTA,HyClone),胎牛血清(fetal bovine serum, FBS,TBD science),Cell Counting Kit-8(CCK-8,日本同仁),细胞活性染色试剂盒 (Invitrogen),反转录试剂盒 (Toyobo),实时定量 PCR 试剂盒 (Toyobo)。
2.2 方法
2.2.1细胞培养 小鼠胚胎成纤维细胞株NIH3T3体外培养于含 10% FBS的高糖DMEM培养液中,隔日换液。细胞培养至90% 融合时,按 1:3比例体外传代培养 (37℃,5% CO2)。
2.2.2氧化石墨烯/明胶膜的制备 称取1 mg氧化石墨烯,加入1 mL明胶(1 mg/mL),制备1 mg/mL浓度的氧化石墨烯明胶溶液。超声使其彻底溶解后滴加到细胞爬片上,置于60℃烘箱中,烘干过夜。培养细胞前置于75%乙醇中浸泡消毒过夜。
2.2.3扫面电镜检测氧化石墨烯/明胶膜的超微结构 将制备的样品用扫描电镜观察细胞在支架上生长的形貌。载物台贴上导电胶后,将制备的明胶涂覆材料、氧化石墨烯/明胶涂覆材料贴附在导电胶上后进行喷金,扫描电镜观察,拍照。
2.2.4细胞活性检测 选取培养了48 h的明胶及氧化石墨烯/明胶膜上NIH3T3细胞,弃去培养基,添加10%CCK-8试剂,并于37℃培养箱中孵育2 h,吸取200 μl孵育液于96孔板中,并利用酶标仪检测450 nm波长下的OD值。
同时,选取在氧化石墨烯/明胶膜上培养48 h的NIH3T3细胞,PBS 冲洗三遍后,根据活 - 死细胞染色 (live/deadstaining) 试剂盒操作说明,分别对活细胞和死细胞染色1 h,荧光焦显微镜(Leica SP8,德国) 观察氧化石墨烯/明胶膜上的细胞活性。
2.2.5细胞增殖能力检测 将细胞接种到单纯明胶组及氧化石墨烯/明胶组涂覆的材料上,分别选取两组中平行的 3 个孔,根据CCK-8试剂操作说明,选取培养第1, 3, 5, 7 d的NIH3T3细胞,分别弃去培养液,添加10% CCK-8试剂并于37℃细胞培养箱中孵育2 h,利用酶标仪检测对应 OD 值,利用Origin 7.0 软件拟合,绘制生长曲线。
2.2.6vimentin免疫荧光染色 选取培养48 h的明胶及氧化石墨烯/明胶膜上的细胞,4%多聚甲醛溶液固定,依次进行脱水,用含0.3% Triton100破膜及用5%山羊血清封闭30 min后加一抗(抗vimentin抗体),一抗按 1:300 稀释,加入500 μL,4℃孵育过夜,随后用 PBS 清洗3遍后加入二抗(山羊抗小鼠)室温放置1.5 h,染色后用 PBS浸洗3次,最后加DAPI染细胞核5 min,用PBS浸洗后,荧光显微镜(Leica SP8,德国 )下观察染色结果。
2.2.7实时定量 RT-PCR 检测粘附相关的基因表达水平 收集实验组及对照组细胞,利用 Trizol 法提取细胞总 RNA,使用RT-PCR kit(Toyobo)将RNA反转录为cDNA,并采用SYBR®Premix Ex TaqTMII Kit(Toyobo)进行实时定量PCR检测。根据NCBI 中cDNA序列,设计引物,以β-actin mRNA作为检测的内参照,序列:β -Actin:上游:5’ -GCTCGTCGTCGACAACGGCTC-3’,下游:5’ -CAAACATGATCTGGGTCATCTTCTT-3’。PCR 反应引物序列如下:α -actin:上游:5’-ATCTGGCACCACACCTTCTA-3’,下游:5’-AGCTCGTAGCTCTTCTCCAG-3’;collagen I:上游:5’-ACTGGTACATCAGCCCGAAC-3’;下游:5’ -GGTGGAGGGAGTTTACACGA-3’;collagenIII:上游: 5’ -GCTGGCATTCCTCAGACTTC-3’ ,下游:5’ - TAGTCTCATTGCCTTGCGTG-3’ ;vinculin :上游:5’ -AGCAGGAGTTGACTCACCAG-3’,下游:5’ -TCTAAGATCTGCCTGATGGC-3’ 。实时荧光定量 PCR 反应体系包括: cDNA 2 μL,引物(1 μmol/L) 2 μL, SYBR green 染料(2×) 10 μL, Nuclease-Free H2O 6 μL,总反应体系为 20 μL。反应条件:95℃ 30 s, 95℃ 3 s,55℃ 30 s,72℃ 30 s,95℃ 1 min,55℃ 30 s,95℃ 30 s,共42个循环。PCR反应的特异性通过产物熔解曲线进行确认,根据 PCR反应曲线得到样品目的基因和β-actin的Ct值。以2-ΔΔCt的值进行相对定量。
2.2.8Western blotting 检测Vimentin表达水平 将培养的细胞消化离心后得细胞沉淀,利用 RIPA 裂解液提取细胞总蛋白,BCA 工作液绘制蛋白标准曲线,并检测样品浓度。利用12% 分离胶SDS-PAGE将对应蛋白转移至NC膜上,脱脂牛奶封闭,一抗 (1:1 000)4 ℃ 孵育过夜,T-TBS 清洗,二抗
(1:3000)室温孵育2 h 后,T-TBS 清洗,滴加发光液,并在暗室利用显影液,定影液进行条带显影。利用 Image J 图像分析软件进行图像灰度扫描测定,得出目的蛋白与内参蛋白 (GAPDH)的灰度比值,即为目的蛋白表达水平的半定量指标。
2.2.9统计学分析 采用SPSS 13.0 软件进行数据的统计分析,且计量资料以 mean±SD 表示,组间比较采用t检验,*P<0.05时认为差异具有统计学意义。
3 结果
3.1 扫描电镜检测材料表面的微观结构
扫描电镜结果显示单纯明胶涂覆材料与氧化石墨烯/明胶材料二者的表面形貌存在较大差异。明胶材料表面光滑,材料表面较为平整,无明显褶皱结构存在,见图1a。而添加氧化石墨烯后,材料表面明显变得粗糙,氧化石墨烯/明胶膜表面起伏不平整,且存在许多凸起与凹陷,具有明显的微米级褶皱结构,但整个表面较为柔和,见图1b。这两种材料表面形貌上的差异很可能是导致细胞生物学行为不同的主要原因。

图1扫面电镜检测材料表面的微观结构
a.单独明胶膜的表面较为光滑;b.氧化石墨烯/明胶膜表面起伏不平,较为粗糙
Fig1Themicrostructureofthematerialwasexaminedbyscanningelectronmicroscopy
a. The microstructure of the gelatin membrane was smooth. b.The microstructure of GO/gelatin membrane was rough
3.2 活性及生长曲线分析
NIH3T3细胞接种到明胶及氧化石墨烯/明胶膜上,Live/Dead Staining结果显示,在培养48 h后,氧化石墨烯/明胶膜上的NIH3T3细胞分布均匀,清晰,绝大部分被染上绿色荧光,细胞活性良好,而被染上红色的死细胞较少,证明该材料的细胞生物相容性较好,见图2a。CCK-8检测细胞活性结果进一步证实,与明胶组相比,接种在氧化石墨烯/明胶膜上NIH3T3细胞活性良好,对细胞没有明显的细胞毒性,见图2b。
生长曲线测定结果显示:随着培养时间的延长,两组材料上测定的细胞吸光度值均增高,间接表明粘附的细胞数逐渐增多。且在培养的第3,5,7 d时,氧化石墨烯/明胶培养组的细胞吸光度值均高于单纯明胶组,细胞呈现明显增殖现象,见图2c。
3.3 材料表面细胞Vimentin基因及蛋白的表达
为了检测NIH3T3细胞在氧化石墨烯/明胶膜上的粘附,利用实时定量RT-PCR检测细胞vimentin的表达,结果显示:与对照组相比,GO/gelatin材料表面的vimentin mRNA的表达显著提高(**P<0.01),见图3a。进一步利用免疫荧光染色检测细胞vimentin的表达,结果显示:在氧化石墨烯/明胶膜的NIH3T3细胞显示出完整的细胞骨架结构,且与单纯明胶组相比,能清晰的观察到细胞伪足延伸,细胞呈梭形,细胞骨架结构更为清晰。而明胶组中的细胞未有明显的细胞骨架延伸,见图3b。同时,我们利用Westernblotting进行了Vimentin蛋白表达的验证,结果显示实验组的Vimentin的表达显著高于对照组,为对照组的1.6倍(*P<0.05),见图3c。
图2 明胶及氧化石墨烯/明胶膜上NIH3T3细胞的活性及增殖能力检测
Fig2TheactivityandproliferationofNIH3T3cellsongelatinandgraphene/gelatinmembranesweredetected
a. Cell viability was observed by live-dead staining; b. Cell viability on cell gelatin and graphene/gelatin membrane was detected by CCK-8; c. Growth curve of the NIF3T3 cells on gelatin and graphene/gelatin membrane was detected by CCK-8 kit
图3 NIH3T3细胞在不同材料上Vimentin的表达水平
Fig3TheexpressionlevelsofVimentinofNIH3T3cellsongelatinandGO/gelatinmembraneswasobserved
a. The expression levels of Vimentin of NIH3T3 cells was detected by RT-QPCR; b. by Western blotting; c. The expression levels of Vimentin of NIH3T3 cells was detected by Immunofluorescence
3.4 细胞粘附相关基因表达
实时定量 RT-PCR 检测结果显示,与单纯明胶培养组相比,加入氧化石墨烯后培养的NIH3T3细胞α-actin、ColⅠ、ColⅢ、及Vinculin mRNA的表达均显著增高,且差异具有统计学意义(*P<0.05),见图4。
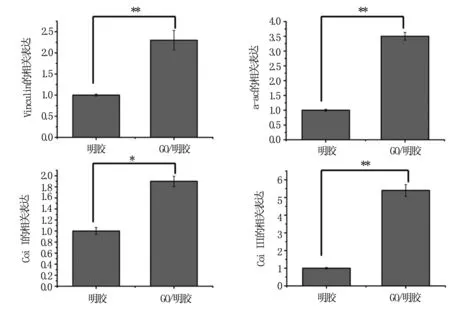
图4不同材料上NIH3T3细胞α-actin、ColⅠ、ColⅢ、及VinculinmRNA表达水平。
Fig4Expressionlevelsofα-actin、ColⅠ、ColⅢandVinculinmRNAofNIH3T3cellsindifferentgroupsdetectedbyrealtimeRT-PCR.Mean±SD,n=3. *P< 0.05; **P<0.01
4 讨论
氧化石墨烯作为新兴的碳纳米材料近年来受到研究者的广泛关注。目前已有大量研究证实石墨烯在药物递送[14]、创伤愈合、组织工程修复[11,15]等研究中应用广泛。然而对氧化石墨烯的生物安全性等方面的研究依然处于起步阶段,尤其在组织工程方面的研究,其作为植入物的表面涂层材料,对其生物相容性及安全性的考察至关重要,还需要研究者进一步探讨。
本研究尝试将小鼠胚胎成纤维细胞系(NIH3T3)接种到氧化石墨烯/明胶膜上,探索氧化石墨烯的生物相容性及对成纤维细胞粘附的影响。结果显示,加入氧化石墨烯后,细胞生长状态良好,无明显毒性。生长曲线测定结果证实在氧化石墨烯/明胶膜上培养的细胞增殖速度明显高于单独明胶培养组。分析原因可能是由于氧化石墨烯/明胶膜大量的凸起与凹陷为成纤维细胞的增殖提供了更多的空间。且这种机械性能较强,导电性能较好的纳米材料会在一定程度上调控细胞周期的改变进而促进细胞的增殖。
利用扫面电镜检测材料表面的微观结构,发现加入氧化石墨烯后材料表面变得粗糙,推测这种氧化石墨烯支架材料表面形成的纳米和微米级的褶皱结构可能会在一定程度上增强细胞与材料的表面接触面积,以及粘附强度的增加。实时定量PCR检测结果进一步证实了氧化石墨烯的掺入的确可以使成纤维细胞分泌更多的胶原,以及增强细胞在材料表面的伸展、粘附。而这种特性更有利于研究者进一步将氧化石墨烯作为植入物的表面涂层材料,推动其在生物医学方面的应用。
本研究通过比较二维明胶膜及氧化石墨烯/明胶薄膜对成纤维细胞增殖和粘附的影响,发现氧化石墨烯/胶原薄膜可以有效的促进细胞增殖、粘附和延伸。进一步证实氧化石墨烯作为植入物的表面涂层材料,具有很高的生物应用潜力,显示出较好的生物相容性。
