与正常人群比较2型糖尿病患者骨转换标志物特点及分析
2018-10-18李伟孔卓王志新王红邓微
李伟 孔卓 王志新 王红 邓微*
1. 北京积水潭医院内分泌科,北京 100035 2. 北京积水潭医院检验科,北京 100035
既往研究对糖尿病能否引起骨质疏松症(osteoporosis,OP)结论并不一致,但近年来许多研究表明,糖尿病患者骨质疏松性骨折的风险明显高于普通人群,认为其是糖尿病在骨骼系统的重要并发症之一,所以将其命名为糖尿病性骨质疏松(diabetic osteoporosis,DOP),但其形成的具体机制尚不清楚[1-3]。既往研究结论并不一致的原因之一是目前临床上缺乏直接测定骨强度的理想方法,采用双能X线吸收法测定的骨密度值(bone mineral density, BMD)是诊断OP、预测骨质疏松骨折风险及评价抗骨质疏松药物疗效的主要指标[3]。然而,BMD主要由骨骼内矿物质成分决定,不能反映骨骼内Ⅰ型胶原等有机成分的变化情况;同时不能反映骨代谢短期内的变化,且对早期骨量减少不够敏感[4]。而骨转换标志物(biochemical bone turnover markers,BTMs)不仅可灵敏地反映骨代谢的动态变化情况,还可用于监测抗OP药物的疗效,逐渐在临床中应用。但文献中针对糖尿病患者BTMs的研究尚不足,结论不一,尚需进一步研究证实。本研究比较2型糖尿病(type 2 diabetes mellitus,T2DM)与非糖尿病人群BTMs变化情况,现报告如下。
1 对象和方法
1.1 研究对象
选取2016年度于北京积水潭医院就诊的2型糖尿病患者(822例,男性410例)为T2DM组;健康人群(821例,男性411例)为对照组。2型糖尿病诊断符合1999年世界卫生组织糖尿病诊断及分型标准;对照组人群行口服糖耐量试验测定空腹及餐后2 h静脉血糖除外糖尿病。T2DM组及对照组排除标准:(1)有糖尿病急性并发症;(2)有甲状腺、垂体等内分泌疾病;(3)有严重心、肺、脑、肝、肾、精神等疾病;(4)有感染及肿瘤情况;(5)近6个月来服用糖皮质激素、维生素D、双膦酸盐等影响骨代谢的药物;(6)其他特殊性骨质疏松,如甲状旁腺功能亢进症、多发性骨髓瘤、遗传性骨病等。
将T2DM组患者按25-羟维生素 D3的水平分为VitD充足、VitD不足和VitD缺乏3个亚组。分层根据《维生素 D 与成年人骨骼健康应用指南 (2014年标准版)》[5]: 即充足: 25OHD≥20 ng/mL; 不足: 25OHD在 12~20 ng/mL; 缺乏: 25OHD<12 ng /mL。
1.2 研究方法
本研究采用病例对照研究的方法,比较T2DM组与对照组患者的骨转换标志物【血钙(serum calcium,Ca),血磷(serum phosphorusserum,P),碱性磷酸酶(alkaline phosphatase,ALP),总Ⅰ型前胶原氨基端延长肽(total procollagen type Ⅰ amino-terminal propeptide,tP1NP),Ⅰ型胶原羧基端肽β特殊序列(βisomer of the C-terminal telopeptide of type I collagen,β-CTX),骨钙素(osteocalcin,OC),25羟维生素D(25 hydroxy vitamin D,25OHD),甲状旁腺素(parathyroid hormone,PTH)】;并分析DM组上述指标与糖代谢指标【糖化血红蛋(glycosylated hemoglobin, HbA1c),空腹血糖(fasting glucose,FPG)】、糖尿病病程、年龄等指标的关系。同时比较分析T2DM患者不同维生素 D水平的3个亚组各参数的差别。
1.3 统计学分析
2 结果
2.1 T2DM组与对照组骨代谢指标及临床资料的比较
两组研究对象Ca、P、ALP及tP1NP差异无统计学意义(P>0.05,见表1、表2);而T2DM组的β-CTX、OC、25OHD水平均低于对照组(P<0.05),PTH水平高于对照组(P<0.05,见表2)。
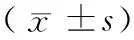
表1 两组研究对象临床资料比较Table 1 Clinical data of the two groups
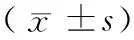
表2 两组研究对象骨转换标志物比较Table 2 Bone turnover markers of the two groups
2.2 T2DM组数据回归分析
对T2DM组研究对象的骨代谢指标进行多因素回归分析显示:OC的主要影响因素有tP1NP、β-CTX、PTH、HbA1c(标准β=0.533、0.256、0.163、-0.127,t=16.417、7.926、6.069、-4.704,P<0.05);25OHD的主要影响因素有Ca、HbA1c、PTH、P(标准β=0.250、-0.149、-0.155、-0.130,t=6.292、-3.783、-3.918、-3.267,P<0.05);β-CTX的主要影响因素有OC、tP1NP、HbA1c、年龄(标准β=0.415、0.215、-0.149、-0.077,t=8.980、4.722、-4.436、-2.353,P<0.05);PTH的主要影响因素有OC、tP1NP、25OHD、Ca、P(标准β=0.418、-0.205、-0.177、-0.083、-0.192,t=7.206、-3.548、-4.285、-3.548、-4.717,P<0.05)。
2.3 T2DM患者不同维生素 D水平亚组数据比较
维生素D(vitamin D,VitD)充足组、VitD不足组的FPG、HbA1c水平均低于VitD缺乏组(P<0.05);VitD充足组的FPG低于VitD不足组(P<0.05),两组HbA1c无明显差异(P>0.05,见表3)。VitD充足组、VitD不足组的Ca水平均高于VitD缺乏组(P<0.05),VitD充足组与VitD不足组的Ca无明显差异(P>0.05,见表3)。VitD充足组、VitD不足组的PTH水平均低于VitD缺乏组(P<0.05);三组间tP1NP、β-CTX、OC无明显差异(P>0.05,见表4)。
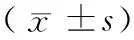
表3 T2DM患者不同维生素 D水平亚组临床资料比较Table 3 Clinical data of the subgroups with different vitamin D levels in T2DM patients
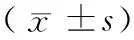
表4 T2DM患者不同维生素 D水平亚组骨转换标志物比较Table 4 Bone turnover markers of the subgroups with different vitamin D levels in T2DM patients
3 讨论
流行病学调查显示,1型糖尿病患者的BMD是减低,其骨量减少和OP的发病率为48%到72%[6]。对于T2DM患者,BMD增高、降低或不变的结果国内外文献均有报道,但近来研究表明骨质疏松性骨折是糖尿病在骨骼系统的并发症之一,但具体机不清楚[1,3,7,8]。本研究发现,T2DM人群的骨转换情况异于正常人群,其中β-CTX、OC、25OHD水平减低,PTH水平升高,而Ca、P、ALP及tP1NP无明显改变。人体骨骼是由无机成分与有机成分共同组成,前者主要为由钙离子与磷酸根离子组成的羟基磷灰石【Ca10(PO4)6(OH)2】,后者主要为Ⅰ型原胶。tP1NP为成骨细胞释放的Ⅰ型原胶原聚合成Ⅰ型胶原过程中的副产物,它的含量在一定程度上反映了骨形成的状态;而β-CTX则是Ⅰ型胶原分解代谢过程中的产物,它的含量在一定程度上反映了骨吸收的状态[9-11]。OC是由成骨细胞分泌,沉积于骨基质中,主要功能是维持骨正常矿化速率,抑制异常的羟基磷灰石晶体的形成;在骨吸收及骨溶解时,沉积在骨基质中的OC就会游离出来,因此OC一方面能反映成骨细胞的活性,但在更大程度上反映的是骨转换的情况[12,13]。ALP广泛存在于多种器官组织,约50%在成骨细胞质膜中,ALP通过水解磷脂释放无机磷,使局部磷浓度增加,促进骨矿化,是目前很常用的评价骨形成的指标[14]。血清Ca及P反映体内钙离子与磷酸根离的情况,一定程度上体现了体内形成羟基磷灰石的能力,二者受PTH及1,25双羟维生素D【1,25-(OH)2VitD】的调节[5,15]。可见T2DM人群其成骨状态较正常人群无明显差异,相对而言,影响骨吸收更显著。这可能是由于长期高血糖使体内产生过多的糖基化终末产物,引起白介素-6(IL6)、肿瘤坏死因子等炎症因子的增多,这些因子可以促进破骨细胞的成熟,导致骨吸收增加[16,17]。此外,胰岛素可以通过成骨细胞表面的胰岛素受体,可直接刺激成骨细胞,细胞内氨基酸蓄积、骨胶原及骨基质的合成分泌,而T2DM患者存在胰岛素分泌相对不足,使成骨细胞数目减少,成骨细胞合成和分泌骨钙素减少,使骨转换率下降;同时,胰岛素可抑制高血糖对骨髓间质干细胞的毒性作用,当胰岛素分泌减少、血糖升高时,其毒性作用明显增强,由于成骨细胞与骨髓脂肪细胞均来源于骨髓间充质干细胞,两者存在负相关的平衡关系,骨髓脂肪细胞的增加会通过复杂的信号通路网(PPARγ、Wnt、TGF-β、OPG/RANKL等)抑制骨髓间充质干细胞向成骨细胞的转化,导致骨转换率下降[18-20]。当T2DM患者血糖超过肾糖阈时,过多的葡萄糖从尿中排出,引起渗透性利尿,使钙、磷排泄增加,并阻碍肾小管对钙、磷的重吸收,使血钙浓度降低,刺激PTH分泌,骨钙动员,溶骨作用加强,代偿性维持血钙、磷处于正常水平[21]。
1,25-(OH)2VitD 是由 25OHD 通过肝细胞线粒体 25-羟化酶及肾近端小管上皮细胞线粒体 1α-羟化酶两步转化而来,两者在体内维持着平衡。血循环中的1,25-(OH)2VitD被维生素D结合蛋白运输到肠道、肾脏和骨骼,与这些组织细胞内的维生素D受体结合; 促进肠道对钙磷的吸收,促进肾小管内钙磷的重吸收,刺激成骨细胞,从而有利于骨骼矿化。此外, 1,25-(OH)2VitD 还抑制PTH的合成,并通过成骨细胞间接作用于破骨细胞,从而影响骨形成和骨吸收,维持骨组织与血液循环中钙、 磷的平衡。而25OHD被认为是最好的反映体内总维生素D 储存状态的指标[5]。本研究显示糖尿病患者群25OHD水平减低,这与既往大量研究结果相符,考虑可能与糖尿病患者群室外活动减少、血糖代谢紊乱和饮食控制影响维生素D的吸收等因素相关;另外,也有研究显示维生素D缺乏本身就是糖尿病的易患因素[22,23]。本研究回归分析显示,25OHD水平明显受到糖化血红蛋白的负相关影响,同时按照25OHD水平进行分层的T2DM亚组分析亦显示VitD充足组、VitD不足组的血糖控制情况优于VitD缺乏组,以上均提示T2DM患者25OHD水平受到了长期血糖水平的影响。而25OHD水平的减低会引起1,25-(OH)2VitD 的下降,而后者的缺少则会肠道吸收Ca、P的减少,引起继发性PTH升高及OP。此外,有一些理论认为,T2DM患者的骨代谢异常是由于维生素D减少所引起,但本研究亚组分析显示,不同25OHD水平的T2DM患者β-CTX及OC无显著性差异,提示T2DM人群的β-CTX及OC变化可能独立于25OHD水平变化,回归分析显示二者受到血糖控制水平的影响[24,25]。
2型糖尿病患者较正常人群β-CTX、OC、25OHD减低,PTH升高;其改变独立于25OHD的变化;受到血糖代谢的影响。比较遗憾的是由于经费限制,本研究中的研究对象未行骨密度检查,无法进一步明确上述改变是否对2型糖尿病患者骨密度有直接影响。
