基于多肽均相裂解电化学发光法检测前列腺特异性抗原
2018-10-16李哲建樊雪梅王书民曹宝月周春生
李哲建,张 静,樊雪梅,王书民,曹宝月,周春生
(1.商洛学院 化学工程与现代材料学院,陕西 商洛 726000;2.西北化工研究院,陕西 西安 710062)
前列腺特异性抗原(PSA)是一种在正常的前列腺细胞和前列腺癌细胞中分泌的蛋白酶,是诊断前列腺癌和乳腺癌的最广泛使用的蛋白之一[1-2]。检测PSA的方法有酶联免疫吸附实验[3]、比色免疫分析法[4]、荧光免疫分析法[5]、表面增强拉曼散射免疫分析法[6]、电化学免疫分析法[7]、化学发光法[8]及电化学发光分析法[9]。上述方法大多基于抗原与抗体之间的免疫反应,能够高灵敏和选择性地检测PSA,但存在检测步骤复杂、成本高、耗时较长,稳定性差,抗原结合活性位点暴露,以及蛋白质抗体易变性等问题。在酶联免疫吸附实验中,必须使用夹心法测量疾病标志物的浓度,所以在每个特定位点应至少结合两个抗体,而重复洗涤步骤可能使抗体流失并降低检测效率。因此,寻找新的识别分子,开发更稳定、更快速和更简单的检测PSA的生物传感系统很有必要。
多肽作为抗体的替代物,具有易合成、成本低、稳定、不易失活、适于极端条件以及无毒副作用等优点[10-11]。近年来,已有利用蛋白酶催化裂解某种序列特异性多肽的传感器报道。Zhao等[12]建立了检测PSA的电化学方法,利用二茂铁标记的螺旋肽作为分子识别物质,通过检测PSA酶切掉二茂铁的电化学信号来测定PSA。Wang等[13]利用基质金属蛋白酶2(MMP-2)的酶催化切割多肽反应构建了检测MMP-2的荧光生物传感器,检出限达32 pmol/L。进一步研制具有高选择性和高灵敏度的新型蛋白酶检测方法对于蛋白酶相关疾病的诊断和治疗药物的开发具有重要意义。
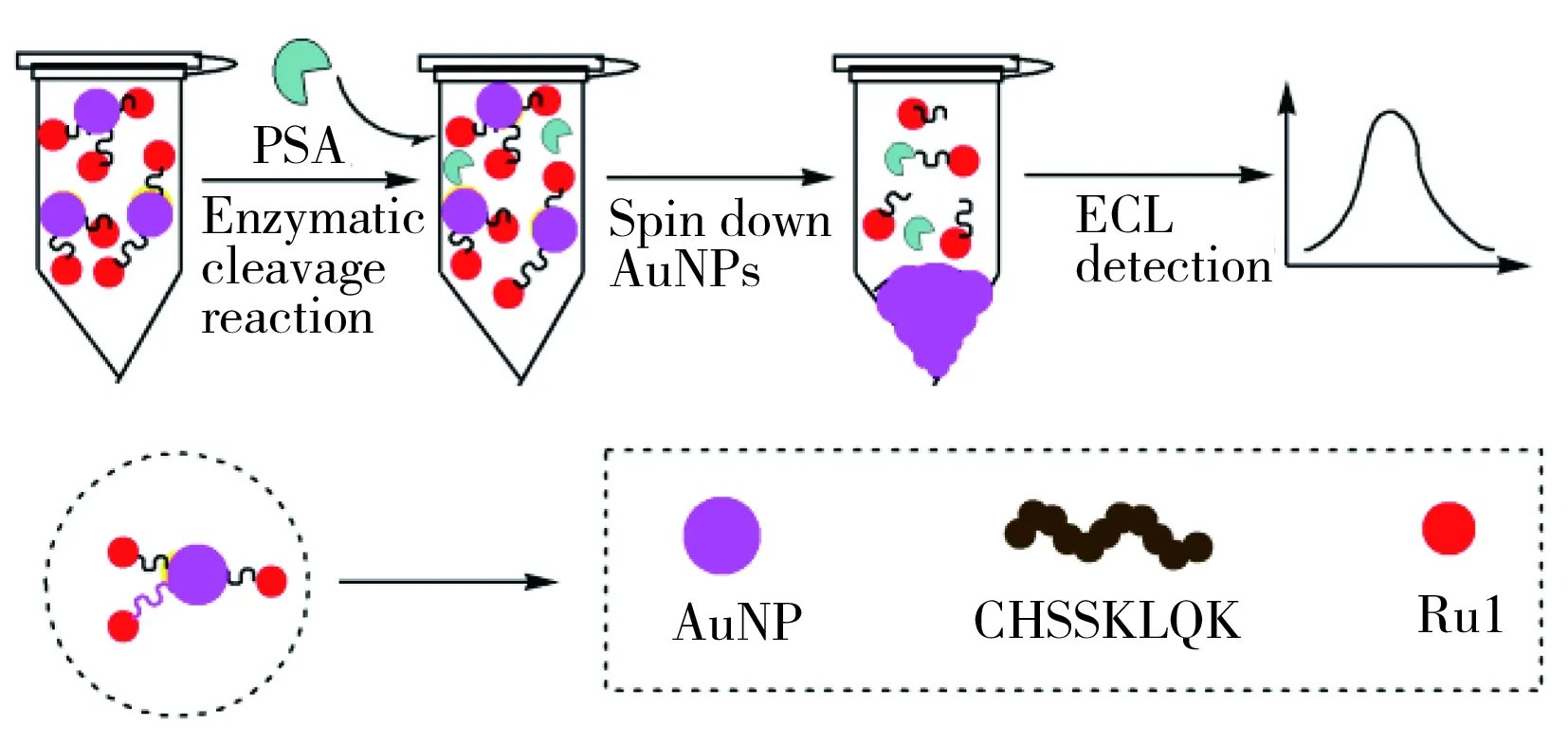
图1 电化学发光生物传感器测定PSA的原理图Fig.1 Principle scheme of the fabrication of ECL biosensors
电化学发光法(ECL)是化学发光和电化学相结合的产物,具有仪器简单、分析灵敏度高、易控制和检测速度快等优点[14]。基于酶催化切割探针生物分析系统并利用金纳米粒子(AuNPs)离心分离的均相检测PSA的电化学发光分析法尚未见报道。在文献[12,15]基础上,本文设计了一个基于生物切割电化学发光多肽探针与AuNPs离心分离的均相检测PSA的电化学发光生物传感器(如图1)。以多肽(CHSSKLQK)为分子识别物质,钌联吡啶衍生物(Ru1)为信号物质,AuNPs为载体,建立了多肽纳米金粒子电化学发光法检测PSA的新方法。钌联吡啶衍生物通过酰胺化反应标记在肽的K端作为电化学发光探针(peptide-Ru1);电化学发光探针利用末端C上的巯基自组装在AuNPs上,构成AuNPs电化学发光探针,由于PSA能特异性催化裂解该肽,使信号物质从AuNPs上脱离;离心分离后,通过对溶液中的信号物质进行电化学发光检测,可实现对目标物PSA的高灵敏检测。本文对ECL生物传感器性能进行了研究,并对实验条件进行了优化。
1 实验部分
1.1 试剂与仪器
钌联吡啶衍生物[Ru(bpy)2(mcbpy-O-Su-ester)(PF6)2,缩写为Ru1]、前列腺特异性抗原(PSA)、氯金酸、柠檬酸钠均购自Sigma公司。多肽(氨基酸序列:CHSSKLQK,MW=929.48),纯度大于95%,购自上海楚肽生物科技有限公司。凝血酶购自北京鼎国昌盛生物技术有限公司。牛血清白蛋白、胰蛋白酶,购自西安沃尔森生物科技有限公司。三正丙胺(TPA)购于国药集团化学试剂公司。所有试剂均为分析纯,实验用水为二次去离子水。
电化学发光测量在MPI-E型电化学发光仪(西安瑞迈电子公司)上进行。三电极体系:以裸玻碳电极作为工作电极,铂丝电极作为对电极,Ag/AgCl(饱和氯化钾)作为参比电极。用UV-2450紫外可见分光光度计(日本Shimadzu 公司)记录紫外可见光吸收光谱图。JEM-2100透射电子显微镜(TEM,日本JEOL公司)。
1.2 AuNPs的合成
参考文献[9]合成AuNPs。将100 mL 0.01%的氯金酸溶液加热搅拌,沸腾后迅速加入4 mL 1%的柠檬酸三钠溶液,溶液颜色由淡黄色变为紫红色,最终变为金纳米特有的红色,继续加热和搅拌约15 min,直至溶液颜色变为透明的橙红色后,停止加热,在室温下冷却后,将该溶液装入棕色瓶置于4 ℃保存备用。
1.3 AuNPs复合物的合成
取0.4 mg多肽(CHSSKLQK,0.000 43 mmol)溶于1 mL 10 mmol/L 磷酸缓冲液(PBS,pH 7.4)中,加入200 μL 5 mg/mL纳米金混合后,置于恒温摇床上缓慢振荡反应4 h,使肽的末端C通过金硫键结合到金纳米粒子表面。待反应完全后,用10 mmol/L的PBS清洗未反应的肽,离心分离完全后,将得到的AuNPs-peptide悬浮于1 mL 10 mmol/L PBS 中,将150 mL 3.5 mg/100 μL Ru1的N,N-二甲基甲酰胺(DMF)溶液,加至搅拌的1 mL 0.25 mg/mL寡肽溶液中,室温、避光下置于恒温摇床上反应12 h。Ru1 通过酰化反应共价结合到肽的另一端K端。同理,用10 mmol/L PBS清洗未反应的Ru1,通过离心分离器进行分离。将得到的AuNPs-peptide-Ru1重新悬浮于0.1% BSA中,37 ℃条件下反应2 h以对AuNPs表面未共价多肽的活性位点进行封闭。对反应得到的AuNPs电化学发光探针(AuNPs-peptide-Ru1)进行冲洗,离心分离后,将探针加至600 μL 10 mmol/L的 PBS缓冲液中在2~8 ℃下保存备用。在参与反应的AuNPs不损失的前提下,根据AuNPs的加入量,计算得电化学发光探针的质量浓度为1.6 mg/mL。
1.4 PSA的电化学发光检测
取10 μL金纳米粒子电化学发光探针(1.6 mg/mL)加至90 μL不同浓度的PSA溶液或血清溶液中,在30 ℃下反应40 min,将反应后的混合液离心分离5 min。切割的电化学发光信号物质在共反应剂TPA存在下进行电化学发光均相检测。取100 μL 100 mmol/L的 TPA(含0.10 mol/L PBS)溶液,与100 μL的 AuNPs-peptide-Ru1反应后的清液混合后,将裸玻碳电极浸入混合液中,以扫速50 mV/s进行电化学发光检测。根据电化学发光强度的变化(ΔI=Is-I0)定量检测PSA,其中I0为空白信号值,Is为电化学发光探针与PSA反应后的信号值。
2 结果与讨论
2.1 AuNPs的TEM分析
将AuNPs胶体溶液超声分散5 min后,再滴在碳膜覆盖的铜网上,待溶液挥发至干,然后在操作电压200 kV时采用透射电子显微镜(TEM)进行观察。实验结果显示合成的AuNPs为纳米级,形状为圆球状,表面较光滑,平均粒径约为10 nm。
2.2 AuNPs-peptide-Ru1的电化学发光性能
利用电化学线性扫描技术对AuNPs-peptide-Ru1和Ru1的电化学发光性能进行研究(图2)。由图2可知,AuNPs-peptide-Ru1和Ru1均产生较强的电化学发光信号,其发光峰电位分别为+1.21 V和+1.18 V,发生了微弱的偏移。表明两者的电化学发光行为相似,所制备的AuNPs-peptide-Ru1达到了预期性能,可用作电化学发光探针。
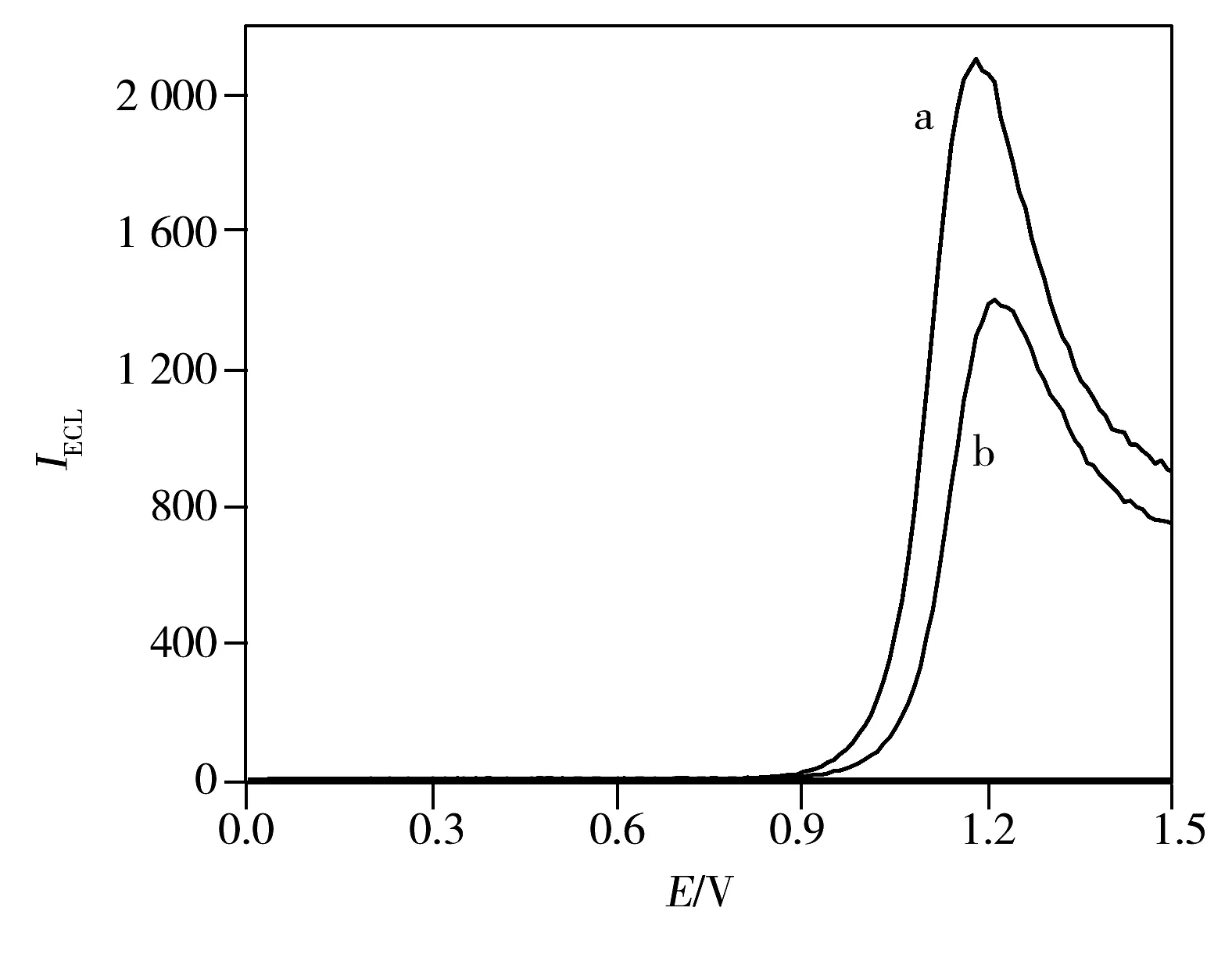
图2 Ru1(a)和AuNPs-peptide-Ru1(b)的电化学发光曲线Fig.2 ECL intensity-potential profiles of Ru1(a)and AuNPs-peptide-Ru1(b)concentration of Ru1 and AuNPs-peptide-Ru1 were 1.5×10-7 mol/L and 1.6 mg/mL,respectively;buffer:10 mmol/L PBS(pH 7.4)containing 0.10 mol/L TPA;scan rate:100 mV/s
2.3 实验条件的优化
考察了PSA与AuNPs-peptide-Ru1的反应时间对电化学发光强度变化值ΔI的影响。结果显示,当反应时间由5 min增至20 min时,ΔI值急剧增加。反应时间在20~40 min范围内,ΔI值增加缓慢,40 min后ΔI达到最大且保持平稳。表明40 min足以使该体系达到平衡。因此,本实验的PSA识别裂解AuNPs-peptide-Ru1的反应时间为40 min。
由于PSA是具有生物活性的丝氨酸蛋白酶,切割温度的大小会影响其生物活性,因此实验考察了反应温度对电化学发光强度变化值ΔI的影响。结果表明,反应温度由5 ℃增至20 ℃时,ΔI值急剧增加;在20~30 ℃范围内,ΔI值增加缓慢,30 ℃时ΔI值达到最大。当温度高于35 ℃时,ΔI值反而降低,表明温度高于35 ℃时PSA的生物活性受到破坏。因此,选择本实验的反应温度为30 ℃。
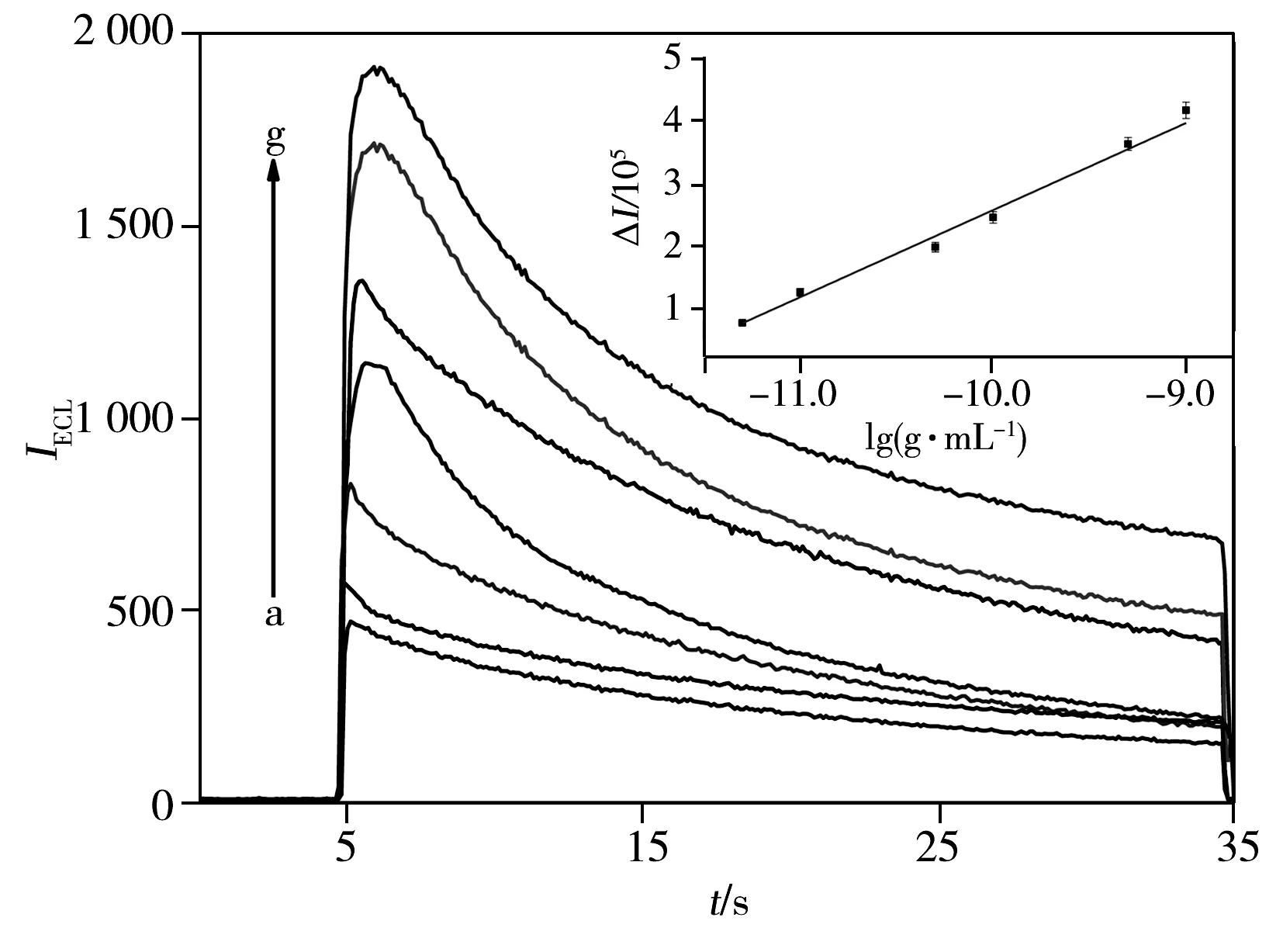
图3 AuNPs-peptide-Ru1与不同浓度PSA反应的电化学发光强度曲线Fig.3 ECL intensities vs potential profiles of AuNPs-peptide-Ru1 after reaction with different concentrations of PSA in 0.10 mol/L PBS(pH 7.4)containing 50 mmol/L TPAconcentration of PSA(a-g):0,5.0,10,50,100,500,1 000 pg/mL;insert:calibration curve of PSA
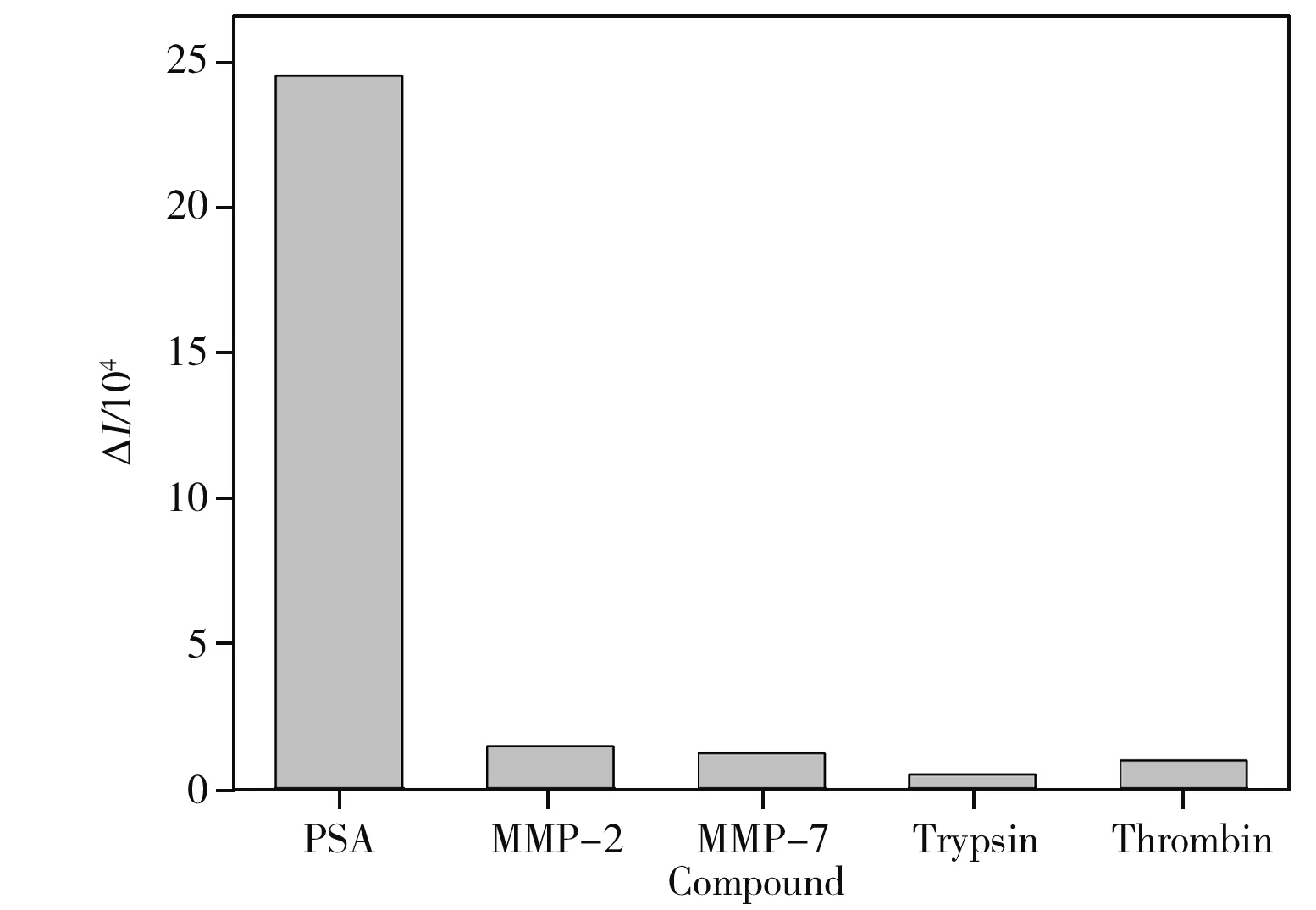
图4 传感器的选择性Fig.4 Selectivity of the biosensor 1.0×10-10 g/mL PSA and 1.0 ng/mL other proteases (MMP-2,MMP-7,trypsin and thrombin)
2.4 传感器的分析性能
在优化条件下,考察了AuNPs-peptide-Ru1对不同浓度PSA的检测性能。图3为AuNPs-peptide-Ru1与不同浓度PSA反应前后的溶液在裸玻碳电极上恒电位积分30 s后的电化学发光强度曲线。由图可知,电化学发光强度随PSA浓度的增大而增强,且ΔI值与PSA质量浓度在5.0×10-12~1.0×10-9g/mL范围内呈良好的线性关系,回归方程为ΔI=1.635×106+1.377×105lgc(g/mL),相关系数r=0.992 3,检出限(S/N=3)为2.0×10-12g/mL。该检出限低于文献[16-17]报道的检出限(10 ng/mL和38 pg/mL)。用PSA作为标志物诊断前列腺癌的临界值(大于该值为异常值)为4.0 ng/mL(更多的接近2.5 ng/mL),这说明该分析方法有望用于早期前列腺癌的诊断。
2.5 传感器的选择性
PSA和凝血酶、胰蛋白酶、MMP-2、MMP-7均属于蛋白酶,因此将它们作为干扰物对传感器的特异性进行了考察。相同实验条件下,该传感器对1.0×10-10g/mL PSA和1.0 ng/mL的其它蛋白酶的电化学发光响应见图4。由图4可知,相对于其他蛋白酶,该传感器检测PSA的响应信号最高。说明PSA能够特异性地切割选用特定序列的多肽CHSSKLQK,所构建的传感方法具有良好的选择性。

表1 血样中PSA的分析结果Table 1 Analytical results of PSA in clinical serum samples
*the CL results provided by Xi'an Friendship Medical Inspection(数据来源于西安市友谊医学检验所)
2.6 实际样品分析
为评估该传感分析方法的应用潜能,从西安市友谊医学检验所采集6份患者的血样。采集的血样经离心后取上清液,用10 mmol/L的PBS进行稀释。用本文设计合成的AuNPs-peptide-Ru1测定血样中PSA的浓度,同时与临床采用的化学发光免疫分析法(CL)测定结果进行对比。由表1可知,本文构建的生物传感分析方法的测定结果与临床CL法结果一致,表明本文建立的基于酶切割多肽的电化学发光传感器准确性良好,具有一定的应用价值。
3 结 论
本文建立了一种基于酶切割多肽探针和AuNPs离心分离均相检测PSA的电化学发光分析新方法。该法通过在AuNPs界面上酶催化切割多肽反应与电子传导实现了PSA的高灵敏检测,减少了复杂的电极修饰过程并克服了生物传感器重现性差的缺点。而且,通过简单的固液分离合成AuNPs电化学发光探针,为金纳米探针的合成提供了参考。该法相比于传统的免疫分析方法更简单、成本更低,改进后可用于检测其他具有酶切割活性的蛋白质。
