紫苏不同部位乙醇提取物对苹果树腐烂病的影响及机制
2018-10-16刘芳洁
刘芳洁
(晋中职业技术学院,山西晋中 030600
苹果(Malusdomestica)属蔷薇科苹果属多年生植物,富含人体所需的矿物质及维生素,深受人们欢迎,已成为世界四大水果之一[1]。苹果树腐烂病(ValsamaliMiyabe et Yamada)别称臭皮病、烂皮病,是一类由黑腐皮壳属真菌引起的真菌型病害,具有发生普遍、危害严重及难治愈等特点,是影响苹果产量和品质的重要限制因素[2-3]。苹果园一旦发生腐烂病,轻者造成苹果减产,重者果树大量死亡甚至毁园,会给果农造成严重的经济损失,已成为威胁我国苹果产业发展的重要病害[4]。目前,在生产上常用化学药剂进行苹果树腐烂病的田间防治,常用药剂主要有多菌灵药泥[5]、戊唑醇[6]、氟硅唑[7]及甲硫·萘乙酸[8]等,均取得了不错的防治效果。但是,由于化学药剂的大量、长期使用不仅对人体健康造成了严重威胁,而且常造成环境污染和病原菌的抗药性,因此,开发环境友好型生物制剂来高效防治苹果树腐烂病已成为当前苹果生产中亟须解决的关键问题[9]。
紫苏(PerillafrutescensL.)别称赤苏、白苏,属一年生唇形科紫苏属草本植物,在我国常作为药食兼用作物进行栽培[10]。大量研究表明,紫苏富含黄酮类、苷类、萜类及挥发油类等成分,具有抑菌、抗氧化、降脂降糖等生物活性[11-12]。程道梅等研究表明,紫苏乙醇提取物具有较广的抑菌谱,能够较好地抑制食品中常见的细菌、霉菌及酵母菌,是一种较好的生物抑菌剂[13];郝佳等研究表明,紫苏叶乙醇提取物对金黄色葡萄球菌具有较强的抑制能力,可作为抗菌药物进行开发利用[14];段江莲等研究表明,紫苏叶部位的多酚及黄酮含量显著高于其他部位,叶部位甲醇提取物可明显抑制敏感菌株大肠杆菌的生长,是一种优良的天然防腐剂和抗氧化剂[15];魏雯等研究表明,紫苏叶、籽皮水浸液对大肠埃希菌、枯草芽孢杆菌、八叠球菌及金黄色葡萄球菌具有明显的抑制作用,其中,对枯草芽孢杆菌的抑菌作用最强[16]。然而,关于紫苏乙醇提取物对植物病原菌抑制及提供植物抗病性方面的研究尚未见相关报道。因此,本研究以富士幼树为对象,分析紫苏不同部位乙醇提取物对苹果树腐烂病的影响,并对其机制进行了初步研究,以期为苹果树腐烂病的生物防治及紫苏资源开发利用提供理论依据。
1 材料与方法
1.1 试验材料
供试苹果树品种为富士幼树,购自山西省晋中市种苗站;供试紫苏品种为奇苏1号,由笔者所在课题组自主种植;供试苹果树腐烂病病原菌由笔者所在课题组自主分离保存,经鉴定为黑腐皮壳属(Valsamali)真菌。
1.2 试验方法
1.2.1 试验设计 试验于2017年4月在晋中职业技术学院实验室开始实施,紫苏茎、叶、花及籽部位的乙醇提取物及腐烂病病原菌抑制试验参照程道梅等[13]方法进行;将抑菌效应最佳的紫苏叶片乙醇提取物浓度分别设置为0.2、0.4、0.6、0.8、1.0 g/mL进行最低抑菌浓度(MIC)试验,具体参照任艳芳等的方法[17]进行。选取长势一致的富士苹果幼苗120株,分别定植于50 cm×55 cm的陶盆中,盆栽基质为改良的土壤基质,每盆定植1株,正常水肥管理;田间预防试验分别用浓度为0.2、0.4、0.6、0.8、1.0 g/mL的紫苏叶片乙醇提取物进行枝条涂抹,25 mL/株,重复3次,每次间隔3 d,对照为同体积的蒸馏水涂抹;第3次涂抹完成后3 d,在树皮上接种腐烂病菌,接种量为2.0×106CFU/g,每个处理重复10株,共60株,随机排列。田间治疗试验首先进行病原菌接种,具体方法与预防试验一致。接菌后3 d分别用浓度为0.2、0.4、0.6、0.8、1.0 g/mL的紫苏叶片乙醇提取物进行枝条涂抹,具体方法与预防试验完全一致。选取预防试验中的各处理植株进行生理及分子指标测定,每个处理重复3次。
1.2.2 生理指标及测定方法 采用任艳芳等[17]的方法进行病原菌抑制率测定。抑制率(I)计算公式为I=(DO-DL)/DL×100%,式中DO表示对照菌落直径;DL表示处理菌落直径。自接种腐烂病病原菌5 d后起开始调查,每隔5 d调查1次,按赵仕光等方法[18]进行病情指数、发病率及防治效果计算;过氧化物酶(POD)活性测定采用愈创木酚法,多酚氧化酶(PPO)活性测定参照赵仕光等的方法[18]进行,苯丙氨酸解氨酶(PAL)活性采用苯丙氨酸比色法进行测定,β-1,3-葡聚糖酶(GLU)活性参照汤章城等的方法[19]进行测定;丙二醛(MDA)含量采用硫代巴比妥酸比色法进行测定;脯氨酸(Pro)含量采用磺基水杨酸提取法进行测定。
1.2.3 病程相关蛋白基因PR5和PR8表达量测定方法 苹果树树皮总RNA提取按照柱式植物总RNA提取试剂盒方法进行;RNA提取质量用琼脂糖凝胶电泳进行检测,浓度定量用核酸分析仪进行;以提取的苹果树树皮总RNA为模板,运用反转录试剂盒将其反转录为cDNA;实时荧光定量PCR反应体系为2 μL cDNA、10 μL SYB Premix ExTaq(Tli NaseH Plus)、0.2 μmol/L上下游引物各0.4 μL、ROX Reference Dye II 0.4 μL、灭菌蒸馏水6.8 μL,在Light Cycler®480II PCR仪上进行扩增。反应程序为95 ℃预变性30 s;95 ℃变性10 s,58 ℃退火40 s,72 ℃延伸30 s,25个循环。采用2-ΔCT法计算基因相对表达量,每个处理重复3次。病程相关蛋白基因PR5、PR8及内参基因EF1α的引物序列参照Liu等的报道进行合成[20],具体序列见表1。

表1 病程相关蛋白基因与内参基因的引物序列
1.3 数据分析
采用Excel 2010软件进行试验数据整理、计算及作图,差异显著性分析采用SPSS 18.0进行。
2 结果与分析
2.1 紫苏不同部位乙醇提取物对苹果树腐烂病病菌的抑菌效果
如图1-A所示,在0.1 g/mL紫苏茎、叶、花、籽4个不同部位乙醇提取物的处理下,苹果树腐烂病病菌的抑制率分别为51.17%、74.16%、65.51%、55.06%,其中叶部位抑制率较花部位达到显著差异水平(P<0.05),较茎、籽部位均达到极显著差异水平(P<0.01)。这说明,紫苏乙醇提取物对苹果树腐烂病病菌的生长存在明显抑制,且不同部位抑制率存在显著差异,紫苏叶部位抑制率最强。不同浓度紫苏叶部位乙醇提取物对苹果树腐烂病病菌的抑制率如图1-B所示,随着紫苏叶部位乙醇提取物浓度的升高,苹果树腐烂病病菌的抑制率呈先上升后趋于平稳的趋势。紫苏叶部位乙醇提取物对苹果树腐烂病病菌的最小抑菌质量浓度为0.8 g/mL,抑制率较质量浓度为0、0.2、0.4、0.6 g/mL紫苏叶片乙醇提取物处理分别提升81.38%、26.09%、15.55%、5.19%,较 0.6 g/mL 紫苏叶片乙醇提取物处理达到显著差异水平(P<0.05),较0、0.2、0.4 g/mL处理均达到极显著差异水平(P<0.01)。这说明,不同浓度的紫苏叶部位乙醇提取物对苹果树腐烂病病菌的抑制率存在显著差异,其中以0.8 g/mL的紫苏叶片乙醇提取物处理抑菌效果最佳。
2.2 紫苏叶片乙醇提取物对苹果树腐烂病发病率、病情指数及防治效果的影响
由表2可知,在预防处理与治疗处理中,不同浓度紫苏叶片乙醇提取物处理均可显著降低苹果树幼苗腐烂病的病情指数和发病率(P<0.05),防治效果显著提高(P<0.05)。在预防处理与治疗处理中均以质量浓度为0.8 g/mL处理的紫苏叶片乙醇提取物处理效果最佳,较0、0.2、0.4、0.6 g/mL预防处理的发病率分别降低 74.81%、33.26%、19.87%、9.33%,较0、0.2、0.4、0.6 g/mL预防处理的防治效果分别提升81.15%、46.27%、23.58%、9.89%,较0.6 g/mL预防处理达到显著差异水平(P<0.05),较0、0.2、0.4 g/mL预防处理均达到极显著差异水平(P<0.01);较0、0.2、0.4、0.6 g/mL治疗处理的发病率分别降低62.56%、31.93%、16.82%、5.27%,较0、0.2、0.4、0.6 g/mL治疗处理的防治效果分别提升76.26%、48.21%、26.88%和10.37%,较0.6 g/mL治疗处理达到显著差异水平(P<0.05),较0、0.2、0.4 g/mL 治疗处理均达到极显著差异水平(P<0.01)。这说明,紫苏叶片乙醇提取物处理均可显著降低苹果树幼苗腐烂病的发病率(P<0.05),显著提升防治效果(P<0.05),且以0.8 g/mL处理效果最佳,其原因可能是由于0.8 g/mL处理紫苏叶部位乙醇提取物对苹果树腐烂病病菌的抑菌效果最佳所致。


表2 紫苏叶片乙醇提取物对苹果树腐烂病的影响
注:表中同列数据后不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
2.3 紫苏叶片乙醇提取物对苹果树树皮防御酶活性的影响
紫苏叶片乙醇提取物对苹果树树皮防御酶活性的影响如图2所示,随着紫苏叶片乙醇提取物浓度的升高,苹果树树皮的POD、PPO、PAL及GLU活性均呈先上升后趋于平稳的趋势;随着处理时间的延长,苹果树树皮的POD、PPO、PAL及GLU活性均呈先上升后急剧下降的趋势。不同浓度紫苏叶片乙醇提取物处理均可显著提升苹果树树皮的POD、PPO、PAL及GLU活性,且以0.8 g/mL处理提升幅度最大。在接种后20 d,各处理的POD、PPO、PAL及GLU活性均达到最高,质量浓度为0.2、0.4、0.6、0.8、1.0 g/mL处理的紫苏叶片乙醇提取物处理的苹果树树皮POD活性分别是对照的1.88、2.02、2.14、2.41、2.39倍,PPO活性分别是对照的1.20、1.31、1.46、1.64、1.63倍,PAL活性分别是对照的1.67、1.92、2.12、2.31、2.31倍,GLU活性分别是对照的1.36、1.54、1.84、2.29、2.29倍,其中0.8 g/mL处理紫苏叶片乙醇提取物处理的POD、PPO、PAL及GLU活性较0.6 g/mL处理达到差异显著水平(P<0.05),较CK、0.2、0.4 g/mL处理均达到极显著差异水平(P<0.01)。这说明,紫苏叶片乙醇提取物处理可提升苹果树树皮的防御酶活性,且以质量浓度为 0.8 g/mL 处理提升幅度最大。

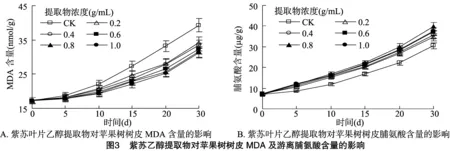
2.4 紫苏叶片乙醇提取物对苹果树树皮丙二醛及游离脯氨酸含量的影响
如图3-A所示,随着紫苏叶片乙醇提取物浓度的升高,苹果树树皮的MDA含量呈逐渐降低的趋势;随着处理时间的延长,苹果树树皮的MDA含量呈逐渐上升的趋势。不同浓度紫苏叶片乙醇提取物处理均可显著降低苹果树树皮的MDA含量,且以1.0 g/mL处理降低幅度最大。在接种后 30 d,各处理的MDA含量均达到最高,质量浓度为0.2、0.4、0.6、0.8及1.0 g/mL的紫苏叶片乙醇提取物处理的苹果树树皮MDA含量分别较对照降低13.02%、15.03%、17.45%、19.64%和20.48%,其中1.0 g/mL的处理较 0.6 g/mL 处理达到差异显著水平(P<0.05),较0.2、0.4 g/mL 及CK处理均达到极显著差异水平(P<0.01)。这说明,紫苏叶片乙醇提取物处理可明显降低苹果树树皮的MDA含量,且以质量浓度为1.0 g/mL处理时降低幅度最大。
紫苏叶片乙醇提取物对苹果树树皮游离脯氨酸含量的影响如图3-B所示,随着紫苏叶片乙醇提取物浓度的升高,苹果树树皮的游离脯氨酸含量呈先上升后降低的趋势;随着处理时间的延长,苹果树树皮的游离脯氨酸含量则呈逐渐上升的趋势。不同浓度紫苏叶片乙醇提取物处理均可显著提升苹果树树皮的游离脯氨酸含量,且以0.8 g/mL处理提升幅度最大。在接种后30 d,各处理的游离脯氨酸含量均达到最高,质量浓度为0.2、0.4、0.6、0.8、1.0 g/mL的紫苏叶片乙醇提取物处理的苹果树树皮游离脯氨酸含量分别较对照提升 13.53%、17.31%、22.27%、30.78%、23.03%,其中 0.8 g/mL的处理较0.6 g/mL处理达到显著差异水平(P<0.05),较0.2、0.4 g/mL及CK处理均达到极显著差异水平(P<0.01)。这说明,紫苏叶片乙醇提取物处理可提升苹果树树皮的游离脯氨酸含量,且以质量浓度为0.8 g/mL处理提升幅度最大。
2.5 紫苏乙醇提取物对苹果树病程相关蛋白基因PR5和PR8表达量的影响
由图4可知,苹果树树皮病程相关蛋白基因PR5和PR8的表达量随着紫苏叶片乙醇提取物浓度的升高和处理时间的延长均呈先升高后降低的趋势。不同浓度紫苏叶片乙醇提取物处理均可显著提升苹果树树皮PR5和PR8的表达量,且以 0.8 g/mL 处理提升幅度最大。在接种后20 d,各处理PR5和PR8的表达量均达到最高,质量浓度为0.2、0.4、0.6、0.8及1.0 g/mL的紫苏叶片乙醇提取物处理的苹果树树皮PR5表达量分别是对照的1.76、2.03、2.29、2.62、2.38倍,其中 0.8 g/mL 的处理较0.6 g/mL处理达到显著差异水平(P<0.05),较0.2、0.4 g/mL及CK处理均达到极显著差异水平(P<0.01)。处理20 d后,质量浓度为0.2、0.4、0.6、0.8及1.0 g/mL的紫苏叶片乙醇提取物处理的苹果树树皮PR8表达量分别是对照的1.63、1.77、2.01、2.29和2.12倍,其中0.8 g/mL处理较0.6 g/mL处理达到显著差异水平(P<0.05),较0.2、0.4 g/mL 及CK处理均达到极显著差异水平(P<0.01)。这说明,紫苏叶片乙醇提取物处理可诱导苹果树树皮的病程相关蛋白基因PR5和PR8转录水平上调,且以质量浓度为 0.8 g/mL 处理提升幅度最大。

3 结论与讨论
紫苏体内含有大量的黄酮类、苷类、萜类及挥发油类等生物活性成分,具有抑菌、抗氧化、降脂降糖等生物活性[11-12]。段江莲等研究表明,紫苏叶片多酚及黄酮成分含量明显高于茎、花、籽部位,甲醇提取物对敏感菌株大肠杆菌具有较好的抑菌性,可以用于天然防腐剂和抗氧化剂的开发[15];魏雯等研究表明,紫苏叶、籽皮水浸液可较好地抑制大肠埃希菌、枯草芽孢杆菌、八叠球菌及金黄色葡萄球菌的生长,其中,对枯草芽孢杆菌的抑菌作用最强[16]。本研究结果表明,紫苏乙醇提取物对苹果树腐烂病病菌的生长存在明显抑制,且不同部位抑制率存在显著差异,紫苏叶部位抑制率最强,最小抑菌质量浓度为0.8 g/mL,抑制率达到81.38%。在预防处理与治疗处理中,不同浓度紫苏叶片乙醇提取物处理均可显著降低苹果树幼苗腐烂病的病情指数和发病率(P<0.05),显著提升防治效果(P<0.05),以0.8 g/mL处理效果最佳,分别较CK、0.2、0.4 g/mL处理达到极显著差异水平(P<0.01),较0.6 g/mL处理达到显著差异水平(P<0.05)。其原因可能是紫苏乙醇提取物可显著抑制苹果树腐烂病的病原菌,尤其以0.8 g/mL处理抑菌效果最为显著。
植物在长期的进化过程中,自身形成了一套完整的防御酶系统,以抵御生物和非生物逆境对自身造成的伤害[21]。本研究结果表明,随着紫苏叶片乙醇提取物浓度的升高,接种苹果树腐烂病病原菌树皮的POD、PPO、PAL及GLU活性均呈先上升后趋于平稳的趋势。其中以0.8 g/mL处理防御酶活性提升幅度最大,在接种后20 d,POD、PPO、PAL及GLU活性分别为对照的2.41、1.64、2.31和2.29倍,较0.6 g/mL处理达到显著差异水平(P<0.05),较CK、0.2、0.4 g/mL处理均达到极显著差异水平(P<0.01)。本研究结果与周宝利等在茄子及王远遐等在黄瓜方面的研究结果[22-23]一致。MDA含量是衡量膜质过氧化程度的重要指标。本研究结果表明,随着紫苏叶片乙醇提取物浓度的升高,苹果树树皮的MDA含量呈逐渐降低的趋势,以1.0 g/mL处理效果最佳,在接种后30 d,MDA含量较CK降低20.48%,较 0.6 g/mL 处理达到差异显著水平(P<0.05),较0.2、0.4 g/mL 及CK处理均达到极显著差异水平(P<0.01),而与 0.8 g/mL 处理差异不显著(P>0.05)。这说明,1.0、0.8 g/mL 紫苏叶片乙醇提取物处理的苹果树树皮细胞膜受破坏程度最轻,其原因是0.8、1.0 g/mL处理下苹果树树皮的防御酶活性较高。
相关研究表明,PR蛋白与植物抵御病原菌侵染和抵抗非生物逆境能力密切相关[24]。本研究结果表明,PR5和PR8的表达量随着紫苏叶片乙醇提取物浓度的升高和处理时间的延长均呈先上升后降低的趋势,且以0.8 g/mL处理上调表达幅度最大,分别是CK的2.62、2.29倍,与0.6 g/mL处理达到显著差异水平(P<0.05),与0.2、0.4 g/mL及CK均达到极显著差异水平(P<0.01)。
综上所述,0.8 g/mL紫苏叶部位乙醇提取物对黑腐皮壳属真菌抑菌性最强,可明显降低苹果树腐烂病病情指数和发病率,防治效果显著提升,苹果树防御酶活性显著提升,病程相关蛋白基因PR5和PR8表达量显著上调,游离脯氨酸含量显著提升,膜质过氧化程度显著降低,可明显增强苹果树对腐烂病的抗性,可用于苹果树腐烂病的生物防治。
