小肠黏膜下层仿生双层敷料复合富血小板血浆促进难愈性皮肤溃疡的修复
2018-10-13世荣
,,, ,,世荣,
(1.陆军军医大学第一附属医院整形美容外科,重庆 400038;2.重庆市畜牧科学研究院,重庆 400039)
放射性皮肤损伤是临床上较为常见的一种难愈性创面,主要出现在放疗和核事故患者中,具有难治性、易复发等特点[1]。针对放射性损伤难愈合的机制现有很多研究观点。曹卫红等[2]认为放射导致皮肤难愈合的原因是照射后局部血管内皮细胞、成纤维细胞等凋亡增加;Goessler等[3]认为相对于普通创面,放射性损伤会降低患处多种细胞因子的表达,抑制放射性创面的正常愈合。因此,针对上述致伤机制,很多治疗方案也应运而生,Kinoda等[4]使用含成纤维细胞生长因子-2的低分子肝素/鱼精蛋白纳米颗粒,有效促进了大鼠辐照后皮肤创面的愈合;Yu等[5]提出壳聚糖纳米颗粒加载血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)可以促进局部血管内皮活化,促进新血管重建,恢复患处血供以促进放射性创面的愈合;黄红梅等[6]则在临床上应用富血小板血浆(platelet-rich plasma, PRP)治疗难愈性皮肤溃疡,并取得了一定的疗效。虽然上述治疗方案取得了一定的成果,但是仍存在许多问题,如创面愈合是一个复杂的过程,需要多种生长因子协同作用,单一使用某种生长因子并不能达到最好的促愈合效果; PRP内虽然含有多种生长因子,但单独使用时,仍存在易流失,不能提供良好的微环境供细胞生长等问题。因此如何保证PRP在修复过程中保持最大的利用率,维持相对稳定的微环境,更加有效地促进组织的修复,仍是需要研究的课题。
我们课题组前期成功研发出了小肠黏膜下层(small intestine submucosa, SIS)仿生双层敷料,并且证实SIS仿生双层敷料可以显著缩短普通伤口愈合时间[7]。SIS仿生双层敷料上层是致密的SIS膜,可以有效抵御细菌入侵,下层疏松多孔的三维立体结构,不仅可以为细胞生长、迁移提供良好的微环境,还可以吸附PRP,大大减少不必要的损耗,达到最大的利用价值[7]。因此,本研究使用SIS仿生双层敷料作为PRP的载体,观察SIS仿生双层敷料复合PRP对大鼠难愈性皮肤创面愈合的影响。
1 材料与方法
1.1 SIS的制备
根据Wang等[7]报道的方法制备猪SIS及SIS冷冻凝胶复合SIS膜双层敷料,具体方法为:取新鲜猪小肠,去除浆膜层和肌层,通过脱脂、胰酶消化、去垢剂清洗等序贯步骤制备SIS单纯膜。将SIS膜在低温下打碎后,经过胃蛋白酶酶解、盐析离心、醋酸溶解、透析、冻干等步骤制备出SIS粉末。取SIS粉末溶于2-(N-吗啡基)乙磺酸(Sigma)缓冲液中,4 ℃搅拌过夜。SIS溶解液、1-乙基-3-(3-二甲胺丙基)碳二亚胺盐酸盐(Sigma)、N-羟基琥珀酰亚胺(Sigma)按照8 ∶ 1 ∶ 1混合后,转移至底部铺有SIS膜的培养皿中,-80 ℃冷冻交联24 h。漂洗后使用冻干机于-80 ℃真空干燥,制备出SIS仿生双层敷料,4 ℃冰箱保存。
1.2 PRP的制备
采用Landesberg二次离心法制备PRP[8]。将制得的PRP置于-80 ℃冰箱保存。使用前使用10%CaCl2激活。
1.3 实验分组与处理
将40只大鼠随机分为4组,每组10只,即对照组(Control组)、SIS修复组(SIS组)、PRP修复组(PRP组)、SIS复合PRP修复组(SIS+PRP组)。使用4 mL/kg 10%的水合氯醛行腹腔注射麻醉,剔除大鼠背毛,使用X射线照射仪对大鼠背部直径3 cm的区域进行总剂量25 Gy的辐照,大鼠的其他部位使用铅板遮挡,于辐照区域用直尺和记号笔标记1 cm×1 cm的拟去除范围,碘伏棉球消毒3次后,75%酒精棉球脱碘,用眼科剪沿标记范围剪除皮肤及皮下全层,制成全层皮肤缺损的1 cm×1 cm创面。动物模型制备完成后,各组分别进行以下处理:SIS+PRP组创面予以滴加了0.2 mL PRP的SIS仿生双层敷料覆盖后外贴手术贴巾;SIS组创面予以滴加了0.2 mL PBS的SIS仿生双层敷料覆盖后外贴手术贴巾;PRP组创面予以滴加0.2 mL PRP后外贴手术贴巾;空白对照组创面予以滴加0.2 mL PBS后外贴手术贴巾。观察各组大鼠术后第3、7、11、15天创面愈合情况,计算创面愈合率。创面愈合率=(原始创面面积-未愈合创面面积)/原始创面面积×100%。取术后15 d大鼠创面及周围组织,进行丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide Dismutase,SOD)、核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信号通路相关蛋白的检测。
1.4 酶联免疫吸附测定(enzyme linked immunosorbent assay, Elisa)
将小鼠皮肤组织样本去除皮下脂肪,放入预冷的研钵内边研磨边加液氮,至组织完全研磨成粉末,加入PBS制成匀浆,将组织匀浆以12 000 rpm离心10 min,取上清。按照Elisa试剂盒说明书(abcam),使用化学比色法分别测定MDA含量及SOD活性。
1.5 蛋白质免疫印迹(western blot,WB)
每20 mg皮肤组织加入200 μL含1 mmol/L PMSF的RIPA裂解液(abcam),匀浆至充分裂解。12 000 rpm离心5 min,取上清液,用BCA法(abcam)测定各组上清液蛋白浓度。于凝胶成像仪(bio-rad)中曝光获取图像,使用Image Pro Plus 6.0软件测量各条带的灰度值,将对照组中目的条带与GAPDH条带的灰度值之比设置为1。
1.6 统计学分析
2 结果
2.1 各组大鼠皮肤创面愈合率比较
通过观察可见,随着时间的推移,各组大鼠背部皮肤创面均逐渐缩小,以SIS+PRP组愈合效果最为显著,在术后第3,7,11天愈合率均高于其他组,差异具有统计学意义(P<0.05),术后15 d,创面已愈合(97.6±4.6)%,创面愈合顺利,未出现红肿、破溃情况。而SIS组与PRP组术后15 d创面愈合约90%,2组各个时间段愈合率未见明显不同,差异无统计学意义(P>0.05),但是各个时间点愈合率均优于对照组,差异具有统计学意义(P<0.05),见表1。
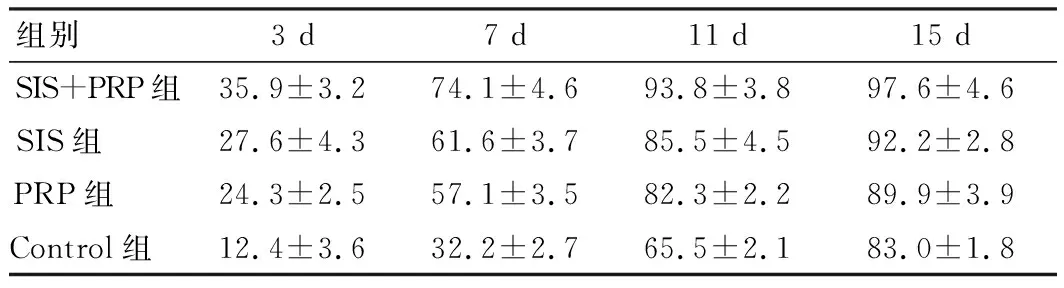
表1 各组大鼠皮肤创面愈合率比较(%)
2.2 各组大鼠皮肤氧化应激水平比较
术后15 d,SIS+PRP组大鼠难愈性皮肤创面的MDA含量(5.58±0.86)μmol/g显著低于对照组(13.71±2.04)μmol/g、SIS组(11.26±1.79)μmol/g、PRP组(10.18±1.73)μmol/g,差异有极显著性统计学意义(P<0.01),见图1a。术后15 d,SIS+PRP组大鼠难愈性皮肤创面的SOD含量(17.60±3.89)U/mL显著高于对照组(5.02±2.05)U/mL、SIS组(7.10±2.41)U/mL、PRP组(11.37±2.96)U/mL,差异有极显著性统计学意义(P<0.01),见图1b。
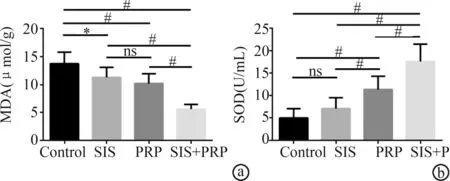
a:MDA;b:SOD ns:P>0.05;*:P<0.05;#:P<0.01
2.3 各组大鼠皮肤Nrf2表达的比较
术后15 d,SIS+PRP组大鼠难愈性皮肤创面的Nrf2 mRNA的相对表达量(3.18±0.64)显著高于对照组(1.00±0.00)、SIS组(1.17±0.22)、PRP组(1.56±0.39),差异有极显著性统计学意义(P<0.01),见图2。
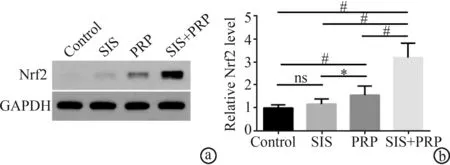
a:WB图片;b:蛋白定量分析 ns:P>0.05;*:P<0.05;#:P<0.01
2.4 SIS复合PRP促进Akt/GSK-3β/Fyn信号通路的活化
术后15 d,SIS+PRP组大鼠难愈性皮肤创面p-AKT及p-GSK-3β的相对表达量(3.94±0.71、2.95±0.50)显著高于对照组(1.00±0.00、1.00±0.00)、SIS组(1.86±0.35、1.46±0.19)、PRP组(2.77±0.52、1.91±0.29),差异有极显著性统计学意义(P<0.01),见图3a~c。而SIS+PRP组Fyn的相对表达量(0.31±0.19)显著低于对照组(1.00±0.00)、SIS组(0.89±0.21)、PRP组(0.56±0.20),差异具有统计学意义(P<0.05或P<0.01),见图3a、d。
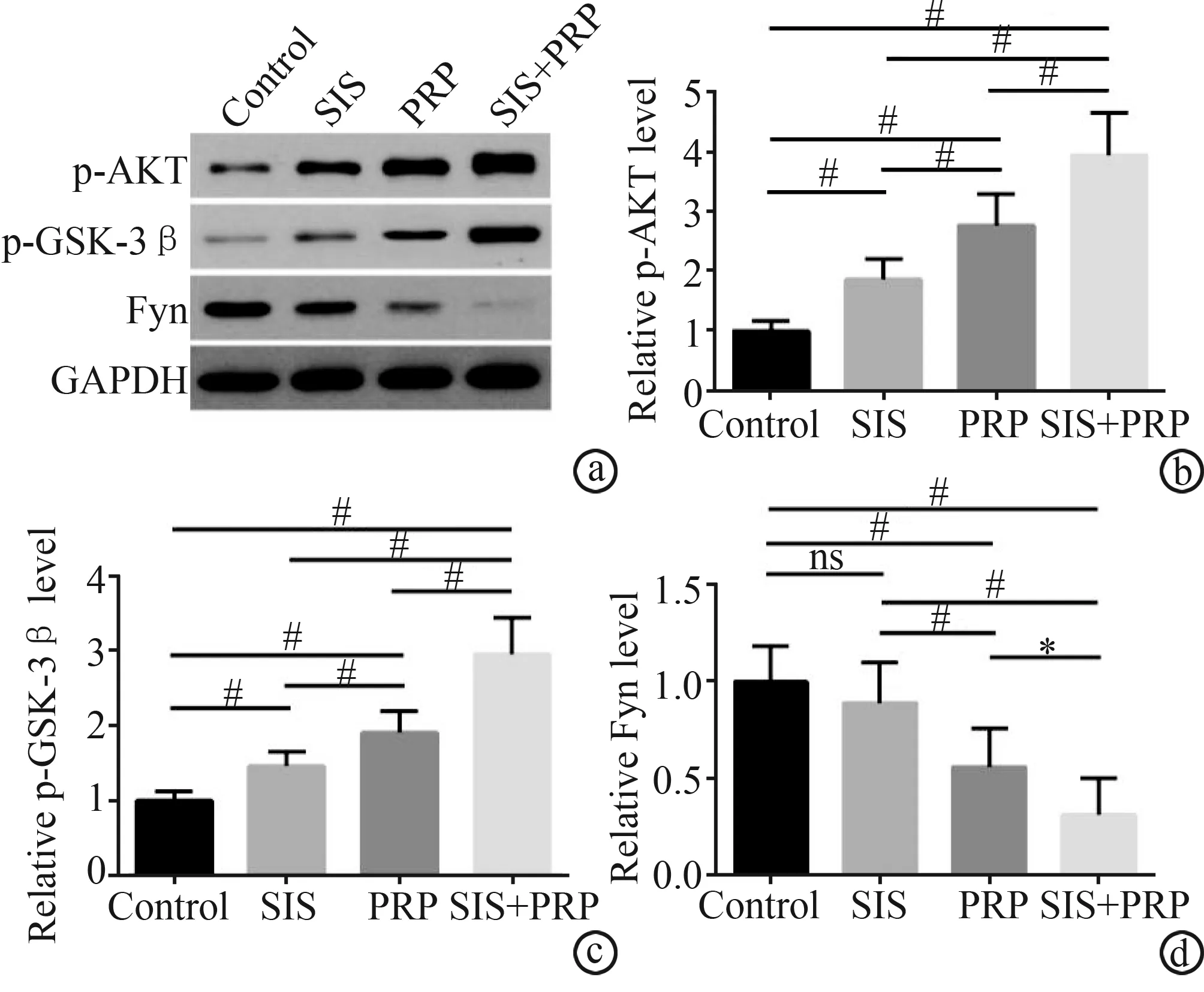
a:WB图片;b:P-AKT蛋白定量分析;c:p-GSK蛋白定量分析;d:Fyn蛋白定量分析 ns:P>0.05;*:P<0.05;#:P<0.01
3 讨论
放射治疗作为一种标准的局部治疗方式,是很多恶性肿瘤的辅助治疗手段,但随着应用增加,照射部位的放射性皮肤损伤也越来越多,当发生严重放射性损伤时,会使基底细胞、成纤维细胞及血管内皮细胞等遭到严重破坏,引起局部血运障碍,并影响炎症细胞粘附及迁出血管,使局部生长因子浓度低于普通创面。生长因子具有调节细胞生长与功能等多种作用,因此补充外源性生长因子,有利于难愈性创面的修复[1]。PRP是通过将自体新鲜全血进行离心后取得富含血小板和血浆的浓缩物,因其激活后可以释放血小板衍生生长因子(platelet derived growth factor,PDGF)、VEGF、成纤维细胞生长因子(fibroblast growth factors,FGF)、胰岛素样生长因子(insulin-like growth factor,IGF)等多种生长因子,所以被广泛应用于难愈性创面、骨骼肌肉、神经等组织的修复[9-11]。但是,单纯使用PRP存在易流失、浪费成分、不能提供很好的三维立体空间供细胞生长等问题。
我们课题组前期研发出了SIS仿生双层敷料,该敷料不仅可以防止细菌入侵,还可以为伤口创造湿润环境,为细胞生长、迁移提供必要的空间结构,并且在其缓慢降解过程中释放多种生长因子,经研究证实该敷料可以有效促进大鼠皮肤创面的愈合[7]。而另一项试验结果显示[12],虽然SIS在降解过程中可以释放生长因子,但含量并不高,VEGF含量约为(93.8±3.033)×10-3ng/mL,bFGF含量约为(121.8±2.683)×10-3ng/mL,仅仅依靠SIS仿生双层敷料自身释放的生长因子浓度远远达不到放射性损伤创面愈合生长因子浓度需求。
因此,本文将SIS仿生双层敷料作为吸附PRP的载体,制备出SIS+PRP敷料,用来观察其对放射性损伤创面愈合的影响,以期解决单用PRP易流失,单用SIS仿生双层辅料生长因子含量不足的问题。我们在研究中发现,使用SIS+PRP治疗方案在治疗不同阶段的皮肤创面愈合率均显著优于单用SIS或PRP的大鼠,这表明SIS+PRP治疗方案确实可以有效促进因放射所致的难愈性创面愈合。
为了探究SIS+PRP治疗方案促进放射性皮肤损伤创面愈合的机制,我们继续研究了SIS+PRP治疗方案对于大鼠皮肤氧化应激水平、Nrf2蛋白表达情况和Akt/GSK-3β/Fyn信号通路活化情况的影响。我们通过研究发现,SIS+PRP治疗方案能有效降低细胞MDA含量,提高SOD含量,这表明SIS+PRP治疗方案可以降低创面氧化应激水平。Rong等[13]已经证明Nrf2蛋白对细胞氧化应激具有抑制和保护作用,为了探究SIS+PRP治疗方案降低创面氧化应激水平与Nrf2蛋白的关系,我们检测了不同治疗方案处理后创面细胞Nrf2蛋白表达情况。我们发现,经过SIS+PRP治疗方案处理后的创面其细胞Nrf2蛋白表达量显著高于单用SIS或PRP以及对照组的创面。这表明SIS+PRP治疗方案可以通过提高Nrf2蛋白表达量,降低创面细胞氧化应激水平。我们知道细胞Nrf2表达主要是通过Akt/GSK-3β/Fyn信号通路调控,研究证明,通过磷酸化Akt可以进一步磷酸化p-GSK-3β,使其失去活性,从而降低Fyn的表达,减少Nrf2的出核和泛素化[14-15]。为了研究SIS+PRP治疗方案对于Akt/GSK-3β/Fyn信号通路的影响,我们检测了术后15 d大鼠皮肤创面p-AKT及p-GSK-3β的相对表达量及Fyn的表达量,发现SIS+PRP治疗方案可以有效提高p-AKT及p-GSK-3β的相对表达,降低Fyn表达。这说明SIS+PRP治疗方案可能是通过影响Akt/GSK-3β/Fyn信号通路活化,增加Nrf2蛋白量,来降低细胞氧化应激水平,从而促进创面的愈合。
综合以上研究,我们认为SIS仿生双层敷料构建了类似于人体表皮和真皮的双层结构,减少了外部环境对创面的干扰,为创面愈合提供了适宜的湿润环境,也提供了适宜细胞生长、迁移的三维空间,另外PRP释放大量的生长因子补充了放射性创面对生长因子的需求,因此使创面愈合显著优于其他组,而促进愈合的机制可能是通过活化Akt/GSK-3β/Fyn信号通路,降低细胞氧化应激水平达到的。
虽然实验结果显示,SIS+PRP组可以促进放射性损伤创面的愈合,但仍有许多科学问题尚未解决:①本研究仅从氧化应激及其信号通路的角度探讨了SIS+PRP的治疗效果,是否有细胞凋亡保护等其他机制参与;②不同方式制备出的PRP浓度和生长因子的含量并不相同,不同浓度的PRP在促进放射性损伤创面愈合的效果是否一样,放射性损伤创面所需各种生长因子的最佳浓度是多少;③在大鼠模型上证实SIS+PRP治疗方案对于放射性皮肤损伤导致的难愈性创面具有较好的疗效,但是其对于患者的治疗作用如何尚不清楚。
综上所述,小肠黏膜下层复合富血小板血浆可以促进难愈性皮肤溃疡的修复,可能与Akt/GSK-3β/Fyn信号通路介导的Nrf2/ARE活化有关。
