海洋微生物的分离与拮抗菌株的初筛
2018-10-13胡秀荣黄振东蒲占湑杜丹超陈国庆鹿连明
胡秀荣 黄振东 蒲占湑 杜丹超 陈国庆 鹿连明
(浙江省柑橘研究所 台州318026)
柑橘黑点病在浙江柑橘产区经常发生,严重影响果实外观品质,造成巨大的经济损失,是当前柑橘重点防治的对象。目前生产上防治黑点病主要以代森锰锌为主,一年喷药4~5次,由于该药剂多年连续使用,再加上农户喷药过程中经常随意加大用药浓度,势必造成农药的残留和环境的污染,因而开发低残留、对环境友好的生物农药很有必要,本研究试图从浙江大陈岛海域采样分离微生物,从中筛选出具有拮抗活性的菌株,为开发新的生物农药提供基础。
1 材料与方法
1.1 海洋微生物的分离
1.1.1 样品的采集。为排除陆地微生物的干扰,从远离大陆的大陈岛(下大陈岛)周边海域取样,样品包括新出海的鱼类、贝类、虾类以及潮间带的泥沙,将采集的样品放入装有冰块的保温箱,24h 内带回实验室内进行微生物的分离[1]。
1.1.2 分离培养基。共选用5种分离培养基,成分如下:G1:可溶性淀粉20g,KNO31.0g,K2HPO40.5g,MgSO40.5g,NaCl0.5g,FeSO40.01g,琼脂20g,人工海水1000ml;M1:葡 萄 糖10g;天 冬 氨 酸0.5g;K2HPO40.5g;MgSO4·7H2O0.05g;琼脂20g;人工海水1000ml;M2:琼脂20g;人工海水1000ml;PDA:马铃薯200g,葡萄糖20g,琼脂20g,人工海水1000ml;NA:牛肉浸膏3g,蛋白胨5g,葡萄糖2.5g,琼脂20g,人工海水1000ml。
其中人工海水是采用Sigma 公司生产的海盐40g加入1000ml 的纯净水溶解而成。G1、M1和M2三种培养基中均加入萘啶酮酸15μg/ml、制霉菌素50μg/ml和放线菌酮50μg/ml[3]。
1.1.3 海洋微生物的分离与培养。将采集鱼类、贝类和虾类的样品用无菌剪刀剪碎,取1g样品,放入4ml的无菌水中,55℃热激10min,剧烈摇动,再将样品1:4稀释,取20µL 稀释液均匀涂布于5种分离培养基平板上,28℃培养2~6周,待菌落长出,挑取菌落进行转接纯化,纯化培养的菌株再接种到含分离培养基的试管中培养,然后放于4℃冰箱保存备用[2]。
1.2 拮抗菌株的筛选
1.2.1 指示菌平板的制备。柑橘黑点病菌由本实验室从发病的柑橘果实上分离并保存。将保存的柑橘黑点病菌转接于PDA培养基平板上,置于28℃的微生物培养箱培养,待菌落长满整个培养皿,用直径6mm的打孔器打取菌饼,置入PDA 培养基平板中央即为指示菌平板。
1.2.2 拮抗菌株的筛选 。采用对峙培养的方法筛选拮抗菌株,将分离获得的海洋放线菌、真菌和细菌接种于相应的培养基平板上,28℃培养7d后,在有菌生长处用打孔器取直径6mm的菌饼,置于距离指示菌平板中心约3cm处,每皿成三角形放置3块,以不放置待测菌株的指示菌平板作为对照。于28℃的微生物培养箱培养7d后,观察抑菌带的有无和宽度,据此判定微生物的拮抗活性[3]。
2 结果与分析
2.1 海洋微生物的分离
从浙江省大陈岛周边海域采集鱼类、贝类、虾类以及潮间带的泥沙等样品20份,进行海洋微生物菌株分离。根据菌落生长形态、大小、色泽等特点进行重排,用肉眼观察,从平板上挑取不同生长特征的菌落进行纯培养,分离到形态特征各异的菌株共计57株。其中放线菌28株、真菌16株、细菌13株(表1)。
2.2 拮抗菌株的初筛
通过平板对峙培养试验,从分离获得的微生物中筛选出4株对柑橘黑点病菌具有明显拮抗活性的菌株(图1所示)。4株菌均属
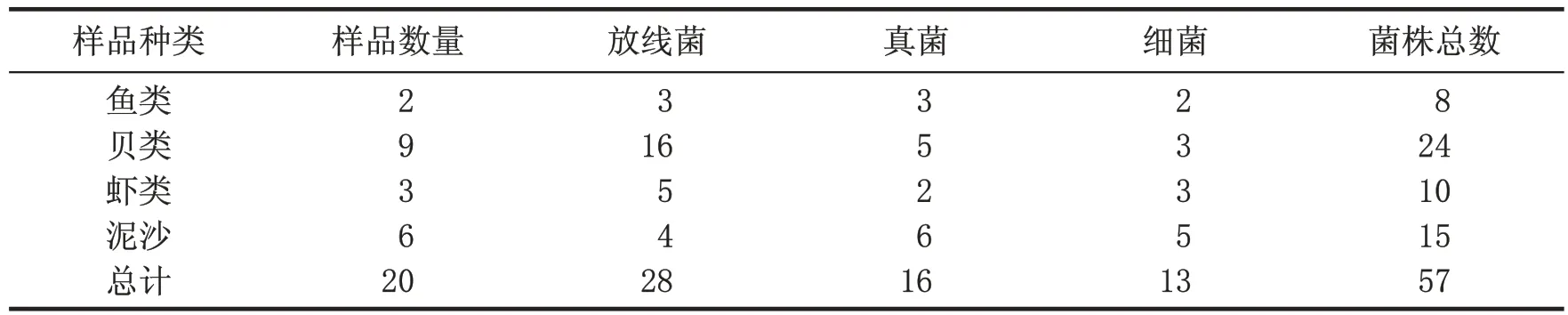
表1 不同海洋生物样品中分离的菌株数

图1 拮抗柑橘黑点病菌的菌株
于放线菌,分离获得的其他16株真菌和13细菌中未发现拮抗活性的菌株。
3 讨论
海洋中有大量微生物资源,其低温、高压、高盐的特殊环境为抗生素等多种代谢活性产物的产生提供了可能,海洋微生物资源的发利用前景广阔,是当前海洋学和微生物学研究的热点[3]。海洋放线菌,尤其是链霉菌在海洋环境中分布广泛,种类多样,能产生多种抗生素类物质,具有巨大的研究开发价值。
本研究从浙江省大陈岛海域采集的海洋生物和泥沙等20份样品中分离获得了57株微生物菌株,经初步测定得知其中有4株放线菌对柑橘黑点病菌具拮抗活性。本次研究结果表明台州地区海洋环境中含有对柑橘病原菌具拮抗活性的微生物,可作为今后拮抗微生物获取的重要来源。本研究测定4株放线菌对柑橘黑点病病菌均具有抑菌活性,那么这些菌株对其他植物病原菌是否有拮抗活性,以及其他分离的微生物对柑橘黑点病菌外的植物病原菌是否有拮抗活性,仍需进一步研究确定。此外,对这些拮抗菌株的分类鉴定等也是接下来需要开展的工作。
