羊结肠小袋虫药敏试验
2018-10-12刘俊伟宋开放杨树宇王文哲姜金庆
刘俊伟,周 叶,宋开放,杨树宇,王文哲,姜金庆
(河南科技学院动物科技学院,河南新乡 453003)
结肠小袋虫病(Balantidiosis)是由结肠小袋虫(Balantidiumcoli)引起的人畜共患寄生虫病,呈全球性分布,已报道包括猪、牛、羊、爬行类等在内的50多种动物可感染该病[1-3],其中,中国生物医学研究中心检测到灵长类食蟹猴感染率达到22.2%[4],巴西学者在圈养灵长类动物粪便中检测到高达56.7%的感染率[5],该病可致痢疾样腹泻及肠外感染或者与其他病原体的合并感染,甚至引起肠坏死等症状,严重威胁人畜安全[6]。结肠小袋虫生长发育分为2个阶段,即滋养体期和包囊期[7],在寄生虫处于滋养体时期进行杀灭可达到最佳效果。羊结肠小袋虫病是由纤毛虫纲、毛口目、小袋虫科、小袋虫属的结肠小袋虫寄生于羊的大肠内所引起的以腹泻、脱水、消瘦和贫血为特征的人兽共患原虫病。目前,文献报道中治疗猪结肠小袋纤毛虫的病例较多,并进行了纤毛虫的体外培养试验[8]、猪结肠袋虫的分子鉴定[9]、药物毒杀试验[10-11]和理化因素影响试验[12]等,而末见直接报道羊结肠小袋虫的病例分析。为了筛选抗羊结肠小袋虫病的有效药物,需要对该寄生虫进行体外培养,并探讨不同药物杀灭羊结肠小袋虫滋养体的效果,为防控羊结肠小袋虫病奠定基础。
1 材料与方法
1.1 材料
1.1.1 羊结肠小袋虫的来源 羊结肠小袋虫采自新乡市某杜泊绵羊养殖户,该养殖户饲养规模100只,放牧散养,其中30只患严重腹泻为特征的结肠小袋虫病。
1.1.2 RPMI1640培养基 PRMI1640培养基用灭菌蒸馏水溶解至1 000 mL,加2.0 g NaHCO3,并调节pH为7.0,置4℃保存备用。使用时,适量1 640培养基分别加入胎牛血清250 g/L,10 g/L玉米淀粉和10 000 U/mL的青霉素和链霉素,制成虫体培养液。
1.1.3 药物种类 丙硫苯咪唑片(50 mg/片)、盐酸左旋咪唑片(25 mg/片)、甲硝唑片(200 mg/片)、痢特灵片(100 mg/片)和乳酶生片(100 mg/片),以上药品各加蒸馏水1 mL,制成混悬液;土霉素片(500 mg/片)、复方新诺明片(480 mg/片)、血虫净(250 mg/支)和氨苄青霉素钠(500 mg/瓶),以上药品各加蒸馏水2.5 mL,制成混悬液或溶液,4℃保存备用。上述药品均来自正规制药厂家,且均在有效期内。
1.2 方法
1.2.1 羊结肠小袋虫的处理 30只患严重腹泻为特征的结肠小袋纤毛虫病,粪便直接镜检发现有大量滋养体。将阳性粪便接种于RPMI1640培养基,28℃进行增殖,达到繁殖期时,用培养基将滋养体稀释至约4×104个/mL,制成羊结肠小袋虫滋养体悬液备用。
1.2.2 绝对致死浓度(LC100)的估算 在96孔细胞培养板中加入PRMI1640培养基100 μL/孔至第12孔;移液器吸取200 mg/mL甲硝唑混悬液100 μL于第1孔,吹吸混匀后吸取100 μL至第2孔,依次倍比稀释至第11孔,从第11孔弃去100 μL,留第12孔作阴性对照;每孔分别加入羊结肠小袋虫滋养体悬液100 μL,轻轻震荡细胞培养板,使各孔混匀,盖上盖板膜,28℃培养箱中作用6 h,置显微镜下观察羊结肠小袋虫滋养体的存活情况。本组试验3个重复。将200 mg/mL甲硝唑混悬液致羊结肠小袋虫滋养体全部死亡的最大稀释倍数(最小浓度),计作甲硝唑混悬液的绝对致死浓度(LC100)。
用50 mg/mL丙硫苯咪唑、25 mg/mL盐酸左旋咪唑、100 mg/mL痢特灵、100 mg/mL乳酶生、200 mg/mL土霉素、192 mg/mL复方新诺明、100 mg/mL血虫净和200 mg/mL氨苄青霉素钠分别重复上述试验。根据LC100数值选取杀虫效果最好的3种药物确定下一步试验浓度梯度,并测算其半数致死浓度(LC50)。
1.2.3 半数致死浓度(LC50)试验
1.2.3.1 甲硝唑2 h和12 h杀虫试验 根据预试验结果,以200 mg/mL甲硝唑混悬液为母液,使用PRMI1640培养基将甲硝唑混悬液稀释成0、200、300、400、500、600、700 mg/L等7个浓度梯度。将培养的羊结肠小袋虫滋养体悬液均匀加入21个10 mL青霉素瓶内,并补充培养基使每瓶的液体体积为3 mL,然后分成7组,每组3个平行。将不同浓度的甲硝唑混悬液加入相应组别的青霉素瓶内,每瓶3 mL,甲硝唑最终浓度分别为0、100、150、200、250、300、350 mg/L。将上述青霉素瓶加盖后置28℃恒温培养箱内静置培养,2 h后取出,液体充分混匀,移液器吸取10 μL滴于载玻片上,加盖玻片后显微镜检。12 h毒性试验时,根据预试验结果,甲硝唑最终浓度确定为0、30、40、50、60、70、80 mg/L,其他步骤同2 h杀虫试验。
1.2.3.2 血虫净2 h和12 h杀虫试验设计 使用PRMI1640培养基将100 mg/mL血虫净母液稀释后用于杀虫试验,具体分组和观察方法同1.2.3.1。根据预试验结果,确定2 h杀虫试验的最终浓度分别为0、300、350、400、450、500、550 mg/L,12 h杀虫试验的最终浓度分别为0、80、90、100、110、120、130 mg/L,其他步骤同甲硝唑杀虫试验。
1.2.3.3 土霉素2 h和12 h杀虫试验设计 使用PRMI1640培养基将200 mg/mL土霉素母液稀释后用于杀虫试验,具体分组和观察方法同1.2.3.1。根据预试验结果,确定2 h杀虫试验的最终浓度分别为0、300、400、500、600、700、800 mg/L,12 h杀虫试验的最终浓度分别为0、80、100、120、140、160、180 mg/L,其他步骤同甲硝唑杀虫试验。
1.2.4 数据计算
1.2.4.1 滋养体存活性判定 载玻片置显微镜100倍暗视野下检查,计算30个视野下样品的虫体平均密度,虫体运动减弱、原地缓慢旋转、纤毛小幅度摆动者仍作活虫计数,虫体不运动、表膜脱出、萎缩、裂解或结构破碎者,作死虫计数。
1.2.4.2 死亡率 以对照组(消毒剂浓度为0)3个平行样品试验结束时所获得的平均活虫数为x,以该试验系列相应浓度组3个平行样品试验结束时所获得的平均活虫数为y,将(x-y)/x的数值换算成百分数,就是该浓度条件下的羊结肠小袋虫滋养体的死亡率。
1.2.4.3 半数致死浓度(LC50)的计算 采用机率单位法计算LC50值,根据死亡百分率—机率单位换算表,将不同浓度下死亡百分率换算成死亡机率单位[10-11]。在Excel图表中,以横轴表示浓度对数,以纵轴表示死亡机率单位,作xy散点图,顺着所获得的散点作一趋势线,并自动获得该直线的回归方程。经x2检验回归线符合要求后,利用该方程式求出死亡机率单位5(50%死亡率)时的药物浓度对数,查反对数表就可以获得LC50值。
2 结果
2.1 羊结肠小袋虫滋养体对药物的敏感性试验结果
羊结肠小袋虫滋养体对药物的敏感性试验结果见表1。甲硝唑、血虫净、土霉素、复方新诺明、盐酸左旋咪唑、痢特灵和氨苄青霉素钠对羊结肠小袋虫滋养体的绝对致死浓度(LC100,6 h)分别为0.195、0.391、0.391、0.75 、0.781、3.125、6.25 mg/mL,丙硫苯咪唑和乳酶生在小于等于12.5 mg/mL和25 mg/mL时对羊结肠小袋虫滋养体无效。甲硝唑、血虫净和土霉素可作为治疗羊结肠小袋虫病的首选药物,用作下一步试验。
2.2 甲硝唑2 h和12 h杀虫试验结果
图1和图2显示甲硝唑的浓度对数与死亡机率单位呈线性关系。2 h杀虫试验的回归方程式为y=2.748x-1.396,R2=0.991,其回归线符合要求,死亡机率单位为5时对应的浓度对数值为2.327 5,查反对数表得其浓度为212.6 mg/L,即0.213 mg/mL。12 h杀虫试验的的回归方程式为y=2.147x+1.253,R2=0.995,其回归线符合要求,死亡机率单位为5时对应的浓度对数值为1.745,查反对数表得其浓度为55.6 mg/L,即0.056 mg/mL。

表1 羊结肠小袋虫滋养体对药物的6 h敏感性试验结果
注:无羊结肠小袋虫滋养体存活的孔标记为(-),有羊结肠小袋虫滋养体存活的孔标记为(+)。
Note:Zero survival of trophozoite of sheepBalantidiumcoliis marked as (-),and the survival of trophozoite of sheepBalantidiumcoliis marked as (+).

图1 甲硝唑2 h杀虫试验的浓度对数与死亡机率单位曲线

图2 甲硝唑12 h杀虫试验的浓度对数与死亡机率单位曲线
2.3 血虫净2 h和12 h杀虫试验结果
图3和图4显示血虫净的浓度对数与死亡机率单位呈线性关系。2 h杀虫试验的的回归方程式为y=5.815x-10.24,R2=0.993,其回归线符合要求,死亡机率单位为5时对应的浓度对数值为2.62,查反对数表得其浓度为417.7 mg/L,即0.418 mg/mL。12 h杀虫试验的的回归方程式为y=3.956x-3.035,R2=0.995,其回归线符合要求,死亡机率单位为5时对应的浓度对数值为2.031,查反对数表得其浓度为107.4 mg/L,即0.107 mg/mL。
2.4 土霉素2 h和12 h杀虫试验结果
图5和图6显示土霉素的浓度对数与死亡机率单位呈线性关系。2 h杀虫试验的的回归方程式为y=3.380x-4.188,R2=0.993,其回归线符合要求,死亡机率单位为5时对应的浓度对数值为2.718 3,查反对数表得其浓度为522.8 mg/L,即0.523 mg/mL。12 h杀虫试验的的回归方程式为y=2.373x+0.159,R2=0.995,其回归线符合要求,死亡机率单位为5时对应的浓度对数值为2.174,查反对数表得其浓度为149.3 mg/L,即0.149 mg/mL。
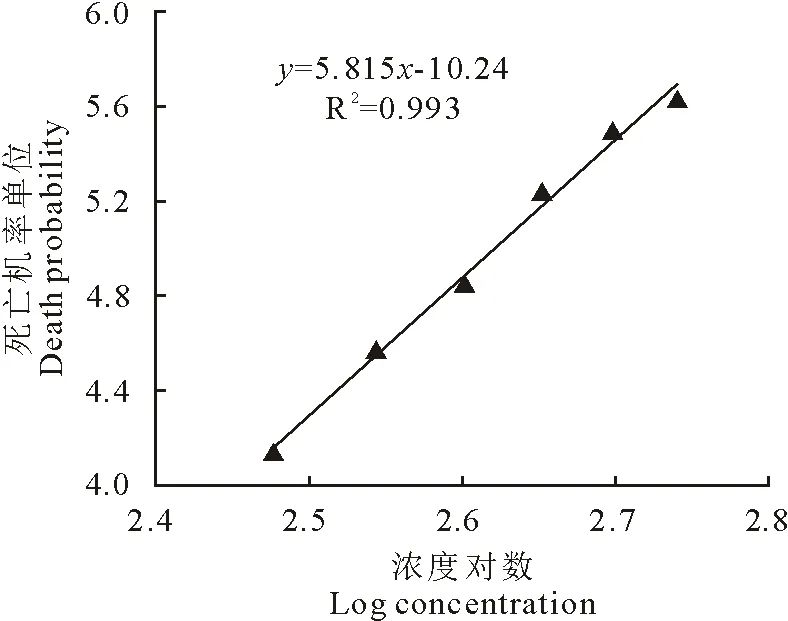
图3 血虫净2 h杀虫试验的浓度对数与死亡机率单位曲线

图4 血虫净12 h杀虫试验的浓度对数与死亡机率单位曲线
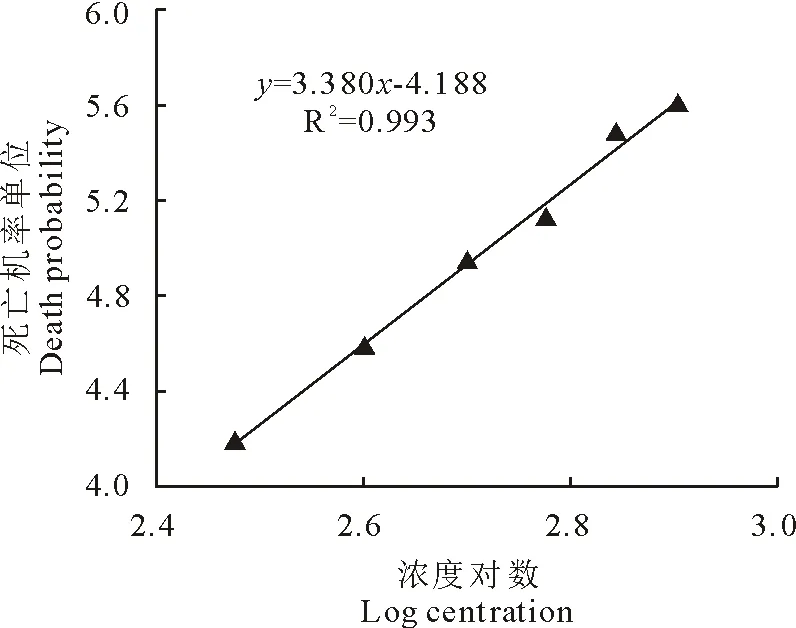
图5 土霉素2 h杀虫试验的浓度对数与死亡机率单位曲线
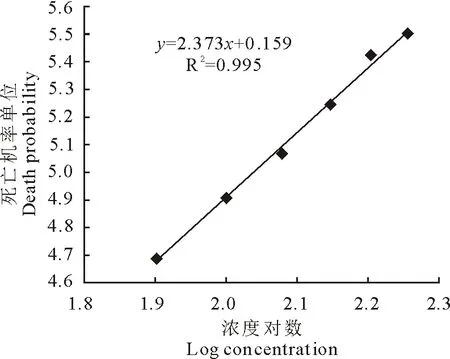
图6 土霉素12 h杀虫试验的浓度对数与死亡机率单位曲线
3 讨论
3.1 药物半数致死浓度测定方法
本试验参考猪结肠小袋虫毒性试验方法[13],建立了针对羊结肠小袋虫滋养体的药物半数致死浓度(LC50)测定方法,该方法将药液放在平底96孔细胞培养板上进行倍比稀释,然后加入等量培养的羊结肠小袋虫滋养体悬液,显微镜下观察结果。由于羊结肠小袋虫体形较小,且虫体死亡后易碎裂,难以确定死亡后的准确数据,因此本试验以对照组(不添加药液)虫体数量为参考,其与各浓度组试验结束后活虫数之差,就是该浓度下的虫体死亡数量,并据此计算死亡率。此外,为防止药物稀释液影响滋养体存活比率,本试验采用培养基稀释药物浓度的办法,减少其对试验结果的干扰。
3.2 羊结肠小袋虫病的药物治疗
临床上对结肠小袋虫病的控制主要是通过肠道给药,杀死体内的滋养体,减轻疫病症状和避免包囊的形成,进而达到治愈的目的。因此,在结肠小袋虫滋养体转化为抵抗力较强的包囊之前,使用药物将其杀死,可有效避免健康羊群的感染,也可避免对饲养管理人员造成威胁。绝对致死浓度(LC100)试验结果显示,甲硝唑、血虫净、土霉素、复方新诺明和盐酸左旋咪唑均具有较好的抗羊结肠小袋虫滋养体活性作用,其中甲硝唑、血虫净和土霉素致体外培养基内虫体全部死亡的最低浓度分别为0.195、0.391、0.391 mg/mL,是本试验中治疗该病效果最好的3种药物。
3.3 药物杀虫半数致死浓度效果比较
选择高效、低毒、价廉的药物来杀死滋养体,是控制羊结肠小袋虫病的重要方法。就本次药敏试验结果来看,甲硝唑对虫体影响最大,其次为血虫净,第3为土霉素,其他药物虽有影响,但对虫体的作用时间要长些,效果不显著。甲硝唑、血虫净和土霉素的2 h半数致死浓度(LC50)分别为0.213、0.418、0.523 mg/mL,12 h半数致死浓度(LC50)分别为0.056、0.107、0.149 mg/mL,即药物杀虫半数致死试验中,甲硝唑浓度最低、效果最好。由于甲硝唑是合成类抗菌剂,多用于抗厌氧菌的感染及肠道原虫感染[10,14],为缓解药物对机体的毒副作用,采用甲硝唑小剂量给药,是控制羊结肠小袋虫病的首要选择。但本试验中另一种抗结肠小袋纤毛虫病的常用药物痢特灵,杀虫效果较差,推测原因可能是羊群近期使用过痢特灵,且剂量和疗程不当,导致羊结肠小袋虫滋养体对其产生了耐药性。临床用药过程中,还可以根据半数致死浓度,合理选择用药剂量和用药间隔周期,以达到最佳的治疗效果。
