山羊痘病毒ORF112蛋白的原核表达及其免疫原性分析
2018-10-12陈伯祥成伟伟豆林涛
陈伯祥,杨 明,成伟伟,李 杰,豆林涛
(甘肃省畜牧兽医研究所,甘肃平凉 744000)
山羊痘病毒(Goatpox virus,GTPV)属于痘病毒科脊椎动物亚科羊痘病毒属,能够感染山羊而引起山羊痘[1-2]。山羊痘是以全身皮肤和黏膜部位出现典型痘疹的一种急性、热性、高度接触性传染病[3],该病具有较高的发病率与病死率,分布范围广、流行率高,给养羊业造成了巨大的经济损失,被世界动物卫生组织(OIE)列为必须报告的动物传染病[1,4],我国也将其列为一类动物疫病[5-6]。
GTPV为大型有囊膜的双股DNA病毒,成熟的病毒粒子呈卵圆形或砖型,大小约310 nm×204 nm,表面有复合对称结构。GTPV的基因组为一个共价闭合的双链DNA,大小约为149 kb,G+C含量约为25%[7]。GTPV的基因组包含1个相对保守的中央编码区域和2个结构相同的末端反向重复序列(inverted terminal repeat,ITR),中央编码区(ORF24-ORF123)基因主要与病毒DNA复制、病毒粒子的构建和装配等有关,在基因数目和排序上高度保守,位于两侧末端反向重复序列(ORF1-ORF23、ORF124-ORF156),主要与病毒感染宿主范围和毒力等特性相关[8]。近年来,p32蛋白的研究比较广泛,P32基因位于GTPV的中央编码区,p32蛋白是其主要的结构蛋白,可是p32蛋白全长表达比较困难,截断表达免疫原性较差,所以p32蛋白作为山羊痘病毒诊断试剂盒的包被抗原有所限制,而ORF112基因也位于GTPV的中央编码区,中央编码区的基因主要与病毒结构蛋白等相关,又由于GTPV ORF112蛋白与痘苗病毒A27L蛋白具有很高的同源性[7],再加之ORF112基因全长较短,易于表达,所以ORF112蛋白在山羊痘病毒诊断与疫苗研究方面具有很大的潜力,成为新的研究热点之一。本研究进行了GTPV ORF112基因扩增,构建ORF112基因的原核表达载体pET-ORF112,将其转化至大肠埃希菌(E.coli)BL21中进行诱导表达,Western blot检测了ORF112蛋白的表达情况与抗原性,并用ELISA方法对该蛋白的免疫原性进行了检测。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级Balb/c小鼠,雌性,4周~6周龄,体重16 g~18 g,购自中国农业科学院兰州兽医研究所实验动物中心。
1.1.2 毒株、菌株和质粒 山羊痘病毒株(GTPV-S-1)和山羊痘病毒全病毒血清均由甘肃省畜牧兽医研究所动物医学研究室保存;大肠埃希菌DH5α、BL21(DE3)感受态细胞,宝生物工程(大连)有限公司产品;质粒pET-28a(+),Addgene公司产品。
1.1.3 主要试剂 DNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒,天根生化科技(北京)有限公司产品;2×PfuPCR Master Mix 、DNA Marker 、蛋白Marker、T4 DNA连接酶、限制性内切酶BamHⅠ和Hind Ⅲ,宝生物工程(大连)有限公司产品;His-Bind Column(Ni-NTA)树脂,北京全式金生物技术有限公司产品;HRP标记的兔抗小鼠IgG、弗氏完全佐剂、弗氏不完全佐剂,Thermo Fisher科技(中国)有限公司产品。
1.2 方法
1.2.1 GTPV ORF112基因的扩增 参照GenBank中公布的GTPV ORF112基因序列并结合表达载体pET-28a(+)的酶切位点序列,应用Primer5.0软件设计扩增GTPV ORF112基因的引物,上游引物:5′-CCGGATCCCCATGGACAGAGCGTTATCCATC-3′(下划线处为BamHⅠ酶切位点),下游引物:5′-CGAAGCTTAAGTGTTGTACTTCTTCC-3′(下划线处为Hind Ⅲ酶切位点),引物由北京六合华大基因科技有限公司合成。提取GTPV的DNA,配置反应体系进行PCR扩增,并将扩增产物进行纯化回收。
1.2.2 GTPV ORF112基因原核表达载体的构建 将纯化回收的ORF112基因扩增产物和pET-28a(+)分别进行Hind Ⅲ+BamHⅠ双酶切,回收酶切产物用T4 DNA连接酶4℃过夜连接,连接产物转化至DH5α感受态细胞进行平板培养,挑取单个菌落摇菌培养14 h后进行菌液PCR鉴定,鉴定正确后提取重组质粒进行酶切鉴定,将鉴定正确的重组质粒送北京六合华大基因科技有限公司进行测序,测序正确后进行保存备用,并将正确的重组质粒命名为pET-ORF112。
1.2.3 重组蛋白ORF112的表达纯化 将构建的pET-112重组质粒转化至表达菌BL21(DE3)中,37℃振荡培养至OD 600 nm值为0.4~0.9时,加入IPTG至终浓度为1.0 mmol/L,进行诱导表达,同时设pET-112重组质粒转化菌的未诱导表达进行对照,于4℃离心收集菌体置于冰浴中超声裂解。然后10 000 r/min离心10 min,分别收集上清与沉淀,进行SDS-PAGE鉴定后用北京全式金生物技术有限公司的镍柱His-Bind Column(Ni-NTA)纯化系统纯化GTPV的ORF112重组蛋白。
1.2.4 重组蛋白ORF112的Western blot鉴定 取纯化的ORF112重组蛋白稀释液进行SDS-PAGE分析,电泳分析后将蛋白转印至PVDF膜上,置入50 g/L的脱脂奶粉液中4℃过夜封闭,PBST洗膜3次,每次10 min,加入GTPV全病毒血清置于37℃孵育2 h后,PBST洗膜3次,将HRP标记的兔抗小鼠IgG用PBST以1∶4 000稀释后加入,置37℃孵育2 h后,PBST洗膜3次,最后用15 mg DAB粉末和9 mg CoCl2(H2O)6溶于30 mL PBS混匀,再加入10 μL过氧化氢配置的显色液进行显色后,用PBS终止反应并观察结果。
1.2.5 重组蛋白ORF112的免疫原性分析 将40只4周龄~6周龄雌性Balb/c小鼠随机分为4组,A组:重组蛋白ORF112免疫组;B组:山羊痘活疫苗免疫组;C组:GST标签蛋白免疫组;D组:PBS对照组。按照各组对应抗原共免疫接种3次,初免按照100 μg/只小鼠剂量将各组对应抗原与等体积的弗氏完全佐剂充分乳化后,经腹股沟和脚掌板皮下免疫小鼠,初次免疫后第14天将各组对应抗原与等体积的弗氏不完全佐剂充分乳化后等剂量加强免疫1次,初次免疫后第21天将各组对应抗原等剂量再加强免疫1次。在第3次免疫后0、7、14、21、28 d采集小鼠尾静脉血,分离血清,采用间接ELISA方法检测各组血清抗体水平。
2 结果
2.1 GTPV ORF112基因的扩增
琼脂糖凝胶电泳结果显示,PCR扩增产物大小约为461 bp,与预期的ORF112基因的大小一致(图1)。
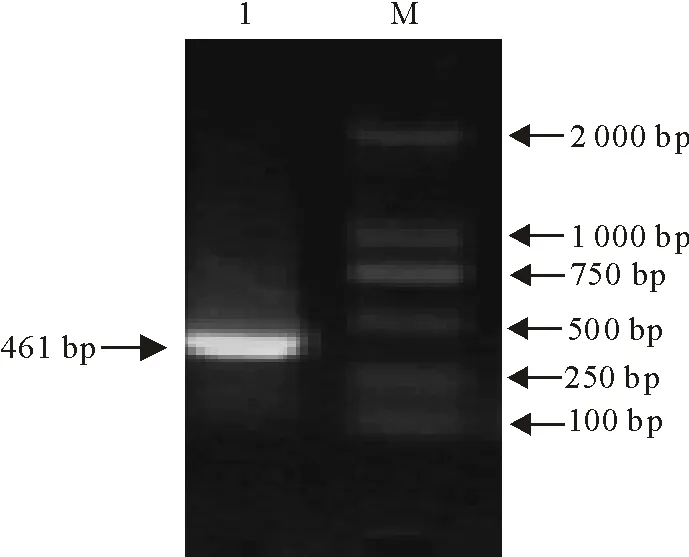
M.DNA标准DL 2 000;1.扩增的ORF112基因M.DNA Marker DL 2 000; 1.PCR-amplified ORF112 gene
2.2 GTPV ORF112基因原核表达载体的构建
将重组质粒pET-112进行Hind Ⅲ+BamHⅠ双酶切,电泳鉴定显示约5 369 bp和461 bp的载体和目的片段,与预期结果一致(图2),测序结果表明表达载体pET-ORF112构建成功。

1.ORF112扩增产物;2.重组质粒pET-ORF112的Hind Ⅲ+BamHⅠ酶切产物;M.DNA标准DL 2 000
1.Products of PCR-amplified ORF112 gene;2.Products of pET-ORF112 digested withHind Ⅲ andBamHⅠ;M.DNA Marker DL 2 000
图2重组pET-ORF112质粒酶切鉴定
Fig.2 Enzyme digestion identification of recombinant plasmid pET-ORF112
2.3 重组蛋白的表达纯化
SDS-PAGE分析显示,诱导后的重组菌pET-112/BL21(DE3)在约23 ku处可见一条特异的蛋白条带,大小与预期一致,且主要以可溶性的形式存在,对其进行了纯化获得了纯度较好的目的蛋白(图3)。
2.4 重组蛋白的Western blot鉴定
Western blot结果显示,制备的重组蛋白可与GTPV全病毒血清发生特异性反应,在约23 ku处可见印迹条带,而阴性对照未见该条带(图4)。表明ORF112蛋白在该表达系统中获得了表达且具有较好的抗原性。

M.蛋白分子质量标准;1.未诱导的重组质粒pET-ORF112阳性BL21菌体蛋白;2.诱导后的重组质粒pET-ORF112阳性BL21菌体蛋白;3.纯化后的重组蛋白ORF112
M.Protein molecular weight Marker; 1.pET-ORF112 without induction; 2.The expression products of pET-ORF112 with IPTG induction; 3.Purified recombinant ORF112
图3 SDS-PAGE分析重组蛋白ORF112表达与纯化
Fig.3 SDS-PAGE analysis of expression and purification of fusion protein ORF112

M.蛋白分子质量标准;1.纯化的重组蛋白ORF112;2.阴性对照
M.Protein molecular weight Marker; 1.Purified ORF112 recombinant protein; 2.Negative control
图4 Western blot鉴定重组蛋白ORF112
Fig.4 Western blot identification of recombinant protein ORF112
2.5 重组蛋白ORF112免疫小鼠血清抗体水平ELISA检测结果
各试验组小鼠血清抗体效价ELISA检测结果见表1。从表1可知,免疫后7 d,注射重组蛋白ORF112免疫组和山羊痘疫苗组的抗体水平开始升高,且显著高于GST标签蛋白免疫组和PBS对照组的,14 d时抗体水平达到最高。山羊痘活疫苗组的抗体水平也显著高于重组ORF112蛋白组。而GST标签蛋白免疫组和PBS组的抗体水平没有明显变化。结果说明,表达的ORF112蛋白具有较好的免疫原性。

表1 血清抗体水平ELISA检测检测
3 讨论
山羊痘病毒可引起山羊和绵羊的羊痘,该病主要经呼吸道、消化道及损伤的皮肤传染,常呈暴发性或地方性流行,在我国西北、东北及华北地区均有流行,特别是内蒙、甘肃、青海等地区常呈暴发性流行[9-10],各年龄段的羊对本病均易感,幼龄羊易感性最高,病死率可达50%以上,还可导致母羊流产[11],给养羊业的发展造成巨大威胁以及严重的经济损失。
山羊痘病毒基因组有147个开放阅读框(opening read frame,ORF),编码产物在53个~2 027个之间,中心编码区主要编码各种转录酶和修饰酶及结构蛋白等,两边的末端反向重复序列主要编码与免疫调节和逃避相关的蛋白,如趋化因子结合蛋白、IL-10、EGF蛋白、PKR抑制剂、丝氨酸蛋白酶抑制剂等[7-12]。国内外对于山羊痘病毒蛋白的研究多集中在囊膜蛋白p32上,因为该蛋白是世界各地所有分离鉴定的山羊痘病毒所共有且特有的蛋白,又是山羊痘病毒的主要结构蛋白,能够刺激免疫机体产生中和抗体。p32蛋白全段表达比较困难,而截短后的P32基因片段的表达虽然容易了,但表达蛋白的抗原性和免疫原性却较差,所以针对山羊痘病毒的检测与亚单位疫苗研究必须探索新的蛋白。研究表明,GTPV ORF112蛋白与痘苗病毒A27L蛋白具有很高的同源性[13],痘苗病毒A27L蛋白在病毒与细胞的黏附过程中发挥重要作用,能够诱导机体产生高水平的中和抗体[14-16],所以对于GTPV ORF112蛋白非常有必要进行更进一步研究。本研究扩增了GTPV ORF112基因并将其克隆至原核表达载体pET-28a(+),进行了诱导表达,进行了表达条件的优化,探索出在IPTG浓度为1.0 mmol/L时低温低转速诱导表达效果较好,GTPV ORF112蛋白没有信号肽和跨膜域等特殊结构,易于实现其全长基因的原核表达,较p32蛋白容易表达。本研究获得了ORF112蛋白较高水平的可溶性表达,对ORF112蛋白多抗血清的制备与其功能的研究具有重要作用。
本试验对ORF112蛋白进行了纯化,用GTPV全病毒血清作为一抗进行了Western blot反应,结果表明ORF112蛋白具有较好的抗原性;用鉴定纯化的ORF112蛋白免疫接种小鼠,采用ELISA方法对小鼠血清抗体水平检测发现,ORF112蛋白免疫组抗体水平与PBS对照组的差异显著,表明ORF112蛋白具有良好的免疫原性。ORF112蛋白相较于p32蛋白易于表达,又与GTPV全病毒血清在免疫反应方面表现出较强的特异性,加之ORF112蛋白具有良好的免疫原性, 所以为山羊痘病毒病的诊断与疫苗研究方面创造了条件,为山羊痘病毒致病机理研究奠定了基础。
