常春油麻藤离体再生体系建立试验
2018-10-12游云飞
游云飞
(福州植物园,福建 福州 350012)
常春油麻藤(MucunasempervirensHemsl)别名牛马藤、常春黎豆藤,为豆科(Leguminosae)油麻藤属(Mucuna)常绿木质藤本,适应性强,南方各省大部分地区都有分布,是一种优良的绿化观赏植物,能在不同生长条件下迅速形成景观[1-2]。常春油麻藤可防暑降温,吸滞尘埃,减少噪音,净化空气,并且对硫、氯气等有害气体有较强的吸附能力和净化能力,可利用它进行环境治理,净化空气,美化环境,稳固土壤,提高环境质量,起到良好的生态防护功能[3-4]。在药用方面,常春油麻藤全株可供药用,性温,味苦,具有活血、通经活络之功效,主治关节风湿痛、跌打损伤、血虚等[5],同时常春油麻藤茎皮可织草袋及造纸,枝条可编箩筐,块根可提取淀粉,种子可食用和榨油[6]。
我国有关常春油麻藤的研究主要集中在生长抗逆性和开发应用等方面,何铮昳等[7-9]对昆明地区种植常春油麻藤进行物候观测研究,得出常春油麻藤生长状况存在一定的差异性;芦夕琴等[10]在常春油麻藤开发利用中得出必须加强对常春油麻藤现有资源的保护,扩大人工种植面积,且种子、茎皮均具备药用价值,应加深综合利用程度。针对目前市场对常春油麻藤植株的旺盛需求,本研究对常春油麻藤进行离体繁育研究,避开季节限制进行大量繁殖,以期提高常春油麻藤繁殖速率和效益,为常春油麻藤植物资源保育和产业化应用提供技术支持和实践依据。
1 材料与方法
1.1 供试材料
供试材料采自福建闽清黄楮林原始森林内,选用种皮饱满、无病虫害,成熟度分别为30%(6—7月采集)、60%(8—9月采集)、90%(10—11月采集)、100%(11—12月采集)荚果种子为繁育外植体(图1a~图1c)。

图1 常春油麻藤荚果及种子
1.2 试验方法
1.2.1 外植体消毒处理 剥去荚果外壳,取出种子置于饱和漂白粉上清液中泡洗15 min后用流水冲洗干净,双蒸水冲荡2~3次,置超净工作台上用75%酒精浸泡30 s,0.1%升汞进行消毒,消毒处理时间分别为5、7、9、11、13、15 min。消毒完毕后用无菌水冲洗3~4遍并用消毒滤纸吸干接种材料表面水分,用手术刀和枪状镊配合切除种子外壳种皮部分,接入经高压灭菌的MS培养基上,接种种子斜插于培养基上,每瓶接种1~2粒,每个处理接种20瓶,试验重复3次。随时观察记录种子萌发情况,14 d后统计污染率:污染率(%)=(污染外植体数/接种总数)×100%。
1.2.2 不同植物生长调节剂浓度配比组合下胚芽的诱导 以MS为基本培养基,设置6-BA(1.0、1.5、2.0、2.5、3.0 mg·L-1)与KT 1.0 mg·L-1和NAA 0.5 mg·L-1配合共5个处理,研究不同浓度植物生长调节剂组合对胚芽启动培养的影响。当胚芽植株茎段达到高5~6 cm时,切下1~2 cm上胚轴茎段,接种在茎段芽诱导培养基中,每瓶培养基接种2~3个茎段,每个处理接种30瓶。30 d后观察记录常春油麻藤外植体的变化情况并统计芽的分化率以及芽诱导率:分化率(%)=(分化芽数/接种数)×100%,芽诱导率(%)=(芽诱导种子个数/种子总个数)×100%。
1.2.3 不同植物生长调节剂浓度配比下不定芽的增殖 以MS为基本培养基,设置6-BA 2.0 mg·L-1、NAA 0.3 mg·L-1、KT 0.5 mg·L-1与TDZ(0.005、0.01、0.02、0.03、0.04 mg·L-1)配合,共5个处理,研究不同浓度植物生长调节剂配比对不定芽增殖的影响。将腋芽诱导成功的植株按上部、中部切割成带一腋一芽的茎段接种在不定芽增殖培养基上,每瓶接种2~3个带芽茎段,每个处理接种30瓶,重复3次。30 d后观察记录常春油麻藤芽增殖情况并统计其增殖系数。诱导芽分化率(%)=(愈伤块数/总愈伤块数)×100%。
1.2.4 不同光照时间和光照强度下芽增殖诱导培养 设置不同光照时间(0、4、8、12、14 h)及不同光照强度(0、500、1000、1500、2000 lx),研究不同光照时间和光照强度对诱导芽增殖培养的影响,每个处理10瓶,重复3次。30 d后统计不同条件下芽增殖诱导率:芽增殖诱导率(%)=(芽增殖诱导个数/总个数)×100%。
1.2.5 不同植物生长调节剂浓度配比下壮苗培养 以MS为基本培养基,6-BA 1.0 mg·L-1、KT 0.5 mg·L-1、NAA 0.3 mg·L-1与IBA(0.5、1.0、1.5、2.0、2.5 mg·L-1)配合,共5个处理,研究不同IBA浓度配比组合对不定芽壮苗培养的影响。当增殖芽高度达到3~4 cm时,将生长健壮的无根植株单株进行分离切割,接种在壮苗培养基上,每瓶接种2~3株,接种30瓶,重复3次。观察并记录壮苗情况。
1.2.6 不同比例基本培养基生根诱导 以MS为基本培养基,设置MS、1/2 MS、1/3 MS、1/4 MS、1/5 MS共5个处理,每个处理包含IBA 0.5 mg·L-1、BA 2.0 mg·L-1、NAA 0.3 mg·L-1,研究基本培养基大量元素含量变化与植物生长调节剂配比对不定芽生根的影响。当植株生长高达4~6 cm时,将经壮苗培养的无根植株转接到生根培养基上进行根诱导培养,每瓶接种1~2株,接种30瓶,重复3次。记录并统计常春油麻藤无根植株生根情况:生根率(%)=(生根苗数/总苗数)×100%。
1.2.7 培养条件 以上培养基在胚芽诱导、不定芽继代增殖培养阶段均添加蔗糖20 g·L-1,壮苗生根培养阶段添加蔗糖25 g·L-1,固化用琼脂粉5.6 mg·L-1,活性炭1.0 g·L-1,pH值5.8。培养温度(23±2) ℃,光照强度1000~2000 Lx,光照时间10 h·d-1。
1.2.8 炼苗移栽 经生根培养后选择生长状态良好的瓶苗进行炼苗。在自然光照状态下炼苗培养7~10 d,松开瓶盖1/2炼苗1~2 d,然后将瓶盖完全揭开炼苗1~2 d。移栽基质体积比为泥炭土∶珍珠岩∶蛭石=5∶1∶2,移栽时,用镊子把移栽苗小心地从培养瓶内取出,用自来水清洗干净附着在根部的残留培养基,应避免伤及根部,适当沥干(水不滴落),移入已准备好的基质中并压实浇足水分后摆放在阴凉通风处。
1.3 数据处理
数据采用SPSS 21.0数据统计软件进行方差分析和多重比较分析(Duncan′s)法。
2 结果与分析
2.1 腋芽诱导
2.1.1 不同消毒时间对常春油麻藤外植体污染的影响 由表1可以看出,不同成熟度种子在不同消毒时间污染变化的趋势相同,30%、60%、90%、100%成熟度种子在消毒时间增加的情况下,污染率先下降后上升。消毒时间为5、7、9、11 min时,不同成熟度种子随着消毒时间的增加而污染率下降;当消毒时间达到13、15 min时,污染率又呈现明显上升的趋势,种子生物活性被破坏,增加了污染率;消毒时间为11 min时达到最低峰,即污染率最低状态。因此,常春油麻藤种子接种最适消毒时间为11 min,污染率为1.67%。
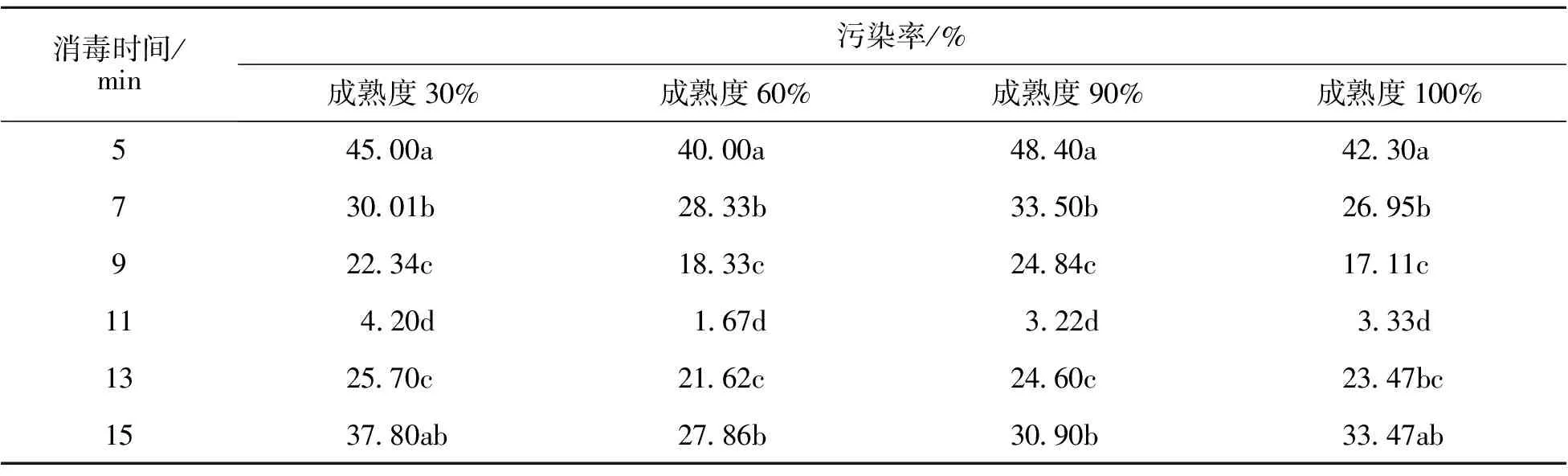
表1 不同消毒时间对常春油麻藤外植体污染的影响
*:不同小写字母为差异显著。
2.1.2 荚果种子成熟度对芽诱导率的影响 由图2、表2可以看出,种子不同成熟度对芽诱导率有很大影响,成熟度60%种子有利于种子萌发,芽诱导率最高达到70.45%;其次为成熟度90%种子,芽诱导率达到50.64%;成熟度30%种子太幼嫩,组织结构尚稚嫩,芽诱导率最低,仅5.00%;成熟度100%的种子由于发育完全,诱导率在相同条件下保持在19.6%,与其它处理差异显著。

图2 不同成熟度荚果芽诱导生长情况
2.1.3 不同植物生长调节剂浓度配比组合对腋芽诱导的影响 由表3看出,在不同浓度的BA溶液处理条件下,成熟度30%的种子表现不敏感,这与外植体过于幼嫩,胚尚未形成相关;成熟度60%的种子芽诱导率均高于成熟度90%的种子和成熟度100%的种子。

表2 荚果种子成熟度对芽诱导率影响
随着BA浓度增加,芽诱导率表现出先升后降的趋势,变化较明显,各试验组变化趋势相同,BA 2.0 mg·L-1时达到最大值,成熟度30%诱导率为13.22%,成熟度60%诱导率为70.45%,成熟度90%诱导率为45.46%,而成熟度100%诱导率仅为24.16%;BA浓度继续增加,达到2.5、3.0 mg·L-1时,芽诱导率有明显下降,不同成熟度种子芽诱导率表现出相似的变化情况。成熟度100%的种子胚芽诱导率极低,不会随BA浓度变化表现出明显的差异性。常春油麻藤种子胚芽诱导率会因为采摘时间不同而生长状态明显不同,成熟度60%的种子芽诱导率远远高于成熟度100%的种子。诱导种子发芽的最适成熟度为60%,最适宜的BA溶液质量浓度为2.0 mg·L-1。
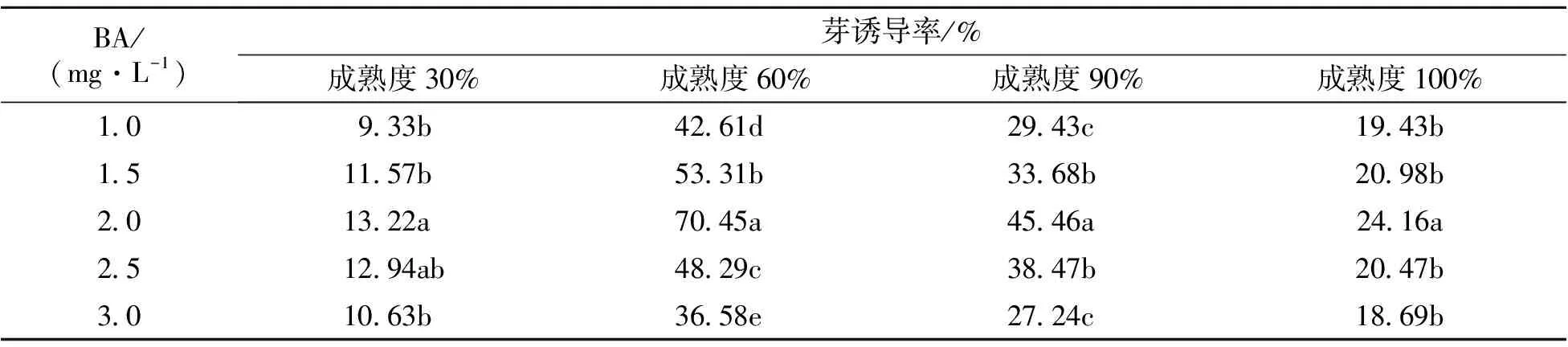
表3 不同植物生长调节剂浓度组合下各成熟度种子芽诱导率
*:每处理均添加KT 1.0 mg·L-1+NAA 0.5 mg·L-1。
2.2 不定芽增殖培养
2.2.1 不同TDZ浓度对芽分化率的影响 由表4、图3可看出,TDZ 0.01、0.02 mg·L-1能缩短芽分化时间;TDZ 0.03 mg·L-1在15 d以前会有较小促进分化作用,15 d以后则抑制芽分化并停止生长;而TDZ 0.04 mg·L-1溶液则会抑制芽的分化。经过TDZ 0.02 mg·L-1溶液处理的试验组,茎段芽分化率在25 d左右达到最大值;没有加入TDZ溶液的对照组,45 d左右分化率达到100%。说明TDZ 0.02 mg·L-1溶液能减少约20 d时间达到100%分化率,即最适TDZ质量浓度为0.02 mg·L-1。

表4 不同TDZ浓度对芽分化率的影响
*:每处理均添加6-BA 2.0 mg·L-1+NAA 0.3 mg·L-1+KT 0.5 mg·L-1。

图3 TDZ不同浓度处理对芽分化的影响
2.2.2 光照时间和强度对诱导芽增殖培养的影响 由表5可看出,不同光照时间下,随着光照强度的增加,增殖率先增加后减小,1500 lx时达到最大值。在500、2000 lx强度下,不同光照时间内芽的诱导增殖率变化不明显,差异不显著,在1500 lx强度下,随着光照时间的增加,增殖率先增加后减小,12 h达到最大值,并与其它组合差异显著。诱导芽的增殖培养最适光照时间为12 h,最适光照强度为1500 lx,此条件下诱导率能达到最大值70.33%,当光照时间或光照强度高于或低于这个值时,均不利于芽增殖和诱导。
2.3 不同植物生长调节剂与IBA组合对壮苗的影响
诱导后的生长植株茎节纤细弱小,应进一步将芽苗转接到壮苗培养基上培养,由表6、图4可知,培养10 d茎段开始增粗和伸长,茎纤维逐渐增强,但仍较弱小,叶片尚未展开;培养20 d茎段继续生长,同时叶片也开始展开,叶片呈浅绿色;培养30 d,茎段及叶片长势良好。IBA 1.0 mg·L-1处理最佳。
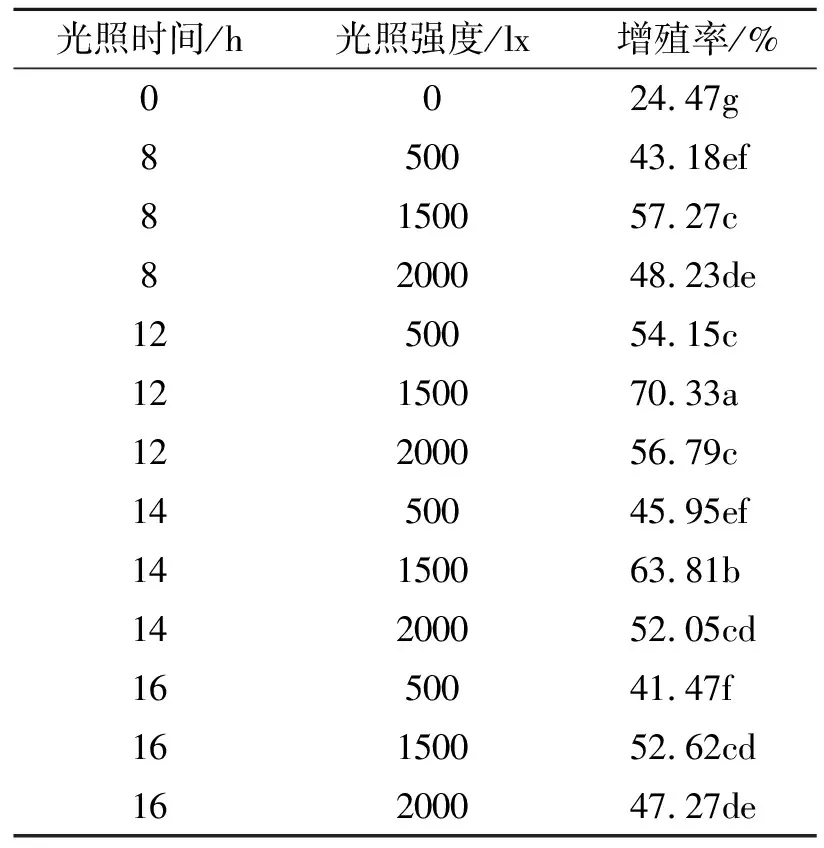
表5 不同光照时间和强度对芽增殖诱导的影响

表6 壮苗培养生长情况
2.4 生根培养
2.4.1 基本培养基大量元素比例对无根苗生根的影响 由表7可知,大量元素浓度较低时,能促进常春油麻藤无根苗生根,长势好。随着大量元素浓度增加,生根率下降,长势变差;当大量元素浓度达到最高时,其生根率为最低,甚至停止生长。由此可知,常春油麻藤无根植株在基本培养基1/2 MS上生根效果最好,1/2 MS培养基可作为常春油麻藤无根苗生根培养的最佳选择。
2.4.2 不同浓度IBA培养基组合对无根苗生根的影响 由表8可知,不同浓度的IBA溶液都能在一定程度上促进生根,其中IBA 1.0 mg·L-1溶液生根长度最大,根长达到9.54 cm。

图4 壮苗培养
2.5 炼苗移栽
由于常春油麻藤适应性强,只要保证苗期水分供应及肥料的适当补充,常春油麻藤生长良好,移栽成活率可达90%以上(图5)。
3 小结与讨论
3.1 取材时间
外植体取材时间相对于种子成熟度和常春油麻藤再生体系建立有着重要的影响,不同取材时间对种子成熟状态和诱导萌发有影响,本研究表明成熟度越高的种子芽诱导率越低,污染率越高,褐化现象严重,选择成熟度60%种子芽诱导率高。
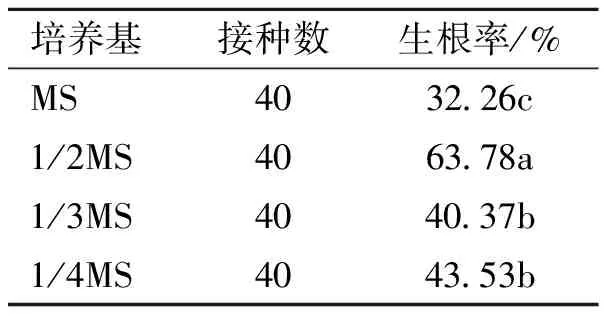
表7 大量元素含量对无根苗

图5 生根及移栽
由于常春油麻藤为热带、亚热带植物,在6月份的时侯会出现生殖生长和营养生长重叠的现象[8-10],植物的各个部位为了争夺营养提升竞争力,芽和果实都有很高的生活力;而10月份以后的成熟果实由于缺少竞争,生活力也自然会低于6月份的果实,选择此时的果实作为接种材料将大大提高种子发芽率。

表8 IBA不同浓度对生根长度的影响
6—7月成熟度30%的种子,组织结构尚稚嫩,一方面胚尚未完全发育形成,成熟度过于幼嫩的种胚萌发率通常不到5.00%,有的甚至完全不萌发;另一方面是种脐剥除及部分种皮切除后种胚汁腋丰富,经过消毒处理,会受消毒剂的毒害,离体培养阶段容易产生褐化现象。完全成熟的种子,褐化死亡少,但萌发率低(一般不到5%),有的长时间不萌发。而成熟度60%的种子经切除种脐消毒处理,极少发生褐化现象,萌发率达70.45%,而且萌发快,萌发时间短,一般在15 d便开始萌动,25 d胚芽高度可达4 cm,且有叶片长出。成熟度90%种子,种脐黑色,并包围着种子的3/4,褐化现象严重,萌发率低,生长缓慢。成熟度100%的种子褐化现象更严重,芽诱导率极低。需要指出的是,接种后15 d的暗培养至关重要,可避免因多酚复合物质的产生,而导致培养外植体褐化毒害而死亡,种子成熟初期胚尚未完全发育形成难以诱导,而种子完全成熟后期诱导率呈下降趋势,因此选择合适的种子成熟期是技术的关键。
3.2 光照条件
常春油麻藤在自然情况下生长于海拔300 m以上,需要较强的光照强度和较长的光照时间,才能满足其生长发育的要求;而试验以及驯化过程中,在温度水分各方面环境条件都优于其生长的自然环境下,需要适当降低光照强度,达到培养和驯化目的。试验培养过程中光照强度过高时,组培苗将出现叶片变白、茎段顶部褐化、植株停止生长并且死亡等现象。光照时间应保持在12 h·d-1左右,当光照时间低于12 h·d-1时,瓶苗得不到充分光照,生长缓慢,长势较差;当光照时间太长时,瓶苗正常生长代谢被破坏,生长也会受到影响。
3.3 污染的原因及解决方法
由于种子大、种皮厚且硬,去除种皮难,所以种皮内的大量细菌和真菌就存活下来,直接导致污染。为解决这一污染现象,一种方法就是将已经发芽的种子再进行一次消毒,这样虽然达到了消毒的目的,但会影响种子的活力。本试验采取的是常规方法与降低温度的方法,将接种室温度降至12 ℃左右,并在接种过程中,更加频繁更换滤纸和进行手术刀、镊子和培养皿消毒,极大地降低污染率。更完善的方法还有待以后的进一步研究。
3.4 褐化现象及解决方法
由于种子大,种皮厚,种皮带红色、褐色或黑色,黑色种脐包围着种子的3/4,易出现褐化现象,同时光强太强,培养苗易出现褐化现象,即四周出现黑色小斑点,应降低光强,褐化现象可以得到改善,所以在开始培养之前就应将光强设置到适当值;并进行多次转移后,褐化现象逐渐消失。
