肾部分切除和根治性肾切除术治疗T1b期肾癌疗效和预后比较的Meta分析
2018-10-12姜义鹏刘勇闫炳霖王国栋冷红刚
姜义鹏 刘勇 闫炳霖 王国栋 冷红刚
1青岛大学医学院 266100 山东青岛 2中国人民解放军海军第971医院泌尿外科
肾癌是成人肾脏最常见恶性肿瘤[1],根据泌尿小管的不同部位分成各种亚型,占成人恶性肿瘤的2%~3%。目前,肾癌发病率以每年约2%的速度递增,是泌尿系肿瘤中致死性最强的肿瘤,对放疗、化疗等常规肿瘤治疗方法均不敏感[2]。手术是肾癌的首选治疗手段,也是目前可治愈肾癌的唯一方法[2, 3]。根治性肾切除术(radical nephrectomy, RN)被认为是治疗局限性肾癌(患肾、肾周脂肪、Gerota筋膜、肾门淋巴结、同侧的肾上腺以及输尿管上段)的“金标准”[4]。但若是孤立肾或双侧肾癌患者,RN术后将终身透析。随着医学技术的不断发展,肾部分切除术(partial nephrectomy, PN) 肿瘤控制效果与根治术一样,且能够保留肾功能[5, 6],提高了患者术后生活质量,成为了肾癌T1a期(肿瘤直径≤4 cm)治疗的新标准。但对于T1b期肾癌(4 cm<肿瘤直径≤7 cm)是否可以选择行PN尚存争议。我们通过Meta分析比较RN和PN的疗效,了解两种手术方式5年肿瘤特异生存率、总生存率、术后慢性肾脏病(chronic kidney disease, CKD)发生率、术后肾小球滤过率(glomerular filtration rate, GFR)的变化,旨在为临床上选择T1b期肾癌的手术方式提供循证医学证据。
1 资料与方法
1.1文献检索
检索时间为2000年1月1日~2017年6月30日。检索中国生物医学文献数据库(China biology medicine disc, CBMdisc)、中国期刊全文数据库(China national knowledge infrastructure, CNKI)、维普数据库(VIP database, VIP)、万方数据库(Wanfang data)、PubMed、荷兰医学文摘数据库(excerpta medica database, EMBASE)、Web of science等中英文数据库。中文检索策略:根治性肾切除术、肾部分切除术、肾细胞癌、T1bN0M0;英文检索策略:partial nephrectomy、radical nephrectomy、Carcinoma, Renal Cell、T1bN0M0。采用专业检索式检索、手工检索相关参考文献。
1.2文献纳入和排除标准
纳入标准:①局限性肾肿瘤,肿瘤单侧单发对侧肾功能正常,分期为 T1bN0M0期肾癌患者; ②研究类型为临床对照研究文献;③随访期是否够长,足以观测到结局的出现,平均随访时间不小于5年;结局指标为5年肿瘤特异性生存率、总生存率、术后CKD发生率、术后GFR下降率;④语种限于中文和英文。排除标准:①重复发表的文献;②研究结果无法提取或转化分析所需数据;③案例报告、综述等文献;④非对照性研究及未提供配比条件的研究;⑤合并有其他肿瘤史者。
1.3文献信息提取
按照既定的文献检索策略,由2名研究者同时且独立完成文献筛选和信息提取工作,若有意见不一致则咨询第3名研究者协助解决。随后采用统一的表格记录每一篇文献内容,包括第一作者、发表年份、发表杂志、研究对象、研究设计、病例一般信息(病例总数、病例种类、性别、年龄)、患者的情况、PN和RN术后5年肿瘤特异性生存率、总生存率、术后CKD发生率、术后GFR下降变化。
1.4文献质量评价
采用纽卡斯尔-渥太华量表(the Newcastle-Ottawa Scale, NOS)对纳入文献进行质量评价。该量表由3大块8个条目来评价队列研究或病例对照研究[7],具体包括:研究人群选择、组间可比性、暴露评价或结果评价等。每一条分为0~2分。最高分共9分。质量评价由2名研究者同时独立完成,若有意见不一致时咨询第三人。
1.5统计学方法
本研究采用统计软件Stata 13.0合并数据。主要从5年肿瘤特异性生存率、总生存率、术后CKD发生率、术后GFR下降率4种结局指标进行分析。经异质性检验,若各研究间同质(P>0.10、I2<50%),则认为纳入文献不存在异质性,采用固定效应模型进行Meta分析;若各研究间不同质(P<0.05、I2>50%),说明各研究间存在异质性,采用随机效应模型进行Meta分析,作森林图。采用Begg和Egger检验发表偏倚,做漏斗图,并进行敏感性分析证明结果的稳定性。
2 结果
2.1纳入文献质量评价与异质性分析
采用NOS量表对纳入文献进行质量评价,文献质量较高,文献评分都在5分以上;研究对象的选择有较好表性,对异质性进行分析和统计学检验,不同文献5年肿瘤特异性生存率合并的异质性为Q=6.41,I2=0.00%,P=0.845。 详见表1。
2.2纳入文献特征
建议进行河道清障、底泥疏浚,清除一些底泥污染;在岸边栽植水生植物,提高净水效果;考虑养殖水浮莲。据介绍,一亩水浮莲短期内可以吸收氮50 kg、磷10 kg,对水体中的酚、汞、铅、镉、砷等也有极强的富集能力,可提高水体自净的速度。
依据纳入与排除标准,本研究共纳入13篇文献[8~20],共包括34 908例患者,PN组4 051例,RN组30 857例,其中12个研究进行了PN和RN术后5年肿瘤特异性生存率的比较,7个研究进行PN和RN术后总生存率的比较,5个研究为PN和RN 术后CKD生存率的比较,2个研究进行PN和RN术后GFR下降变化的比较。
2.3PN与RN的5年肿瘤特定性生存率比较
12项研究[8~19]比较了5年肿瘤特定性生存率。各研究间无异质性(Q=6.41,I2=0.00%,P=0.845),采用固定效应模型合并分析。Meta 分析结果发现,PN和RN的5年肿瘤特定性生存率差异无统计学意义(HR=1.01,95% CI=0.85~1.20)(图1。)。

表1 13篇T1b肾癌患者PN和RN预后比较文献的基本情况及质量评分

图1 PN与RN的5年肿瘤特定性生存率比较森林图
2.4PN与RN的总体生存率比较
7项研究比较了PN与RN的总体生存率[8, 9, 11~13, 15, 19]。各研究间存在同质性(Q=96.36,I2=93.8%,P<0.001) ,采用随机效应模型合并分析。Meta分析结果表明,PN与RN的总体生存率差异无统计学意义(HR=0.71,95% CI=0.35~1.42)(图2)。
5项研究比较了PN与RN的术后CKD发生率[8, 9, 11, 15, 20]。研究间不存在异质性(Q=4.90,I2=18.4%,P=0.298 ),采用固定效应模型合并分析。Meta分析结果表明,PN术后CKD发生率低于RN ,差异有统计学意义(OR=0.38,95% CI=0.28~0.51)(图3)。

图2 PN与RN的总体生存率比较森林图
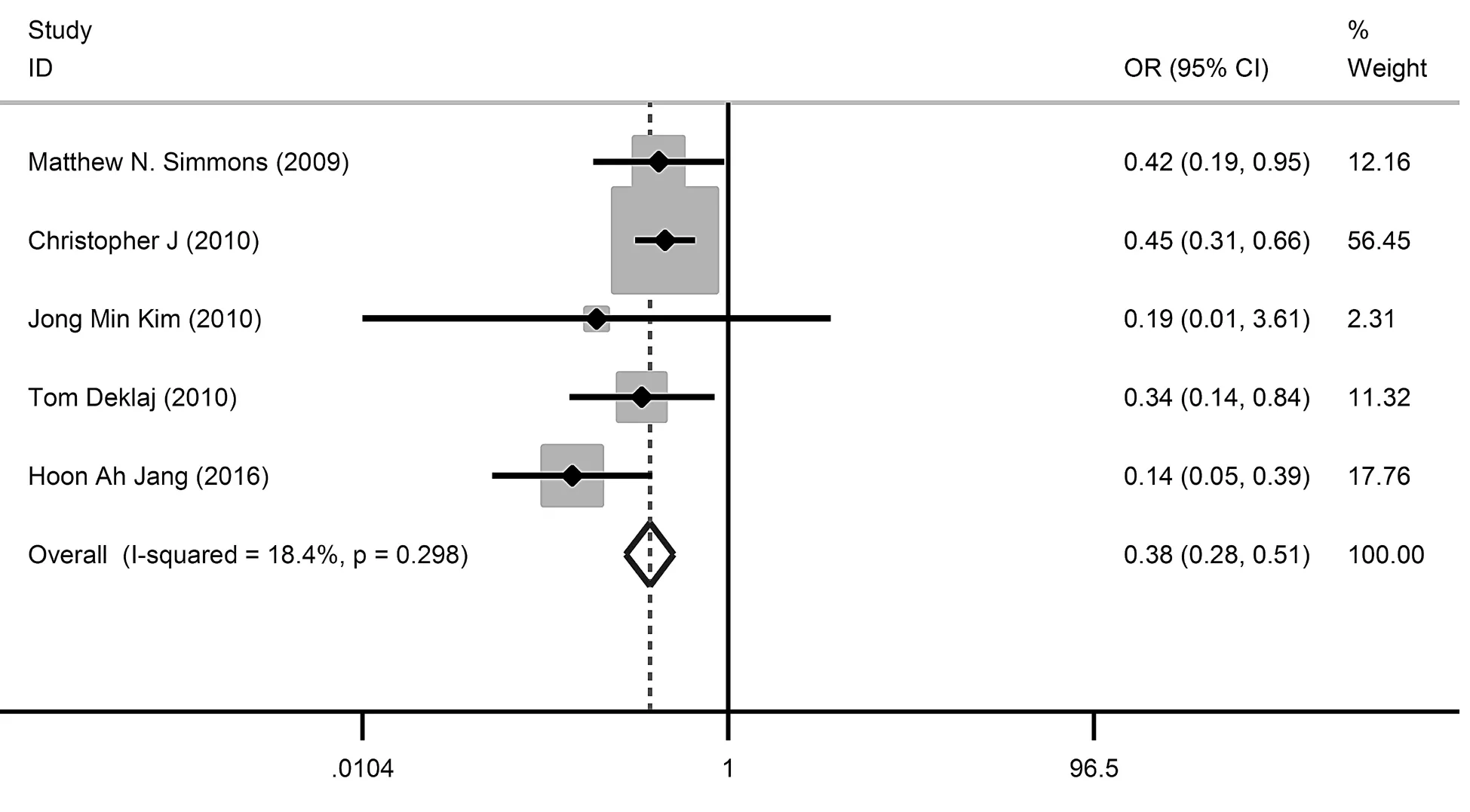
图3 PN与RN的术后CKD发生率比较森林图
2.6PN与RN的术后GFR下降变化比较
2项研究[9, 15]比较了PN与RN术后GFR的下降变化。研究间无异质性(Q=0.04,I2=0.00%,P=0.835) ,采用固定效应模型合并分析。Meta分析结果表明,PN的术后GFR下降变化低于RN,差异有统计学意义(SMD=-0.46,95% CI=-0.79~-0.14)(图4)。
2.7发表偏倚分析
PN与RN的5年肿瘤特定性生存率的发表偏倚的漏斗图如图5所示。漏斗图显示两侧对称,提示没有明显发表偏倚。同时,Begg's检验(z=0.57,P=0.566)和Egger's 检验(t=1.12,P=0.267)也提示没有明显发表偏倚(图5)。

图4 PN与RN的术后GFR下降变化比较森林图

图5 发表偏倚漏斗图
3 讨论
多年来,由Robson等创立的RN一直是治疗局限性肾癌的金标准[4]。但术后患者的对侧肾单位代偿性血流负荷增加,肾功能损伤甚至肾功能衰竭,严重影响患者的生活质量[21]。随着医学技术的不断提高,有学者发现PN治疗局限性肾癌能保证患者良好的无瘤生存率,最大程度的保存残肾的肾单位和残肾功能,而肿瘤控制效果与RN相似[22, 23]。既往大多数学者认为对于T1a期的肾癌患者,PN是优于RN的首选治疗方式。近年来,很多直径>4 cm或中央型的肾癌成功施行PN[5, 24, 25]。Belldegrun等[26]发现在对于T1b期肾癌患者施行PN和RN,生存率无明显差异。Patard等[5]报道T1b期肾肿瘤患者PN和RN术后远处复发和局部复发差异无统计学意义,进一步说明了PN也适用于T1b期肾癌患者的治疗。
Deklaj等[20]比较了T1b期肾肿瘤行腹腔镜肾部分切除与根治性切除的数据,研究发现,虽然肾部分切除术手术时间较长,术中出血较多,但两组患者术中及术后并发症的发生并无显著差异。Simmons等[9]比较了术后57个月、80个月的无复发存活率、总死亡率、癌症特异性死亡率、中位生存时间、总生存率均相近。
Deklaj等[20]发现肾部分切除术后肾小球滤过率的降低显著低于根治性肾切除术。术后半年随访中,两组患者均无复发。术后第1天RN组GFR下降更明显((RN组47 ml/minvs. PN组10 ml/min;P<0.01),之后PN组肾功能逐渐恢复,但没有达到术前基础水平。术后肾功能下降PN组明显少于RN组。PN组下降12.5%(中位随访15个月),RN组下降29.3%(中位随访21个月),P=0.002。术后肾小球滤过率<60 ml/min的患者,PN组明显少于RN组。PN组为30.3%,RN组为55.7%,P=0.04。
Simmons等[9]发现PN可以更好的保护肾功能,减少血肌酐正常的患者进展为Ⅰ-Ⅱ期CKD,术后CKD进展PN组为45%,RN组为66%,P<0.003。而对于术前即已经出现血肌酐升高的患者(106vs. 88.4 μmol/L;P=0.03),更容易进展为Ⅲ~Ⅳ期CKD(PN组24%vs. RN组31%;P=0.009)。Weight等[8]发现PN组术后GFR的下降明显低于RN组,RN组更多的出现术后CKD。在病理分期和分级相近的情况下两组5年特异性生存率是相近的。但PN具有更好的总生存率(hazard ratio 0.30,95% CI=0.13~0.71),PN组为94.5个月,RN组为82.6个月,P=0.000 1。GFR下降数值PN组为16 ml·min-1·1.73m-2,CI值14~18,RN组为27 ml·min-1·1.73m-2,CI值25~29,P<0.000 1。RN术更易导致术后CKD(odds ratio 3.4,95% CI=2.1~5.6)。所有患者主要死因是肾癌(n=29,50%),其次是心血管疾病(n=13,22%)。本资料两组患者术前心血管疾病是相近的(RN组13%vs. PN组12%,P=0.6),术后心血管疾病的存在导致死亡风险增加了13倍(HR=13.6,95% CI=4.1~52.0,P=0.000 1)。而心血管疾病特异性生存率的主要因素是年龄(HR=1.06逐年递增,95% CI=1.01~1.11,P=0.025)和术后GFR<60(HR=3.9,95% CI=1.26~14.3,P=0.018)。PN通过减少术后肾功能不全的发生,从而减少了术后心血管相关疾病的发病率和死亡率。
Jang等[11]指出估计的10年特异性生存率(PN组85.7%vs. RN组84.4%,P=0.52),5年和估计的10年无进展存活率(progression-free survival, PFS)PN组86.4%、79.2%vs. RN组86.0%和66.1%,P=0.66)。5年PFS和估计的10年PFS及10年肿瘤特异性生存率PN组略高于RN组,但没有显著差异,而估计的10年总生存率(PN组85.7%,RN组73.3%,P=0.003), PN组明显优于RN组。
总之,对T1b肾癌,PN可以完整切除肿瘤,术后切缘阴性率、术后局部复发率较RN无明显差异[9, 20]。最新的一些研究也表明,在手术切除同种族、非内侵性的T1b期肾癌中,选择PN或者RN并不会改变术后的无复发存活率[27]。而且,比较T1b和T2a成功施行PN后,术后无复发存活率也没有变化。这就表明不管PN还是RN,均可达到相同的肿瘤控制效果。有的学者报道PN与RN术后5年肿瘤特异性生存率、总生存率无显著差异,而在10年甚至更长的研究中,PN术后患者eGFR更高,PN术后发生慢性肾脏疾病的概率更低,在多变量分析中,患者的年龄、ASA评分和肿瘤的病理分级是影响总生存率的主要因素,而患者的年龄和肿瘤的病理分级是影响癌症特异性生存率的主要因素。所以PN与RN的选择改变的不是对肿瘤的控制,而主要在于保留了更多有功能的肾单位,减少了CKD的发生,从而降低心血管疾病的发病率、死亡率[28],降低了总死亡率,延长了患者总生存期[8, 11]。
虽然PN围手术期并发症较RN多,手术风险相对较大,但随着手术设备的完善,包括机器人辅助手术的普及、数字肾[29]技术的应用以及操作者手术技巧的不断提高,T1b肾癌行PN将更加安全、有效,PN也必将成为更多术者及患者的第一选择。