氢气作用下硅镁型红土镍矿的低温还原特性
2018-10-11丁志广魏永刚
丁志广, 李 博, 魏永刚
氢气作用下硅镁型红土镍矿的低温还原特性
丁志广1, 李 博2, 魏永刚2
(1. 昆明理工大学 冶金与能源工程学院,昆明 650093;2. 昆明理工大学 省部共建复杂有色金属资源清洁利用国家重点实验室,昆明 650093)
以含镍0.82%、含铁9.67%的某硅镁型红土镍矿为原料开展氢气低温还原实验研究,考察还原温度、还原时间、氢气浓度及矿物粒度对镍、铁金属化率的影响。结果表明:在还原温度为600 ℃、还原时间90 min及氢气浓度为60%(体积分数)的条件下,红土镍矿中镍、铁金属化率分别达到95%和42%。当矿物粒度小于380 μm 时,矿物粒径对镍、铁金属化率的影响并不明显。随着还原温度的升高,镍铁合金([Fe,Ni])的衍射峰呈现先增强后减弱的趋势,在600℃时达到最大。且随着温度的进一步升高,无定型含镁硅酸盐重结晶生成镁橄榄石相,阻碍镍、铁的还原。通过氢气低温还原,矿物中的氧化镍几乎完全还原,部分铁被还原为金属铁与镍形成了镍铁合金,大部分的铁被还原为铁的低价氧化物。
硅镁型红土镍矿;氢气;还原特性;金属化率;镍铁合金
镍因其具有高强度及高腐蚀性而用于生产不锈钢及有色金属合金的主要原材料[1]。在自然界中,镍主要以硫化镍矿和氧化镍矿(红土镍矿)存在[2−3],虽然70%的镍资源存在于红土镍矿,但是只有40%的镍的生产来自于红土镍矿[4−6]。随着高品位硫化镍矿的日益枯竭,低品位红土镍矿逐渐成为生产镍铁的主要原 料[7−9]。
根据铁和氧化镁的含量,红土镍矿可分为褐铁型红土镍矿和硅镁型红土镍矿:前者铁含量高,镍含量低,主要用湿法过程的高压酸浸处理;后者铁含量低,硅、镁含量较高,适合火法过程的电炉还原熔炼[10−11]。本研究中所用红土镍矿属于硅镁型红土镍矿,适合火法处理。
针对红土镍矿的火法处理工艺,诸多学者开展了红土镍矿的气基还原实验研究。UTIGARD等[12]用CO2/H2的混合气作为还原剂在500~1000 ℃温度范围内还原红土镍矿,通过改变H2和CO2混合气体比例对红土镍矿进行还原焙烧实验。得出混合气中的H2/CO2比率对矿物还原金属化率的增加有着显著的影响,比率越大,金属化程度越大,镍的回收率也越高。O'CONNOR等[13]用CO2/H2/N2的混合气作为还原剂讨论了脱羟基对褐铁型红土镍矿还原焙烧的影响,结果表明延长还原时间、提高还原温度以及提高还原性气体的含量,有助于镍的扩散及聚集长大。CARON[14]用H2/H2O和CO/CO2混合气体还原红土镍矿时发现在900 ℃时用90% H2O+10% H2(摩尔分数)或者75% CO2+25% CO(摩尔分数)时镍的金属化率最高。
采用红土镍矿生产镍铁合金作为不锈钢的生产原料,是保障不锈钢工业可持续发展的有效途径之一,极低的镍含量、复杂的镍元素赋存状态以及较高的冶炼成本是低品位红土镍矿的典型特征。本文作者首先采用化学分析、X射线衍射等分析方法,对原矿石的化学成分、物相进行了研究,确定了矿石中镍、铁的含量以及物相特点。进而采用清洁环保的氢气作为还原剂,讨论了还原温度、还原时间、氢气浓度以及矿石粒径等因素对矿石中镍、铁氧化物金属化率的影响。并用X射线衍射(XRD),扫描电子显微镜(SEM)及能谱分析(EDS)等手段对还原样品进行了分析,研究了还原过程中硅镁型红土镍矿的物相和微观结构的 转变。
1 实验
1.1 实验原料
本实验所用红土镍矿的化学成分及XRD分析结果分别见表1和图1。由表1和图1可知,该红土镍矿中Ni的含量0.82%,MgO约31%,SiO2约37%,属典型的硅镁型红土镍矿,适合火法冶炼,其主要矿物组成为利蛇纹石(Mg3Si2O5(OH)4)、石英(SiO2)和磁赤铁矿(-Fe2O3)。由于原矿中镍含量低,并且大部分存在于其他矿物中,因此没有被检测到。实验过程中采用99.999%的氢气作为还原剂,高纯氮气(99.999%)调节氢气浓度和作为保护气。

表1 原矿的化学成分
1) FeTis total Fe content.

图1 硅镁型红土镍矿XRD谱
1.2 还原过程
样品首先经磨样机磨至<74 μm,压片制成粒径为0.250~0.380 mm的颗粒(除研究粒径对镍、铁金属化率的影响外),每次实验称取5 g样品。红土镍矿氢气还原实验设备示意图如图2所示,样品装入石英管中并置于电炉的恒温区,H2与N2的混合气从管式炉顶部通入,底部排出,用质量流量计控制通入气的总流量为30 mL/min。用氮气调节氢气浓度和保护已还原的样品被再次氧化。还原之后的样品在氮气气氛下于管式炉中自然冷却至室温,用于分析。

图2 实验装置示意图
1.3 样品表征
红土镍矿物相组成采用日本理学D/Max−3B型X射线衍射仪(XRD)测定,Cu K射线源,电压35 kV,电流20 mA,扫描速度10 (°)/min,扫描范围2为10°~90°。
还原产物微观形貌采用日本HITACHI−S3400N型扫描电子显微镜分析,采用X射线能谱仪 (EDX,GENESIS60型,美国EDAX公司)进行EDS分析。
样品热重分析采用STA449F3型热重分析仪(TG-DSC,德国Netzsch仪器制造有限公司)。
2 结果与讨论
2.1 差热-热重分析
图3所示为红土镍矿的TG-DSC曲线。由图3可看出,升温过程中出现2个吸热峰和1个放热峰,总质量损失率为12.7%。97℃的吸热峰为残留游离水的脱除[15],未发生物相变化。升温至400℃过程中脱除少量结晶水。红土镍矿高温脱水过程主要是结晶水和结构水脱除,影响原矿的结构[16]。610℃的吸热峰是由于蛇纹石脱除羟基生成了硅酸盐产物,820℃的放热峰表明镁硅酸盐由非晶态转化为结晶度良好的橄榄石相,该过程是放热反应,相关文献也已经对非晶态镁硅酸盐重结晶生成橄榄石相的过程进行了证明[17−19]。可见脱水过程会使矿物结构变化,发生了脱羟基反应和晶型转变。

图3 硅镁型红土镍矿的差热-热重曲线
2.2 热力学基础


图4 氢气还原氧化镍、氧化铁吉布斯自由能与温度之间的关系

图5 氢还原铁、镍氧化物的平衡图[20]
2.3 不同因素对镍、铁的金属化率的影响
2.3.1 还原温度对镍、铁的金属化率的影响
在氢气浓度为60%(体积分数),还原时间为90 min的条件下,镍、铁金属化率随温度的变化趋势如图6所示,实验选取500~1000 ℃的还原温度。
从图6中可以看出,在还原温度为600 ℃时,镍、铁的金属化率较高,分别达到88%和46%,随着温度进一步升高,镍、铁金属化率有所降低,结合不同温度焙砂XRD谱(见图6)可以得出,这主要是由于温度升高至700℃时,无定型镁硅酸盐开始重结晶形成了的橄榄石(Mg2SiO4)物相,镍、铁的氧化物被包覆在橄榄石相中不易还原[17, 21]。随着还原温度升高至800 ℃和900 ℃,镍、铁金属化率有所回升,主要是因为温度升高使部分SiO2与Mg2SiO4反应生成了辉石(MgSiO3),使包覆于其中的镍、铁氧化物被释放出来,从XRD结果中也可以看出,还原温度从700 ℃升高至900 ℃的过程中,石英和橄榄石相逐渐减少,而辉石相的衍射峰逐渐增强。当还原升高至1000 ℃时,镍的金属化率继续提高,而铁的金属化率反而降低,这是因为在此温度范围原料中的铁氧化物参加了固相化合反应[22]:

图6 还原温度对镍、铁的金属化率的影响
(Fe3O4, FeO)+SiO2→2FeO·SiO2,=950 ℃ (1)
生成的低熔点共熔物2FeO·SiO2能够抑制FeO进一步被还原为金属铁[23],因此,铁的金属化率呈现下降的趋势。

图7 不同温度时焙砂的XRD谱
2.3.2 氢气浓度对镍、铁金属化率的影响
在还原温度为600 ℃,还原时间为90 min的条件下,镍、铁金属化率随氢气浓度的变化趋势如图8所示。从图8中可以看出,随着氢气浓度从20%(体积分数)升高到100%(体积分数),镍、铁的金属化率呈现先升高后降低的趋势,氢气浓度为60%(体积分数)时,镍、铁金属化率各自达到实验最佳值。然而整体变化并不明显,这是由于实验所用硅镁型红土镍矿为复杂矿物,该矿物中所含铁氧化物和镍氧化物少,混合气体中的氢气是过量的,因此,氢气含量对镍、铁金属化率的影响并不大。
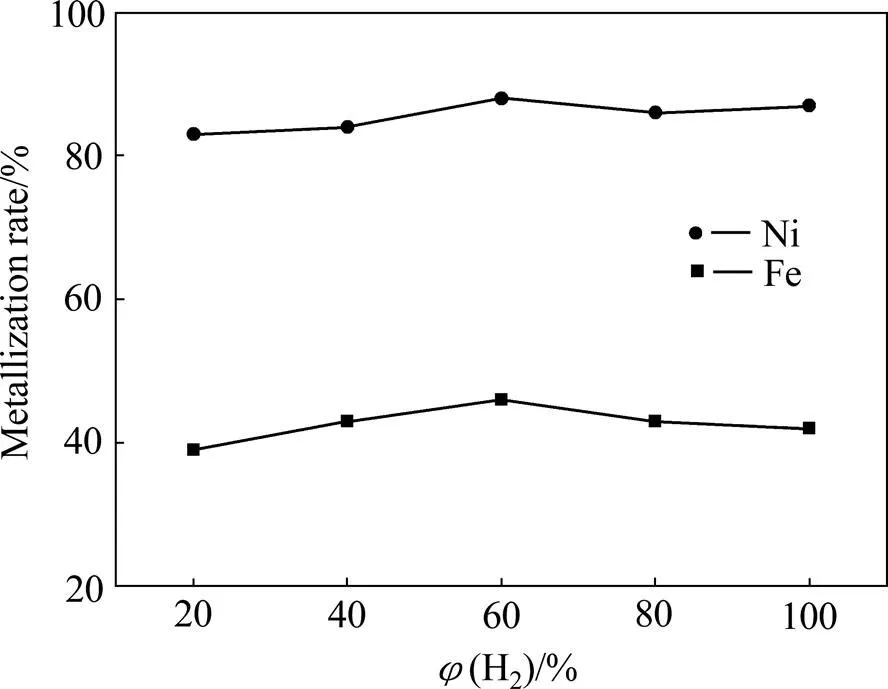
图8 氢气浓度对镍、铁金属化率的影响
2.3.3 还原时间对镍、铁金属化率的影响
在还原温度为600 ℃、氢气浓度60%(体积分数)的条件下镍、铁金属化率随还原时间的变化趋势如图9所示,从图9可以看出,随着还原时间的增加,镍、铁金属化率都呈现增加趋势,当时间由30 min增加至90 min时,镍、铁金属化率上升趋势大致相同,还原时间由90 min增加至120 min的过程中,镍金属化率几乎没有变化。综合考虑,600 ℃还原温度下,还原时间为90 min时,镍、铁金属化率较高,所以最佳还原时间为90 min。

图9 还原时间对镍、铁金属化率的影响
当还原时间较短时,将FeO还原为金属铁的速率要低于磁铁矿还原为FeO的速率,而且矿物中存在的未还原的Fe2O3对NiO的扩散也具有阻碍作用,导致金属化率相对较低。继续延长还原时间,此时更多的还原气体通过内扩散方式扩散到颗粒内部,从而使更多的镍、铁氧化物被还原为金属态的镍和铁,因而镍、铁金属化率也有所提升。从图9中镍、铁金属化率变化的趋势来看,还原时间越长,越有利于镍、铁金属化率的提高,但在90 min以后,延长还原时间,镍、铁金属化率提升的幅度较小,甚至趋于平缓。为了选择合适的还原时间以使镍、铁氧化物得到更为充分的还原,而且也尽可能地降低因还原时间过长造成的能源浪费,选择还原时间为90 min较为合适。
2.3.4 矿物粒度对镍、铁金属化率的影响
在氢气浓度为60%(体积分数)、还原温度为600℃,还原时间为90 min的条件下,研究了矿物粒度大小对镍、铁金属化率的影响,其结果如图10所示。由图10可知,矿物粒度大小对镍、铁金属化率影响并不明显,0.25~0.38 mm时铁金属化率相对较高。根据气−固还原反应动力学,矿物粒度影响着气固动力学条件,当矿物颗粒较大时,其比表面积较小,氢气与固体反应物接触面积较小,影响气固反应速率。此外,形成的金属镍、铁包裹在氧化物颗粒周围,使镍、铁氧化物的还原变得困难,因此,镍、铁的金属化率较低。在一定还原条件下,矿物粒度小时,还原速度快。但当矿物颗粒过小时,会使料柱透气性变差,影响气体在矿物层中扩散,从而使镍、铁的金属化率较低[24]。

图10 矿物粒度对镍、铁金属化率的影响
2.4 还原产物SEM-EDS分析
在氢气浓度为60%(体积分数),还原温度为600 ℃,还原时间为90 min条件下还原产物的SEM像如图11所示,结合EDS分析结果可以得出,样品还原之后部分铁被还原为金属铁,与还原得到的镍形成镍铁合金,但是由于温度较低,镍铁合金颗粒并未长大,大部分的铁仍以低价氧化物的形式存在于硅酸盐矿物中。

图11 硅镁型红土镍矿还原产物SEM像和EDS谱
3 结论
1) 通过氢气低温还原,矿物中的氧化镍镍几乎完全还原,部分铁被还原为金属铁与镍形成了镍铁合金,大部分的铁被还原为铁的低价氧化物。
2) 当还原温度从500 ℃升高600 ℃的过程中,镍、铁的金属化率呈现增加的趋势。还原温度的升高至700 ℃时,生成了复杂稳定的镁橄榄石相,使镍、铁的还原变得困难,随着温度的升高,产生了辉石,使镍、铁氧化物重新被释放出来,继续升高温度至1000 ℃生成低熔点共熔物2FeO·SiO2抑制FeO进一步被还原为金属铁,使铁的金属化率呈现下降的趋势。随着还原时间的增加,镍、铁金属化率逐渐增加,但当还原时间超过90 min时,镍、铁金属化率增加并不明显。氢气浓度及矿物粒度对镍、铁金属化率的影响并不显著。
3) 在氢气浓度为60%(体积分数),还原温度为600 ℃,还原时间为90 min,矿物粒度为0.25~0.38 mm的条件下,镍、铁的金属化率分别达到88%和46%。
[1] LI Hua-bing, JIANG Zhou-hua, ZHANG Zu-rui, YANG Yan. Effect of grain size on mechanical properties of nickel-free high nitrogen austenitic stainless steel[J].Journal of Iron and Steel Research, International, 2009, 16(1): 58−61.
[2] 杨永亮, 高锁山, 高占奎. 红土镍矿冶炼炉渣提镍及再利用的研究和实践[J]. 中国科技纵横, 2012(8): 120−124.YANG Yong-liang, GAO Suo-shan, GAO Zhan-kui. Research and practice on nickel extraction and reuse of laterite nickel ore smelting slag[J]. China Science & Technology Panorama Magazine, 2012(8): 120−124.
[3] 刘志国, 孙体昌, 高恩霞, 王晓平. 蛇纹石矿物的高温相变对红土镍矿直接还原的影响[J]. 中国有色金属学报, 2015, 25(5): 1332−1338.LIU Zhi-guo, SUN Ti-chang, GAO En-xia, WANG Xiao-ping. Effect of high-temperature phase transition of serpentine minerals on direct reduction roasting of laterite nickel ore[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(5): 1332−1338.
[4] FARROKHPAY S, FILIPPOV L. Challenges in processing nickel laterite ores by flotation[J]. International Journal of Mineral Processing, 2016, 151: 59−67.
[5] 邱 沙, 车小奎, 郑 其, 段 锦. 红土镍矿硫酸化焙烧−水浸实验研究[J]. 稀有金属, 2010, 34(3): 92−98. QIU Sha, CHE Xiao-kui, ZHENG Qi, DUAN Jin. Experimental study on laterite-nickel ore with sulfating roasting-water immersion methods[J]. Chinese Journal of Rare Metals, 2010, 34(3): 92−98.
[6] ZHANG Yong-lu, WANG Cheng-yan, YANG Yong-qiang, Yin-fei, MA Bao-zhong. Pressure nitric acid leaching of alkali-pretreated low-grade limonitic laterite[J]. Rare Metals, 2015, 34(1): 64−70.
[7] LI Bo, WANG Hua, WEI Yong-gang. The reduction of nickel from low-grade nickel laterite ore using a solid-state deoxidisation method[J]. Minerals Engineering, 2011, 24(14): 1556−1562.
[8] NORGATE T, JAHANSHAHI S. Low grade ores–Smelt, leach or concentrate?[J]. Minerals Engineering, 2010, 23(2): 65−73.
[9] PICKLES C A, FORSTER J, ELLIOTT R. Thermodynamic analysis of the carbothermic reduction roasting of a nickeliferous limonitic laterite ore[J]. Minerals Engineering, 2014, 65(2): 33−40.
[10] DALVI A, BACON W, OSBORNE R. The past and the future of nickel laterites[C]// PDAC 2004 International Convention. Toronto: Trade Show and Investors Exchange, 2004: 1−27.
[11] RHAMDHANI M A, HAYES P C, JAK E. Nickel laterite Part 1–Microstructure and phase characterisations during reduction roasting and leaching[J]. Mineral Processing & Extractive Metallurgy, 2009, 118(3): 129−45.
[12] UTIGARD T, BERGMAN R A. Gaseous reduction of laterite ores[J]. Metallurgical and Materials Transactions B, 1993, 24(2): 271−275.
[13] O'CONNOR F, CHEUNG W H, VALIX M. Reduction roasting of limonite ores: Effect of dehydroxylation[J]. International Journal of Mineral Processing, 2006, 80(2/4): 88−99.
[14] CARON M H. Fundamental and practical factors in ammonia leaching of nickel and cobalt ores[J]. Transaction of American Institute of Mining, Metallurgical, and Petroleum Engineers, 1950, 188: 67−90.
[15] 李好泽, 郭汉杰. 红土镍矿预还原焙烧的研究[J]. 铁合金, 2014, 45(4): 40−45. LI Hao-ze, GUO Han-jie. Research on pre-reduction and roasting of laterite[J]. Ferro-Alloys, 2014, 45(4): 40−45.
[16] 李 博, 魏永刚, 王 华. 干燥过程中硅镁镍矿的作用机制及其相变特征[J]. 中国有色金属学报, 2013, 23(5): 1440−1446. LI Bo, WEI Yong-gang, WANG Hua. Action mechanism and phase transformation characteristics of garnierite in drying process[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(5): 1440−1446.
[17] ZHOU Shi-wei, WEI Yong-gang, LI Bo, MA Bao-zhong, WANG Cheng-yan, WANG Hua. Kinetics study on the dehydroxylation and phase transformation of Mg3Si2O5(OH)4[J]. Journal of Alloys & Compounds, 2017, 713: 180−186.
[18] CATTANEO A, GUALTIERI A F, ARTIOLI G. Kinetic Study of the dehydroxylation of chrysotile asbestos with temperature by in situ XRPD[J]. Physics & Chemistry of Minerals, 2003, 30(3): 177−183.
[19] ZULUMYAN N, MIRGORODSKI A, ISAHAKYAN A, BEGLARYAN H. The mechanism of decomposition of serpentines from peridotites on heating[J]. Journal of Thermal Analysis and Calorimetry, 2014, 115(2): 1003−1012.
[20] 张钰婷, 张 昭, 袁熙志, 游贤贵. 低品位红土镍矿的直接氢还原实验研究[J]. 四川大学学报(工程科学版), 2011, 43(2): 172−176.ZHANG Yu-ting, ZHANG Zhao, YUAN Xi-zhi, YOU Xian-gui. Study on direct hydrogen reduction experiment of a low-grade laterite-nickel ores[J]. Journal of Sichuan University (Engineering Science Edition), 2011, 43(2): 172−176.
[21] YANG Jun, ZHANG Guang-qing, JAHANSHAHI S, OSTROVSKI O. Reduction of a garnieritic laterite ore by CO-CO2gas mixtures[J].Fundamentals, Theory, 2015: 518−527.
[22] 王筱留. 钢铁冶金学[M]. 北京: 冶金工业出版社, 2005: 39−41. WANG Xiao-liu. Iron and steel metallurgy[M]. Beijing: Metallurgical Industry Press, 2005: 39−41.
[23] 卢 杰. 硫酸钠对红土镍矿在氢气和甲烷气氛下的还原性研究[D]. 太原: 太原理工大学, 2013: 42−44. LU Jie. The reducibility research of sodium sulphate on the hydrogen and methane reduction process of nickel laterite ore[D]. Taiyuan: Taiyuan University of Technology, 2013: 42−44.
[24] 杨 新, 李荣玲, 贺国霞. 烧结矿粒级影响因素试验研究[J]. 数字化用户, 2013(21): 40−42. YANG Xin, LI Rong-ling, HE Guo-xia. Experimental study on influence factors sinter grain size[J]. Digitization user, 2013(21): 40−42.
Reduction characteristic of garnieritic laterite ore using hydrogen at low temperature
DING Zhi-guang1, LI Bo2, WEI Yong-gang2
(1. Faculty of Metallurgy and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China;2. State Key Laboratory of Complex Nonferrous Metal Resources Clean Utilization, Kunming University of Science and Technology, Kunming 650093, China)
The garnieritic laterite ore (0.82% Ni and 9.67% Fe) was used to carry out low-temperature hydrogen reduction experimental study.The effects of reduction temperature, reduction time, hydrogen concentration and mineral size on the metallization rate of nickel and iron were investigated.The results show that metallization rate of nickel and iron are 95% and 42%, respectively, under the conditions of reduction temperature of 600 ℃, reduction time of 90 min and hydrogen concentration of 60% (volum fraction).When the particle size is less than 380 μm, the effect of particle size on the metallization rate of nickel and iron is not obvious. The diffraction peak of nickel-iron alloy ([Fe,Ni]) first increases, and then decreases with the increase of reduction temperature, and reaches a maximum at 600 ℃. In addition, the amorphous silicate is recrystallized to form magnesium olivine hindered the reduction of nickel and iron. A nickel-iron alloy is obtained by the low temperature hydrogen reduction. The nickel oxide is almost completely reduced and most of the iron is reduced to iron low-priced oxide.
garnieritic laterite ore; hydrogen; reductioncharacteristic; metallization rate; Fe-Ni alloy
Projects(U1302274, 51304091) supported by the National Natural Science Foundation of China
2017-02-15;
2017-06-22
LI Bo; Tel: +86-15987127468; E-mail: libokmust@163.com
国家自然科学基金资助项目(U1302274,51304091)
2017-02-15;
2017-06-22
李 博,副教授,博士;电话:15987127468;E-mail: libokmust@163.com
10.19476/j.ysxb.1004.0609.2018.08.22
1004-0609(2018)-08-1669-07
TF815
A
(编辑 李艳红)
