采用萃取剂[Omim][BF4]分离提取铬渣中的Cr2O2− 7
2018-10-11魏君怡薛向欣
魏君怡,李 勇,薛向欣
采用萃取剂[Omim][BF4]分离提取铬渣中的Cr2O2− 7
魏君怡,李 勇,薛向欣
(东北大学 冶金学院,沈阳,110819)


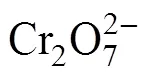
目前,提取铬的方法主要有化学沉淀法[4]、吸附法[5]、离子交换树脂法[5]、电化学法[6−7]和萃取法[8]等。化学沉淀法、吸附法和离子交换法等传统方法具有工艺简单的优点,但生产过程中产生大量废水,污染物处理量大,极易造成二次污染。萃取法因具有分离效果好、萃取容量大、易连续生产等优点而广泛应用在稀有金属的分离和提取[9]。例如,LUO等[10]采用P507萃取铬,萃取率高达95%。PANDEY等[11]采用P204−煤油−异癸醇萃取铬效率可达94.9%。ZHANG等[12]采用PESA从电镀污泥中萃取铬。但是传统的萃取铬工艺存在萃取剂选择性低且条件复杂等缺点,使其应用越来越受到限制[13]。因此,探索铬的萃取剂就显得十分必要。
离子液体是指全部由离子组成、在室温或室温附近温度下呈液态的物质,具有挥发性低、电化学窗口宽、导电性强、离子迁移率高、结构特性可调等优 点[14−17],在电化学、有机合成、萃取分离、反应催化等工程中有着广泛应用[18−22]。离子液体在萃取重金属离子方面应用较广泛,通常是将其作为绿色溶剂。例如,VISSER等[23−26]利用[C4mim][PF6]萃取水中有毒金属离子,NAKASHIMA等[27]报道了离子液体用于稀土镧系元素的萃取分离。WHITEHED等[28]采用离子液体浸取矿物分离回收金属离子。虽然上述应用离子液体萃取金属离子具有一定的效果,但主要是应用离子液体对物质的高溶解性的“绿色溶剂”特点来达到分离,但是价格昂贵是制约其作为溶剂使用的主要瓶颈,因此,将离子液体作为萃取剂应用于金属离子的分离是突破这一瓶颈的有效途径。值得一提的是,将离子液体作为萃取剂应用于铬渣的资源化利用还未见报道。
辛基咪唑四氟硼酸盐离子液体是一种来源容易、价格相对适中的离子液体,由于具有良好的疏水亲油性,在长链醇中具有较好的溶解性[29−31],因此,采用[Omim][BF4]为萃取剂,正戊醇为溶剂组成有机相,采用铬渣酸浸液为水相,对其进行铬的萃取分离研究,为铬渣的绿色资源化利用进行新的实验探索。
1 实验
1.1 实验仪器
PXSJ−216型离子计(上海精密仪器科学公司)、Nicolet 380型傅立叶变换红外光谱仪(美国热电集团)、氟硼酸根离子选择性电极(上海圣科仪器有限公司)、232参比电极(上海圣科仪器有限公司)、Optima 8300D型电感耦合等离子体发射光谱仪(美国PE公司)、SYC型超级恒温水浴箱(巩义市予华仪器有限公司)、TG−60型高速离心机(巩义市予华仪器有限公司)。
1.2 实验试剂
铬渣酸浸液化学组成如表1所示。1-辛基-3-甲基咪唑四氟硼酸盐([Omim][BF4])(购于林州市科能材料科技有限公司,化学纯)。

表1 铬渣酸浸液的化学组成
1.3 实验步骤


式中:t和e分别为萃取前后水相中铬的浓度,g/L。


式中:0和s分别为反萃取前后有机相中铬的浓度,g/L。
2 结果与讨论
2.1 [Omim][BF4]萃取实验
2.1.1 萃取剂初始浓度对铬萃取率的影响

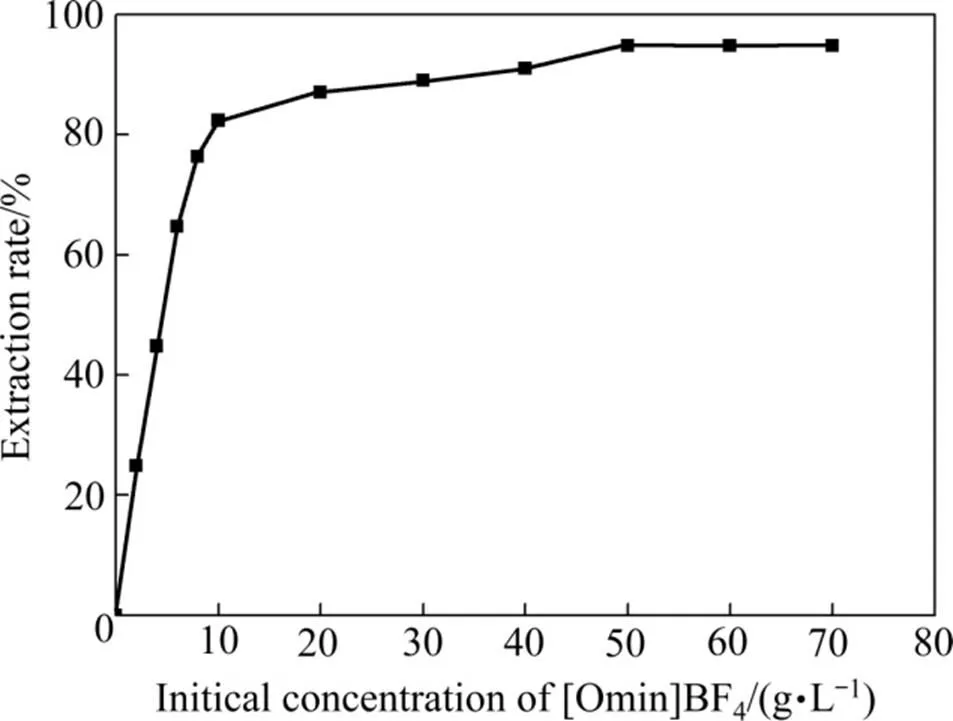
图1 萃取剂初始浓度对铬萃取率的影响

2.1.2 相比对萃取率的影响
本实验中选取O/A分别为0.25、0.5、0.75、1.0、1.25这5个不同的条件下进行铬的萃取实验。其他条件同上,其中萃取剂浓度50.0 g/L。实验结果如图2所示。
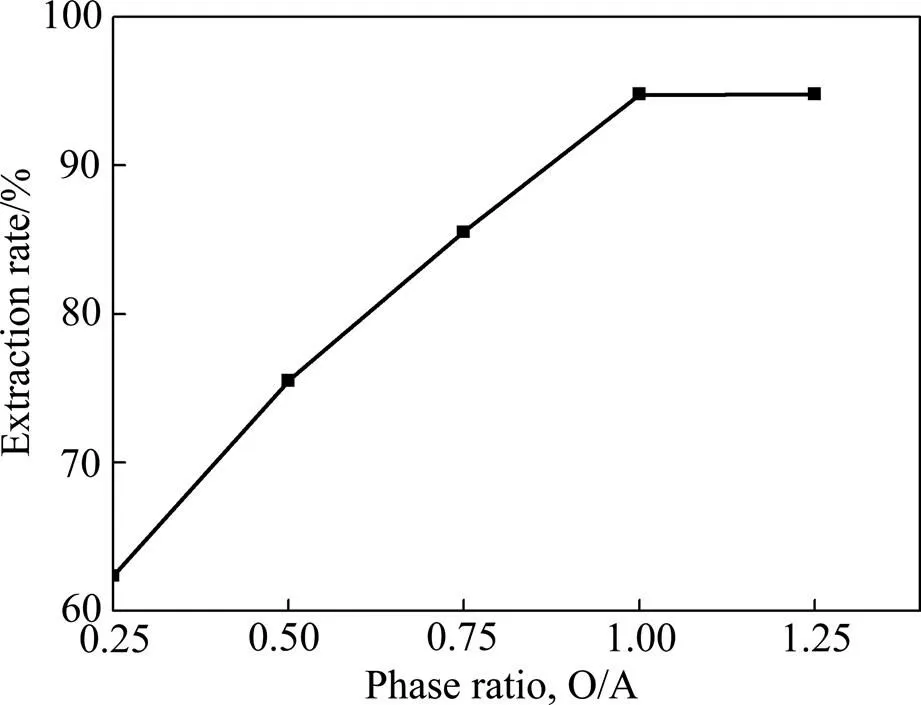
图2 相比对于铬萃取率的影响

2.1.3 时间对萃取率的影响
本实验中选取1.0、2.0、3.0、4.0、5.0、6.0、8.0和10.0 min这8个不同萃取时间进行铬的萃取实验。其他条件同上,其中O/A=1.00。实验结果如图3所示。

图3 时间对于铬萃取率的影响
由图3可见,随着时间的延长,铬萃取率快速增大,当=6.0 min时,萃取率达到最大。而后萃取率曲线趋于平缓。综合考虑,萃取时间≥6.0 min为宜,因此,本实验中萃取时间确定为6.0 min。
2.1.4 pH对萃取率的影响
铬在不同pH条件具有不同的离子存在状态,为了考察不同pH条件下对铬的萃取效果。本实验中选取10个不同pH条件进行铬萃取实验。其他条件同前,其中萃取时间为6.0 min。实验结果如图4所示。
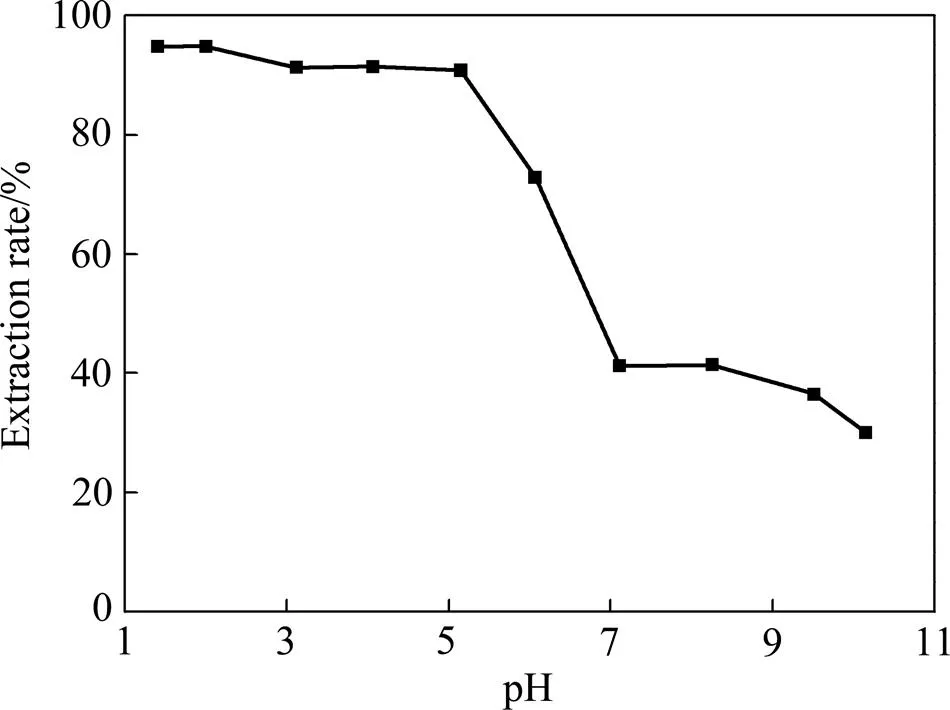
图4 pH对铬萃取率的影响
由图4可见,pH对萃取率有明显的影响作用。当pH为1~5时,[Omim][BF4]对铬具有极好的萃取率;当pH为7~11时,萃取率下降较为明显。

综上所述,采用[Omim][BF4]为萃取剂萃取分离铬渣酸浸液中铬最适宜的萃取条件为萃取剂浓度为50.0 g/L、O/A=1.00、时间为6.0 min、水相pH为1.408~2.006,常温下单级萃取率达到94.81%。
2.2 萃取机理研究
2.2.1 斜率法确定萃合物组成
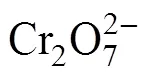

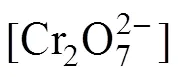

式中:为萃合物中[Omim][BF4]的配位数(下标aq代表水相,org代表有机相,下同)
萃取平衡常数(ex)的计算公式如下:
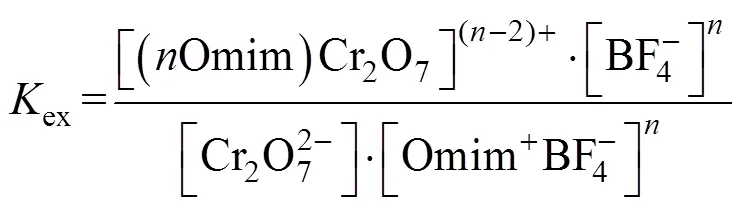
分配比()的计算公式如下:
(5)
整理得

取对数
(7)
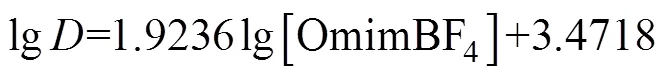
计算得到R2=0.9987,直线斜率为1.9236,取整数为2,表明的萃合物中[Omim]BF4的配位数 为2。

2.2.2 红外光谱分析


图6 [Omim][BF4]-Cr(Ⅵ)萃合物、[Omim][BF4]、[Omim][Br]的红外光谱图
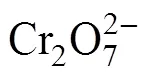
2.3 反萃取实验
2.3.1 pH对反萃率的影响
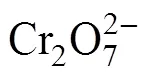
由图7可见,当单独使用(NH4)2SO3为反萃剂时,随着pH的变化,铬反萃率先下降,后趋于平缓,最后缓慢上升。当单独使用NaBr为反萃剂时,pH的变化对铬反萃率影响不大。当反萃取剂为NaBr和(NH4)2SO3时,铬反萃率显著大于相同条件下单独使用NaBr或(NH4)2SO3的铬反萃率,且在pH=10是达到最大,因此,本实验中反萃液pH=10,反萃剂为NaBr+ (NH4)2SO3。

图7 pH对于铬反萃率的影响
2.3.2 反萃剂浓度对反萃率的影响
本实验中选取11个不同的反萃剂浓度,进行铬的反萃取实验。其他条件同上,其中反萃液pH=10,反萃剂为NaBr+(NH4)2SO3。实验结果如图8所示。

图8 铬的反萃取实验中反萃剂浓度对铬反萃率的影响
由图8可见,随着反萃剂浓度的增大,铬反萃率不断上升后趋于平缓。当反萃剂浓度为0.5 mol/L时,铬反萃率达到最大,因此为了保证较高反萃率,本实验中采用反萃剂浓度为0.5 mol/L NaBr+0.5 mol/L (NH4)2SO3。
2.3.3 反萃时间对铬反萃率的影响
反萃剂时间对于对确定反萃实验条件具有重要的意义。本实验中选取10个不同的反萃时间,进行铬的反萃取实验。其他条件同上,其中反萃取剂为0.5 mol/L NaBr+0.5 mol/L (NH4)2SO3。实验结果如图9所示。

图9 铬的反萃取实验中时间对于铬反萃率的影响
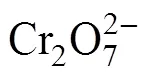
3 结论
1) 本实验中最适宜的萃取条件如下:萃取剂浓度为50.0 g/L、O/A=1.0、时间为6.0 min、萃取液pH为1.408~2.006,常温下铬萃取率可达94.81%。
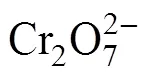
3) 最适宜的反萃取条件如下:pH=10,反萃取剂浓度为0.5 mol/L NaBr+0.5 mol/L (NH4)2SO3,时间为15 min,常温下反萃率可达99.35%。
[1] 石 磊, 赵由才, 牛冬杰. 铬渣的无害化处理及综合应用[J]. 再生资源研究, 2004(6): 34−38. SHI Lei, ZHAO You-cai, NIU Dong-jie. Harmless disposal and comprehensive utilization of chromiumslags[J]. Recycling Research, 2004(6): 34−38.
[2] 景学森, 蔡木林, 杨亚提.铬渣处理处置技术研究进展[J].环境技术, 2006(3): 33. JING Xue-sen, CAI Mu-lin, YANG Ya-ti. Research progress of treatment and disposal of chromiumslags[J]. Environmental Technology, 2006(3): 33.
[3] 陈 果, 王 鑫. 浅析我国铬渣解毒技术的研究[J]. 科技与企业, 2015(6): 245−246.[J]. Technology and Business, 2015(6): 245−246.
[4] 孟 超, 孟庆庆. 化学沉淀法处理含铬电镀废水的工程应用研究[J]. 环境科学与管理, 2013, 38(4): 106−110. MENG Chao, MENG Qing-qing. Applied research on chromium-containing electroplating wastewater by chemical precipitation method[J]. Environmental Science and Management, 2013, 38(4): 106−110.
[5] 范 力, 张建强, 程 新, 刘 伟, 夏明芳, 王志良. 离子交换法以及吸附法处理含铬废水的研究进展[J]. 水处理技术, 2009, 35(1): 30−33.Progress of treatment of waste water containing chromium by ion-exchange method and adsorption method[J]. WaterTreatmentTechnology, 2009, 35(1): 30−33.
[6] 覃奇贤, 刘淑兰, 成旦红, 郭鹤桐.铬酸溶液中金属铬电沉积的机理[J]. 物理化学学报, 1992, 8(4): 571−575. TAN Qi-xian, LIU Shu-lan, CHENG Dan-hong, GUO He-tong. The mechanism of chromium electrodeposition of from chromic acid solution[J]. Acta Physico-Chimica Sinica, 1992, 8(4): 571−575.
[7] 王拥军, 张宇飞, 许 刚, 蒋兴祥. 高纯金属铬的电解生产实践[J]. 湿法冶金, 2009, 28(2): 99−100. WANG Yong-jun, ZHANG Yu-fei, XU Gang, JIANG Xing-xiang. Electrolysis production practice of high purity metal chromium[J]. Hydrometallurgy, 2009, 28(2): 99−100.
[8] 邱胤轩, 杨丽梅, 黄松涛, 李 岩, 张 歌, 胡祎罕娜. 协同萃取法分离和回收废水中重金属离子的研究现状[J].稀有金属, 2015, 39(8): 749−758. QIU Yin-xuan, YANG Li-mei, HUANG Hai-tao, LI Yan, ZHANG Ge, HU Yi-han-na. Progress in separation and recycled of heavy metals from wastewater by synergistic solvent extraction method[J]. Rare Metals, 2015, 39(8): 749−758.
[9] 孙 盼, 黄 焜, 刘会洲. 采用酸化伯胺A-N1923-酒石酸钠体系从强碱性溶液萃取分离钒铬[J]. 中国有色金属学报, 2016, 26(7): 1559−1567. SUN Pan, HUANG Kun, LIU Hui-zhou. Seperation V and Cr from alkaline aqueous solutins using acidified primary amine A-N1923-sodium tartrate system[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(7): 1559−1567.
[10] LUO Jian-hong, LI Jun, YANG Zhao-peng, LIU Xue-feng. Removal of chromium(Ⅲ) from aqueous waste solution by predispersed solvent extraction[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(2): 524−529.
[11] PANDEY B D, COTE G, BAUER D. Extraction of chromium(Ⅲ) from spent tanning baths[J]. Hydrometallury, 1996, 40(3): 343−357.
[12] ZHANG Li-hua, ZHU Zhi-liang, Chromium extraction from sewage sludge using polyepoxysuccinic acid[J]. Pedosphere, 2012, 22(1): 131−136.
[13] 刘梦莹, 车佳宁, 吴蔚闳, 卢运祥, 彭昌军, 刘洪来, 卢 浩, 杨 强, 汪华林.功能性离子液体萃取水中Cu2+的实验与理论[J]. 化学学报, 2015, 73: 117. LIU Meng-ying, CHE Jia-ning, WU Wei-hong, LU Yun-xiang, PENG Chang-jun, LIU Hong-lai, LU Hao, YANG Qiang, WANG Hua-lin. Extraction of copper from aqueous solution with functional ionic liquids: Experiment and theoretical calculation[J]. Acta Chimica Sinica, 2015, 73: 117.
[14] 陈仁坦, 刘植昌, 孟祥海, 张 睿. 离子液体萃取重金属离子的研究进展[J]. 化工进展, 2013, 32(11): 2758. CHEN Ren-tan, LIU Zhi-chang, MENG Xiang-hai, ZHANG Rui. Advances in heavy metal ion extraction with ionic liquids[J]. Chemical Industry and Engineering Progress, 2013, 32(11): 2758.
[15] CHIAPPE C, PIERACCINI D. Ionic liquids: Solvent properties and organic reactivity[J]. Journal of Physical Organic Chemistry, 2005, 18(4): 275−297.
[16] ROONER D, JACQUEMIN J, GARDAS R. Thermoph-ysical properties of ionic liquids[J]. Ionic Liquids, 2004, 49(4): 954−964.
[17] TOKUDA H, ISHII K, SUSAN H B A, WATANABE M. Physicochemical properties and structures of room temperature ionic liquids: Variation of anionic species[J]. Journal of Physical Chemistry, 2004, 108(42): 16593−16600.
[18] PLECHKOVA N, SEDDON K R. Applications of ionic liquids in the chemical industry[J]. Chemical Society Reviews, 2008, 37(1): 123−150.
[19] SUN Ping, ARMSTRONG D W. Ionic liquids in analytical chemistry[J]. Analytica Chimical Acta, 2010, 661(1): 1−16.
[20] SUN Xiao-qi, LUO Hui-ming, DAI Sheng. Ionic liquids-based extraction: A promising strategy for the advanced nuclear fuel cycle[J]. Chemical Reviews, 2012, 112(4): 2100−2128.
[21] GALINSKI M, LEWANDOWSKI A, STEPNIAK I. Ionic liquids as electrolytes[J]. Electro chimical Acta, 2006, 51(26): 5567−5580.
[22] PARVULESCU V I, HARDARE C. Catalysis in ionic liquids[J]. Chemical Reviews, 2007, 107(6): 2615−2665.
[23] VISSER A E, JENSEN M P, LASZAK I, NASH K L, GREGORY R, ROGERS R D. Uranyl coordination environment in hydrophobic ionic liquids: An in situ investigation[J]. Inorg Chem, 2003, 42(7): 2197−2199.
[24] VISSER A E, ROGERS R D. Room-temperature ionic liquids: New solvents for F-element separations and associated solution chemistry[J]. Solid State Chem, 2003, 171: 109−113.
[25] VISSER A E, SWATLOSKI R P, REICHERT W M. MAYTON R, SHEFF S, WIERZBICKI A,DAVIS J H, ROGERS R D. Task-specific ionic liquids incorporating novel cations for the coordination and extraction of Hg2+and Cd2+: Synthesis, characterization, and extraction studies[J]. Environmental Science & Technology, 2002, 36(11): 2523−2529.
[26] VISSER A E, SWATLOSKI R P, REICHERT W M, MAYTON R, SHEFF S, WIERZBICKE A, DAVIS J H, ROGERS R D. Task-specific ionic liquids for the extraction of metal ions from aqueous solutions[J]. Chem Comun, 2001: 135−136.
[27] NAKASHIMA K, KUBOTA F, MARUYAMA T. Ionic liquids as a novel solvent for lanthanide extraction[J]. Anal SCI, 2003, 8(19): 1097−1098.
[28] WHITEHEAD J A, LAWRANCE G A, MCCLUSKEY A. Green leaching: Recyclable and selective leaching of gold-bearing ore in an ionic liquid[J]. Green Chem, 2004, 6(7): 313−315.
[29] DOMANSKA U, KOZLOWSKA M, ROGALSKI M. Solubility of imidazoles in alcohols[J]. Journal of Chemical & Engineering Data, 2002, 47(1): 8−16.
[30] DOMANSKA U, KOZLOWSKA M K, ROGALSKI M. Solubilities, partition coefficients, density, and surface tension for imidazoles+octan1ol or + water or +-decane†[J]. Journal of Chemical & Engineering Data, 2002, 47(3): 456−466.
[31] DOMANSKA U, KROLIKOWSKA M, ARASIMOWICZ M. Phase equilibria of (1-hexyl-3-methylimidazolium thiocyanate+ water, alcohol, or hydrocarbon) binary systems[J]. Journal of Chemical & Engineering Data, 2010, 55(2): 773−777.
[32] 郑丽丽, 郭 晨, 刘会洲. 离子液体的红外光谱研究[J]. 光谱学与光谱分析, 2006, 26(7) : 33−34. ZHENG Li-li, GUO Chen, LIU Hui-zhou. The FTIR study of the 1-butyl-3-methylimidazolium based ionic liquids[J]. Spectriscopy and Spectral Analysis, 2006, 26(7): 33−34.

Separation and extraction of Cr2O2− 7from chromic slags using [Omin][BF4] as extractant
WEI Jun-yi, LI Yong, XUE Xiang-xin
(School of Metallurgy, Northeastern University, Shenyang 110819, China)
Chromic slags are vital industrial solid wastes which possess extremely serious environmental perniciousness. Separating and extracting chromium is effective means to reduce its environmental pollution and resources waste. The extraction behavior of chromium from chromiumslag acidic leaching solution with [Omim][BF4] dissolved in pentanol was studied as concentration of extractant, time, acidity, and so on. The results show that extraction rate of chromate can reach up to 94.81% under the conditions of [Omim][BF4] concentration of 50.0 g/L, shaking time of 6.0 min, pH of 1.408−2.006. The extraction mechanism results show that the extraction proceeds via ionic association based on HSAB to product adduct. The back-extraction rate of chromate can reach up to 99.35% under the conditions of pH=10, stripping agent 0.5 mol/L NaBr+0.5 mol/L (NH4)2SO3, shaking time 15.0 min. The purification of chromium from chromiumslags is achieved.

Project(U1502273) supported by the National Nature Science Foundation of China
2017-05-23 ;
2018-07-20
LI Yong; Tel: +86-13709847505; E-mail: liyong@smm.neu.edu.cn
10.19476/j.ysxb.1004.0609.2018.08.20
1004-0609(2018)-08-1653-07
O 652.62
A
国家自然科学基金资助项目(U1502273)
2017-05-23;
2017-07-20
李 勇,副教授,博士;电话:13709847505;E-mail: liyong@smm.neu.edu.cn
(编辑 龙怀中)
