牡丹花蕊多糖三相分离纯化及其理化性质
2018-10-10磊薛依涵杨永庆朱文学
罗 磊薛依涵杨永庆朱文学
(1. 河南科技大学食品与生物工程学院,河南 洛阳 471023;2. 洛阳牡丹生物科技研究院,河南 洛阳 471023)
牡丹花蕊为牡丹(Paeonia suffruticosa Andr)的组成部分,呈黄色小石榴状,含有丰富的碳水化合物、蛋白质、不饱和脂肪酸、氨基酸和维生素等营养成分[1],丹凤牡丹于2013年被中国国家计生委列为一种新食品原料。作为种子植物产生花粉的器官,牡丹花蕊具有降血脂、降血糖和抗氧化等功效[2]。但是作为牡丹资源大国,中国对牡丹花蕊的研究主要集中在营养成分分析和产品开发上[3-4],缺乏对牡丹花蕊中有效成分的提取纯化和化学结构的深入研究。
三相分离法是通过在粗提物中加入一定比例的有机溶剂和盐而使体系分成明显的三相,即色素、脂质和疏水物质集中的上层相,蛋白质和细胞质集中的中间层,糖类等极性成分集中的下层相[5-8]。三相分离法应用了传统盐析、共溶剂、等离子体和蛋白质渗透沉淀等多种原理[9-10],最近几年才被用到多糖的分离纯化当中。Yan等[11]采用三相分离法对河蚌多糖进行了分离纯化,得到良好的纯化效果。
本试验拟采用三相分离法纯化牡丹花蕊多糖,并对所得多糖的理化性质进行分析,为三相分离体系在多糖纯化方面的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
新鲜牡丹花蕊:丹凤,采自洛阳牡丹园;
叔丁醇、硫酸铵、无水乙醇、盐酸、氢氧化钠、乙二胺四乙酸、磷酸氢二钠、磷酸二氢钠、乙腈、牛血清蛋白、考马斯亮蓝G-250、苯酚、硫酸、溴化钾、氘代水等:分析纯。
1.1.2 主要仪器设备
旋转蒸发仪:RE-52A型,上海亚荣有限公司;
真空冷冻干燥机:LGJ-10型,北京松原华兴生物技术有限公司;
磁力加热搅拌器:78-1型,金坛市晶玻实验仪器厂;
精密pH计:PHS-3C 型,上海越平科学仪器有限公司;
紫外-可见分光光度计:UV2400型,上海舜宇恒平科学仪器有限公司;
台式高速离心机:TDZ5-WS型,湖南长沙湘仪离心机仪器有限公司;
傅立叶红外变换光谱仪:TENSPOD27型,德国NRVKER公司:
核磁共振波谱仪:AVANCE Ⅲ HD400型,瑞士布鲁克公司。
1.2 方法
1.2.1 牡丹花蕊粗多糖提取方法 称取脱脂牡丹花蕊粉末5 g,按照料液比1∶25 (g/mL)加入蒸馏水,在超声功率120 W,超声时间64 min条件下超声辅助提取,将浸提液5 000 r/min 离心20 min,取上清液即为粗糖液,4 ℃冻藏备用。
1.2.2 三相分离法纯化牡丹花蕊多糖 取一定体积粗糖液,1 000 r/min搅拌下缓慢加入一定质量分数硫酸铵,待硫酸铵固体完全溶解后调pH至一定值(用1 mol/L NaOH或HCl调节),随后按一定比例加入叔丁醇,快速混匀,将混合液在30 ℃[12]条件下静置一定时间,为确保完全分离,将混合物于5 000 r/min离心20 min,以形成澄清的三相。收集上层有机相(叔丁醇)减压蒸发回收,弃去中层沉淀(游离蛋白质),收集下层混合液(主要由硫酸铵和多糖组成),用移液管移出。将得到的下层溶液进一步采用截留分子量为8 000~14 000 U的透析袋于蒸馏水中透析24~36 h,除去硫酸铵,随后将透析袋内提取液移出,浓缩并冷冻干燥,得到纯化牡丹花蕊多糖。
1.2.3 三相分离法纯化单因素试验
(1) pH值:固定提取液与叔丁醇体积比1∶1,硫酸铵质量分数20%,提取时间60 min,考察不同pH(3,4,5,6,7)对牡丹花蕊多糖回收率与蛋白质去除率的影响。
(2) 硫酸铵质量分数:在pH为6的最优条件下,固定提取液与叔丁醇体积比1∶1,提取时间60 min,考察不同硫酸铵质量分数(10%,20%,30%,40%,50%)对牡丹花蕊多糖回收率与蛋白质去除率的影响。
(3) 体积比:在pH为6、硫酸铵质量分数为20%的最优条件下,固定提取时间60 min,考察不同提取液与叔丁醇体积比(1∶0.5,1∶1.0,1∶1.5,1∶2.0,1∶2.5)对牡丹花蕊多糖回收率与蛋白质去除率的影响。
(4) 提取时间:在pH为6、硫酸铵质量分数为20%、提取液与叔丁醇体积比为1∶1.5的最优条件下,考察不同提取时间(10,30,50,70,90 min)对牡丹花蕊多糖回收率与蛋白质去除率的影响。
1.2.4 多糖回收率测定 采用苯酚-硫酸法[13],制作葡萄糖标准曲线,在490 nm处测定样品吸光度,计算纯化前后样品中多糖含量,按式(1)计算多糖回收率。
(1)
式中:
M——多糖回收率,%;
A1——纯化后提取液中多糖含量,g;
A2——粗提液中多糖含量,g。
1.2.5 蛋白质去除率测定 采用考马斯亮蓝比色法[14],制作牛血清蛋白标准曲线,在595 nm处测定样品吸光度,分别计算样品中蛋白质含量,按式(2)计算蛋白质去除率。
(2)
式中:
N——蛋白质去除率,%;
B1——纯化后提取液中蛋白质含量,g;
B2——粗提液中蛋白质含量,g。
1.2.6 色素清除率 色素的种类繁多且结构复杂,在色素的测定上暂无确定的方法。根据文献[15]修改如下,将原始粗提液在各个波长下扫描均无特征吸收峰(蛋白质特征吸收峰除外),因此将原始粗提液色素浓度定为100%,将粗提液稀释不同倍数,选择360,380,400,420,440,460 nm为扫描波长,分别测定吸光度值,选择线性拟合最佳的波长作为测定波长,按式(3)计算脱色率。
(3)
式中:
P——色素清除率,%;
a、b——稀释倍数;
C1——粗提取液吸光度;
C2——透析液吸光度;
V1——粗提取液体积,mL;
V2——透析液体积,mL。
1.2.7 牡丹花蕊多糖紫外光谱分析 将三相分离法纯后的多糖用蒸馏水配成一定浓度的多糖溶液,在200~500 nm内扫描,测量样品紫外吸收光谱,观察在190~210 nm以及260,280 nm处有无多糖、核酸以及蛋白质等物质的特征吸收峰。
1.2.8 牡丹花蕊多糖单糖组分分析 多糖样品的单糖组成分析根据文献[16]的PMP柱前衍生化法,将多糖样品酸水解,然后对水解后的多糖和单糖标准品进行PMP衍生化,进行高效液相色谱检测。根据出峰时间以及标准曲线可得出多糖样品各个单糖组分和摩尔比。
1.2.9 牡丹花蕊多糖红外光谱分析 牡丹花蕊多糖的结构及主要官能团采用傅里叶红外光谱法进行分析。采用溴化钾压片法[17],取牡丹花蕊多糖纯品适量,与溴化钾在体积比为1∶100条件下混匀压片,在450~4 000 cm-1内扫描,以溴化钾为空白。
1.2.10 牡丹花蕊多糖核磁共振波谱分析 将一定量干燥牡丹花蕊多糖纯品用一定体积氘代水溶解,真空冷冻干燥,重复置换3次,将多糖中的轻水置换[18]。将置换后的多糖样品用氘代水配置成20~30 mg/mL溶液,至于核磁管中,在400 Hz条件下进行一维核磁共振氢谱测定。
2 结果与分析
2.1 三相分离纯化
2.1.1 pH值对牡丹花蕊多糖回收率和蛋白质去除率的影响
在三相分离试验中,pH常作为首先考虑因素。 由图1可以看出,pH值在3~6时,多糖回收率与蛋白质去除率都呈现上升的趋势,并在pH值为6时多糖回收率与蛋白质去除率同时达到最大值,呈现最佳的纯化效果。当pH值由6上升至7时,多糖的回收率呈略微下降的趋势,但是蛋白质的去除率明显下降。可能是当pH值达到蛋白质等电点附近时,蛋白质分子的正负电荷相等,溶解度最小,形成沉淀物,与蛋白质等电点沉淀方法类似[19-20]。因此蛋白质在pH值为6时,蛋白质生成沉淀最多,即蛋白质去除率达到最佳值。
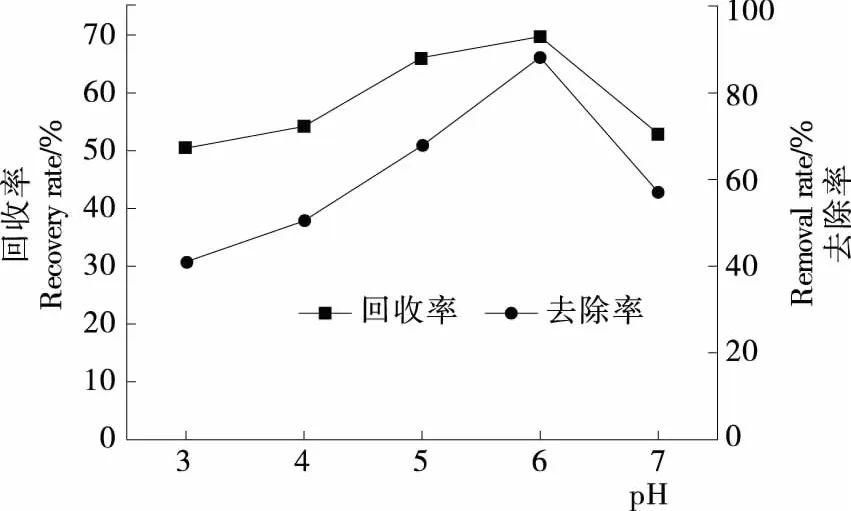
图1 pH值对牡丹花蕊多糖回收率与蛋白质去除率的影响
图1 Effect of pH on recovery and protein removal ofpolysaccharide from peony stamen
2.1.3 提取液与叔丁醇体积比对牡丹花蕊多糖回收率和蛋白质去除率的影响 在三相分离体系中,叔丁醇和硫酸铵的量之间常常存在相互关系[23]。从图3中可以看出,当提取液与叔丁醇体积比由1∶0.5增加到1∶2.5时,多糖回收率先增加后减少,当体积比为1∶1.5时,多糖的回收率最大为71.33%。同时,随着体积比的变化,蛋白质的去除率也呈先增加后减小的趋势。这可能是较少量的叔丁醇不能够与硫酸铵起到协同作用[11]。提取液与叔丁醇体积比较大时,过量的叔丁醇使多糖吸收了一定量的水,导致无足够的水以完全水合硫酸根离子,同时水相与有机相的浓度增大可能导致回收率与去除率的减小[24-25]。因此,提取液与叔丁醇体积比选为1∶1.5,该条件下多糖回收率最优且蛋白质去除率较高。
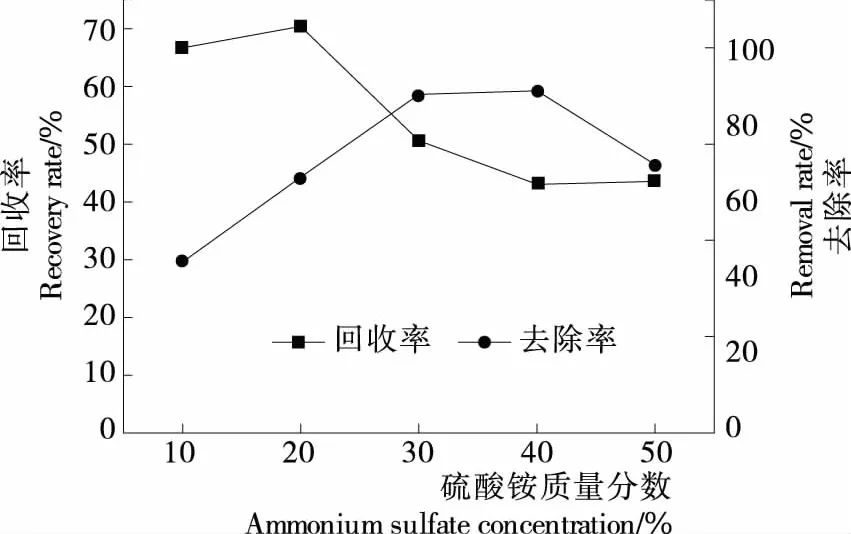
图2 硫酸铵质量分数对牡丹花蕊多糖回收率与蛋白质去除率的影响
图2 Effect of ammonium sulfatecon certration on recovery and protein removal of polysaccharide from peony stamen
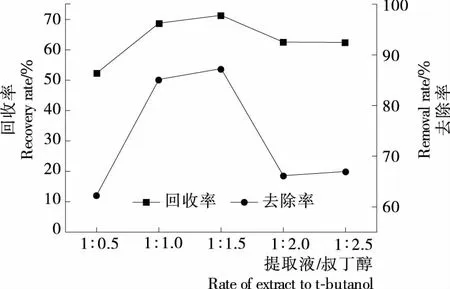
图3 提取液与叔丁醇体积比对牡丹花蕊多糖回收率与蛋白质去除率的影响
图3 Effect of rate of extract to t-butanol on recovery and protein removal of polysaccharide from peony stamen
2.1.4 提取时间对牡丹花蕊多糖回收率和蛋白质去除率的影响 从图4可以看出,在10~90 min内,多糖回收率与蛋白质去除率大体上呈先增加后减小的趋势。萃取时间达到50 min时,多糖回收率达到最大值71.99%。蛋白质去除率在10~50 min中有一定幅度的减小,随后在50~70 min时,蛋白质去除率不断增加,在70 min达到最大值。结果显示,时间在50~70 min时,三相分配体系中各因素相互平衡,多糖回收率与蛋白质去除率结果较优,因此选择60 min作为三相分离萃取时间。
2.1.5 三相分离法纯化正交试验设计 根据单因素试验结果,选取pH值、硫酸铵质量分数、粗提液与叔丁醇体积比为考察因素,选取L9(34)正交表用于优化三相分离法纯化牡丹花蕊多糖粗提液的正交试验。
2.1.6 正交结果分析 正交试验极差分析采用加权综合评分法[26]。本试验以三相分离法纯化后的牡丹花蕊多糖回收率与蛋白质去除率为综合评价指标,以多糖回收率作为主要指标。多糖回收率权重为0.7,蛋白质去除率权重为0.3,消除两指标y1和y2量纲,计算加权综合评分值。
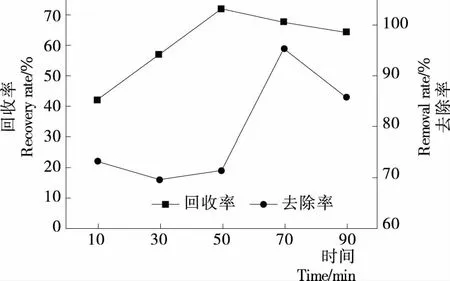
图4 提取时间对牡丹花蕊多糖回收率与蛋白质去除率的影响
图4 Effect of extraction time on recovery and protein removal of polysaccharide from peony stamen
由表2可知,三相分离法纯化牡丹花蕊多糖的因素影响主次为体积比>pH值>硫酸铵质量分数,较优组合为pH值7、提取液与叔丁醇体积比1∶2和硫酸铵质量分数为10%。该条件下多糖回收率为69%,蛋白质去除率为73%。
由表3可知,因素A、B和D对综合指标的影响极显著,因此选取A3B3D1组合作为三相分离纯化的最优工艺。

表1 正交试验因素水平编码表Table 1 Factor-level coding table of orthogonal expriment
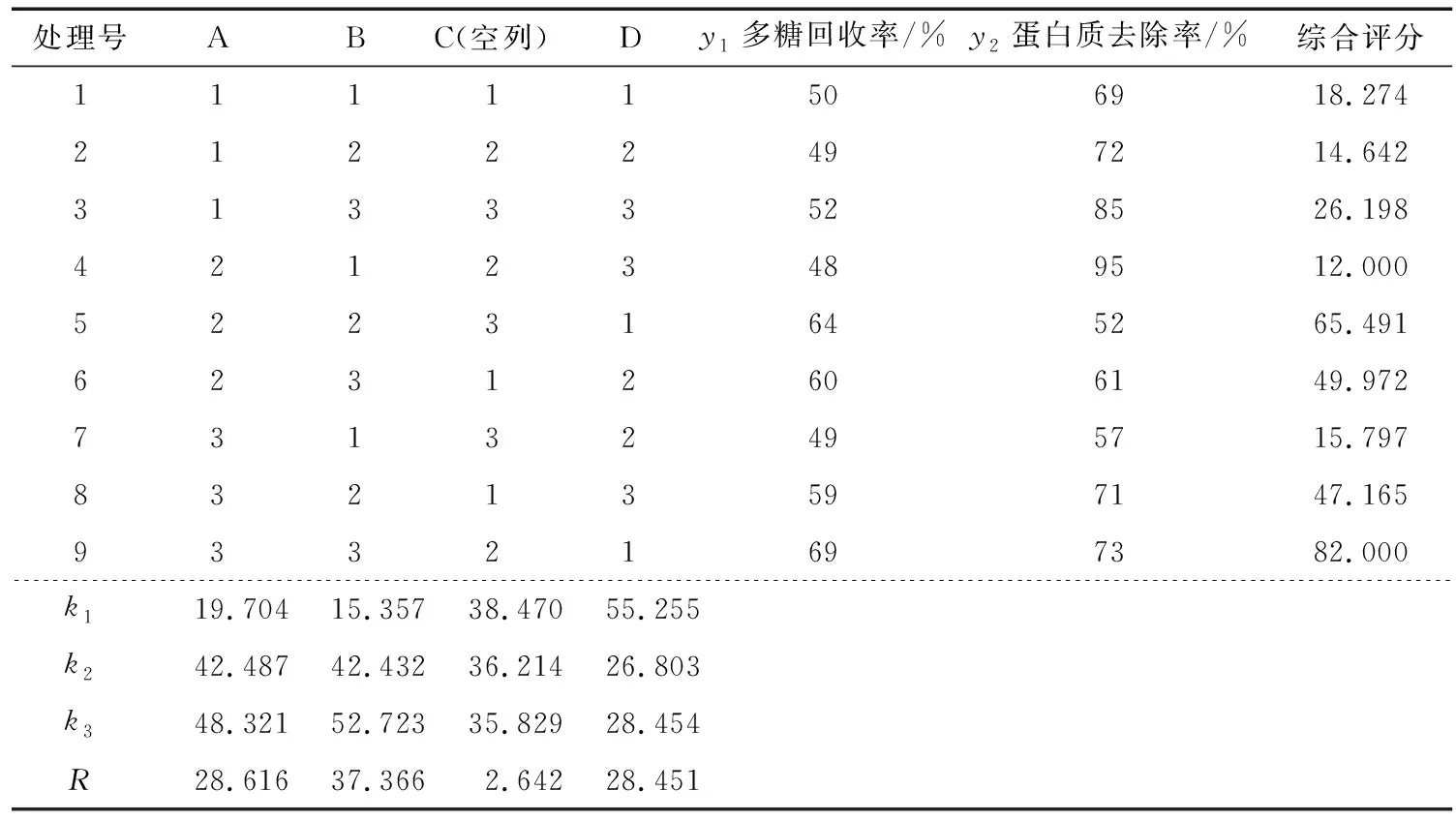
表2 正交试验结果极差分析Table 2 Result of orthogonal experiment range analysis
2.1.7 色素清除率 牡丹花蕊粗多糖中还残留部分色素,会影响多糖纯度,且会对多糖结构的分析造成影响。三相分离法对色素有较好的清除作用,可用于牡丹花蕊粗多糖中色素的清除。在360~460 nm内对色素浓度与吸光度值进行线性拟合,结果见图5。显示在420 nm处R2为0.999最优,因此选择420 nm作为色素浓度测定波长,测得经三相分离法纯化后牡丹花蕊多糖的色素清除率达95.36%。
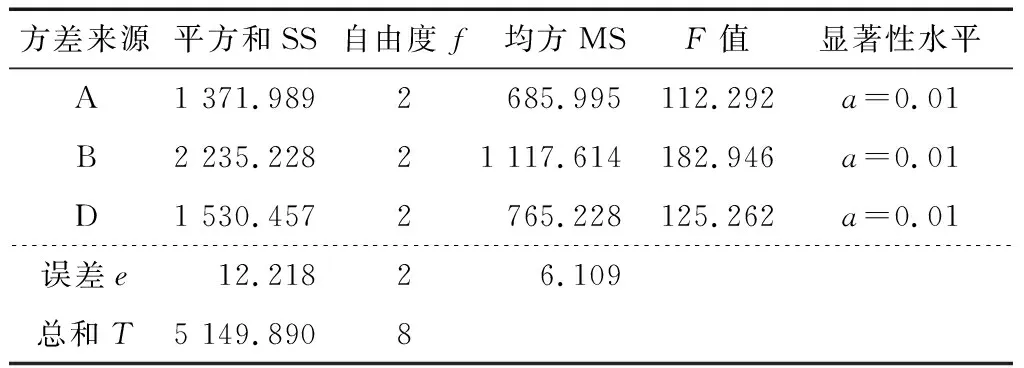
表3 正交试验结果方差分析†Table 3 Results of orthogonal experiment analysis of variance
†F0.01(2,2)=99.01,F0.05(2,2)=19。
2.2 理化性质
2.2.1 紫外图谱分析 将三相分离法纯化多糖在200~500 nm 内扫描。从图6中可以看出,在209 nm处有一多糖特征吸收峰,说明组分为多糖,而在280 nm左右有一个微弱吸收峰,说明经过三相分离纯化已除去大部分核酸和蛋白质等杂质,纯度较高。
2.2.2 单糖组成分析 单糖标品和牡丹花蕊多糖水解产物的PMP衍生化色谱图见图7。将多糖水解产物的出峰时间与各标准单糖的保留时间和峰面积对比,得出牡丹花蕊多糖由鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成,摩尔比为1.24∶1.59∶2.00∶9.11∶1.68,其中半乳糖含量明显高于其他几种单糖,可见牡丹花蕊多糖主要由半乳糖组成,并含有少量鼠李糖、葡萄糖和阿拉伯糖。

图5 不同色素浓度与吸光度值关系Figure 5 Relation of different pigment concentration and absorbance value
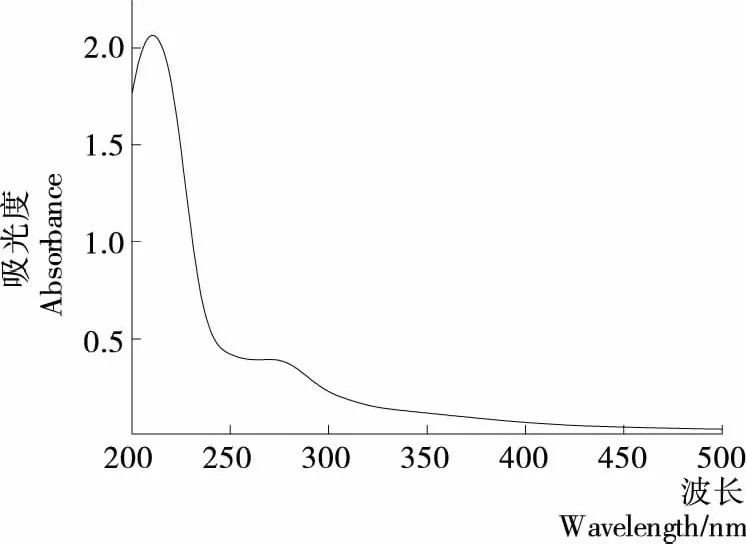
图6 牡丹花蕊多糖的紫外光谱图Figure 6 UV spectra of polysaccharide from peony stamen
2.2.3 红外光谱分析 通过红外光谱分析,结果见图8。样品在3 435 cm-1处宽而深的峰是由羟基O—H伸缩振动引起的,2 952 cm-1处是由烷基C—H伸缩引起的,以上2组峰为多糖特征吸收峰,断定样品为多糖类物质。1 742,1 316 cm-1处由羧基的C═O键伸缩振动和O—H弯曲振动引起,推断有半乳糖醛酸的存在,此结果与单糖组分分析中含有半乳糖醛酸结果相同,另外在1 637 cm-1处的吸收峰为羧基酯化吸收峰,表明样品为一种酸性果胶类多糖[27-28]。在1 443 cm-1处是由烷基的C—H弯曲振动引起,说明有烷基链存在。1 240 cm-1处的吸收峰推断是硫酸基的S═O 伸缩震动引起,推断有硫酸基存在[29]。在指纹区内,1 094,1 013 cm-1处由醚键的C—O伸缩振动引起,为糖苷键非对称振动峰,结合在896 cm-1处由C—H横向振动引起微弱吸收峰,推断有β型吡喃糖存在[30]。840 cm-1处无明显吸收峰表明该多糖不具有或含有少量α型糖苷键[31]。另外896,819 cm-12处吸收峰证明多糖中有半乳糖存在,此结果与单糖组分分析结果一致。
2.2.41H NMR分析 牡丹花蕊多糖的1HNMR图谱见图9。一般情况下,异头氢质子H-1的化学位移处于δ 4.5~5.5,α-型异头氢质子H-1化学位移大于5,β-型异头氢质子H-1化学位移小于5[32]。图9中在δ 4.94处有一强信号,表明糖环以β-型为主,另外δ 5.26,5.09,5.00处信号较弱,表明有少量α-型糖环存在。此外,在δ 4.5~5.5共有4个质子信号,表示有4种单糖种类[33],此结果与单糖组成分析结果完全一致。在δ 3.51~4.14的信号主要是糖环上C2—H至C6—H的信号峰位,因受羟基作用严重重叠[34]。化学位移在δ 1.08~1.25的信号可能为鼠李糖C-6 甲基上的氢质子信号,此结果与单糖组分分析中有鼠李糖结果相同。化学位移在δ 2.00 附近的信号可能为糖醛酸羧基乙酰化结构中乙酰基的甲基氢信号[34]。综合分析可知,牡丹花蕊多糖中同时存在α-构型和β-构型,并且大部分牡丹花蕊多糖以β-构型连接,少量为α-构型,此结果与红外光谱分析结果相符。
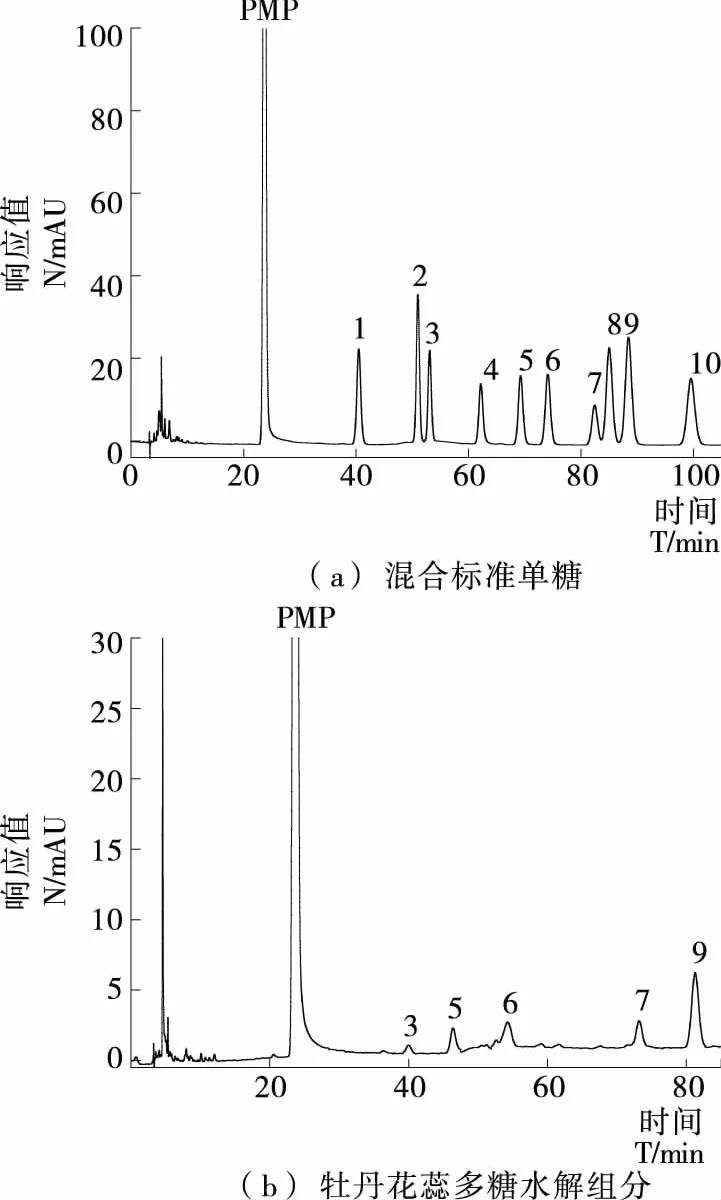
1. Man 2. Rib 3. Rha 4. GlcA 5. GalA 6. Glc 7. Gal 8. Xyl 9. Ara 10. Fuc图7 混合标准单糖和牡丹花蕊多糖水解组分色谱图
图7 HPLC charomatography of mix monosaccharides standardand hydrolysis component of polysaccharides from peony stamen
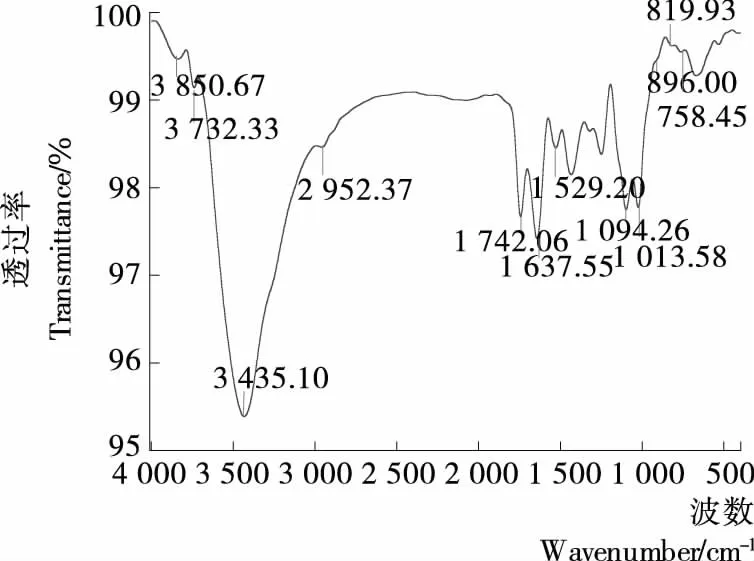
图8 牡丹花蕊多糖的红外光谱图Figure 8 FT-IR spectra of polysaccharide from peony stamen
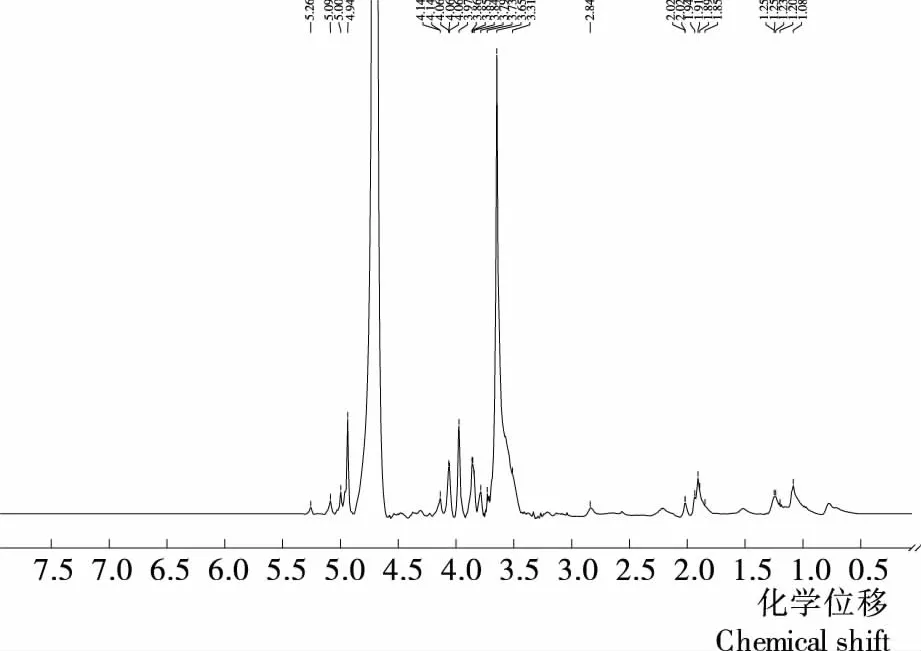
图9 牡丹花蕊多糖的1H核磁共振图Figure 9 1H NMR spectra of polysaccharide from peony stamen
3 结论
(1) 三相分离法纯化牡丹花蕊多糖的最优条件为pH值7、硫酸铵质量分数10%、提取液与叔丁醇体积比1∶2,此条件下多糖回收率为69%,蛋白质去除率为73%,纯化后的牡丹花蕊多糖纯度为99.24%。可将420 nm作为色素浓度测定波长。测定三相分离纯化后的牡丹花蕊多糖的色素清除率为95.36%。
(2) 对纯化后牡丹花蕊多糖的理化性质分析表明,牡丹花蕊多糖由鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖5种单糖组成,其摩尔比为1.24∶1.59∶2.00∶9.11∶1.68。紫外光谱分析验证了牡丹花蕊多糖纯度较高。傅立叶红外变换光谱和核磁共振波谱表明,牡丹花蕊多糖是一种酸性吡喃糖,主要由半乳糖组成且多以β-构型连接。
(3) 从试验结果中看出三相分离法是一种较好的多糖纯化方法,与传统的柱层析方法相比较不仅纯化速度快,且得到多糖纯度较高,多糖损失较少,色素清除率较高。纯化后的牡丹花蕊多糖为一种酸性果胶类多糖,为今后牡丹花蕊多糖的进一步研究提供了理论基础。
(4) 本试验采用了一种较新的多糖纯化方法,在牡丹花蕊的纯化中起到了较好的效果,但是对于其他类多糖的纯化是否适用还需在今后的试验中进一步的探索。
