碱与热处理对大米蛋白质结构与功能性质的影响
2018-10-10陈茂龙程云辉
刘 芳 许 宙 陈茂龙 程云辉
(长沙理工大学化学与生物工程学院,湖南 长沙 410114)
大米蛋白质的氨基酸组成平衡合理,接近FAO/WHO所推荐的营养配比模式,第一限制性氨基酸赖氨酸含量高于其他谷类,其精氨酸含量也较高,这都是其他植物蛋白质甚至很多动物蛋白质无法比拟的[1-3];同时,大米蛋白质的低过敏性也是有别于其他植物蛋白的一个显著特点。但因作为贮藏性蛋白质的谷蛋白在大米蛋白质中含量高达80%,导致其溶解性及其他功能性质皆较差,从而限制了大米蛋白质在食品领域的广泛应用。
蛋白质糖基化改性技术因只需通过2种天然生物分子加热就可自发进行,而成为近年大米蛋白质改性的研究热点[4-6]。本课题组前期研究发现对大米蛋白质-接枝物功能性质的改善,不仅仅完全决定于蛋白质糖基化反应的成功与否,碱处理、热处理和pH与温度协同处理可能皆有不同程度的贡献,目前还没有研究团队针对大米蛋白质糖基化产物功能性质改善的决定性因素开展深入研究。
本研究拟以实验室自制的大米蛋白质为研究对象,通过考察单独碱处理、热处理前后大米蛋白质分子量分布、化学键等结构性质和溶解性、乳化性与乳化稳定性等功能性质的变化,深入探讨碱处理、热处理对大米蛋白质结构及功能性质的影响,以期为大米蛋白质资源的高值化利用提供理论依据。
1 材料与方法
1.1 材料与试剂
桃花香米:金健米业股份有限公司;
大米蛋白质:实验室自制;
磷酸氢二钠、磷酸二氢钠:分析纯,国药集团化学试剂有限公司;
蛋白质分子量标准:天根生物科技有限公司;
细胞色素C、牛碳酸酐酶、牛血清白蛋白、乙醇脱氢酶:美国Sigma公司。
1.2 仪器与设备
电子分析天平:FA2004N型,上海精密科学仪器有限公司;
pH计:FiveEasyPlusTM型,瑞士Mettler toledo公司;
紫外可见分光光度计:UV1800型,日本岛津公司;
高剪切乳化均质器:LR型,无锡市群光化工设备有限公司;
荧光分光光度计:Ls45型,美国珀金埃尔默公司;
离心机:TDL-36C型,上海安亭科学仪器有限公司;
磁力搅拌器:85-1型,江苏省金坛市医疗仪器厂;
高效液相色谱仪:Waters2690型,美国Waters公司;
电泳仪:DYY-6C型,北京市六一仪器厂。
1.3 试验方法
1.3.1 大米蛋白质(rice protein,RP)的制备 采用碱溶酸沉法,具体操作如下:称取20 g NaOH溶于10 L去离子水中,待NaOH完全溶解后加入1 kg大米粉(过120目筛),室温下搅拌2 h,经3 500 r/min离心30 min,收集上清液,用2 mol/L HCl调节pH至等电点(pI=4.8),于3 500 r/min离心30 min,收集沉淀,水洗沉淀3次(3 500 r/min,10 min)至pH为中性,冷冻干燥。
1.3.2 碱处理大米蛋白质的制备 称取适量大米蛋白质,按照底物质量分数为1%加入去离子水,室温下用2 mol/L NaOH 溶液调节pH值分别为8.0,9.0,10.0,11.0,12.0,充分搅拌至pH值稳定后继续搅拌40 min,浓缩并冻干备用。
1.3.3 热处理大米蛋白质的制备 称取适量大米蛋白质,按照底物质量分数为1%加入去离子水,室温下搅拌2 h,使其充分溶解,置于恒温水浴锅中反应40 min,温度分别为50,60,70,80,90 ℃,反应结束后立即冰浴至室温,浓缩并冻干备用。
1.3.4 大米蛋白质结构性质的测定
(1) 分子量测定:在高效液相系统中进行。色谱柱为Waters高效液相凝胶柱(BioSuitTM 250,5 μm HR SEC 7.8 mm×300 mm column)。流动相使用 0.1 mol/L Na2HPO4-NaH2PO4缓冲液(pH 6.7)包含0.1 mol/L Na2SO4和0.05% NaN3,经0.45 μm滤膜过滤后再经超声进行脱气。洗脱流速为1.0 mL/min,检测波长为280 nm,柱温30 ℃。上样量为20 μL,恒流洗脱。标准蛋白质分别是:细胞色素C(12.5 kDa)、牛碳酸酐酶(29.0 kDa)、牛血清白蛋白(66.0 kDa)、乙醇脱氢酶(150.0 kDa)。
(2) 红外光谱测定:按样品与溴化钾的比例1∶100加入一定量的样品和溴化钾,充分研磨使其混合均匀,置于压片磨具中制成均匀透亮的薄片,再用傅立叶红外分光光度仪作全波长(4 000~400 cm-1)扫描分析,在分辨率为2 cm-1条件下测定吸光度,扫描信号累加32次。
(3) 二级结构测定:参照Aoki的圆二色谱法。将大米蛋白质样品溶于0.01 mol/L pH 7.0的Na2HPO4-NaH2PO4缓冲液中,配制成浓度为0.1 mg/mL的溶液,室温下用圆二色谱仪进行远紫外光谱分析,扫描范围190~250 nm,数据间隔为0.5 nm/s,采 CDPro 软件包中SELCON3 算法进行二级结构含量计算。
(4) 表面疏水性测定:采用8-苯氨基-1-萘磺酸钠(ANS)荧光探针法[7]测定样品的表面疏水性。在室温下将样品制成0.1,0.2,0.3,0.4,0.5 mg/mL不同浓度的样品溶液,经离心(8 000 r/min,10 min)后的上清液蛋白浓度采用Folin酚法测定,取4.0 mL不同浓度的样品溶液分别加入20 μL ANS(8 mmol/L),振荡混匀,避光静置3 min。以Na2HPO4-NaH2PO4缓冲液为空白对照,用荧光分光光度计测定样品荧光强度,激发波长和发射波长分别设定为390,470 nm。疏水性指数即为荧光强度—蛋白浓度曲线的初始斜率。
1.3.5 大米蛋白质功能性质的测定
(1) 溶解性:称取一定量样品(精确至0.000 1 g)溶解于0.05 mol/L pH 8.0的缓冲液中,底物质量分数为2%,用0.1 mol/L HCl或NaOH维持pH为8.0,室温搅拌1 h后于3 500 r/min离心30 min,取上清液定容,用福林酚法进行测定。溶解度按式(1)计算。
(1)
式中:
S——溶解度,%;
m1——上清中蛋白质含量,%;
m2——样品中总的蛋白质含量,%。
(2) 乳化活性与乳化稳定性:参照Pearce & Kinsella的浊度法[8],并稍作修改。在0.1 mol/L pH 8.0的磷酸缓冲液中加入一定量的样品,配置成蛋白浓度为2 g/100 mL 的样品液,样品液与大豆油按3∶1的质量比置于高速均质机中,以10 000 r/min分散30 s。在均质0,10 min 后分别取50 μL 样品(取样点固定在离烧杯底部0.5 cm 处),与5 mL 0.1 g/100 mL SDS溶液进行混合,振荡混匀后用分光光度计于500 nm处测定其吸收值A0、A10。用0 min测定的吸光度值表示乳化活性,乳化稳定性按式(2)计算。
(2)
式中:
ES——乳化稳定性,%;
A0——均质结束时的吸光值;
A10——均质10 min后的吸光值;
△t——间隔时间,10 min。
(3) 起泡性(Foaming,FA)与起泡稳定性(Foaming stability,FS):在0.1 mol/L pH 8.0的磷酸缓冲液中加入一定量的样品,配置成蛋白浓度为2 g/100 mL的样品液,搅拌均匀后取40 mL该样品液于100 mL量筒中,用高速均质机剪切40 s(10 000 r/min),立即观察泡沫体积V0,并记录静置30 min后泡沫的体积V30。起泡性及起泡稳定性按式(3)、(4)计算。
(3)
(4)
式中:
FA——起泡性,%;
FS——起泡稳定性,%;
V0——均质结束时泡沫的体积,mL;
V30——静置30 min后泡沫的体积,mL。
1.3.6 试验设计与统计分析 所有样品进行平行试验,重复3次;样品的测定均重复3次,结果取平均值;应用统计学件SPSS对结果进行方差分析(P<0.05)。
2 结果与讨论
2.1 碱处理、热处理对大米蛋白质结构性质的影响
2.1.1 对大米蛋白质分子量分布的影响 由表1可知:与RP相比,当碱处理的pH值范围为8.0~11.0时,>50 kDa的组分含量增加;当处理pH值为12.0时,>100 kDa的组分含量由原RP的9.69%下降至0.90%,50~100 kDa的组分含量由24.75%下降至5.14%,而10~20 kDa的组分含量由16.67%增加至55.03%,可能是随着处理pH值的提高,大米蛋白质的结构展开,分子之间形成次级键而发生交联聚集使得高分子量组分比例增加;但当处理pH值超过12时,分子之间的次级键被破坏,且蛋白质会被逐渐水解成分子量较小的多肽,从而使得低分子量组分含量增加[9-11]。
由表2可知:RP中>50 kDa的组分含量增加随着处理温度升高呈增加趋势;当热处理温度达到90 ℃时,>100 kDa 的组分含量增加至30.11%,原因是热处理导致RP中α-酸性亚基和β-碱性亚基形成α-β二聚体,二聚体又不断聚集形成新的聚集物[12]。
2.1.2 对大米蛋白质化学键的影响 从图1可见,RP在1 626,1 535,1 225 cm-1处有较强吸收峰,分别是由酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带伸缩振动产生的。碱处理、热处理对大米蛋白质化学键的影响结果一致,仅当处理pH值为12.0或处理温度为90 ℃时,由C—H弯曲振动在1 390 cm-1处产生的吸收峰强度减弱,表明大米蛋白质内部的氢键被破坏;由酰胺Ⅲ带在1 225 cm-1产生的吸收峰移动至1 277 cm-1,这与酰胺基团转变成羧基密切相关;在881 cm-1处有吸收峰出现,这是由羰基α位的C—H键弯曲振动产生的。
2.1.3 对大米蛋白质二级结构的影响 由表3可知,RP二级结构中α-螺旋47.30%,β-转角26.30%,β-折叠仅为8.77%。碱处理pH值为8.0~10.0时,随着处理pH值提高,α-螺旋、β-转角含量减少,β-折叠、无规卷曲含量增加,表明一定程度的碱处理使得蛋白质结构由有序向无序状态转变;当碱处理pH高于10.0时,α-螺旋、β-转角、β-折叠、无规卷曲的含量变化较小。
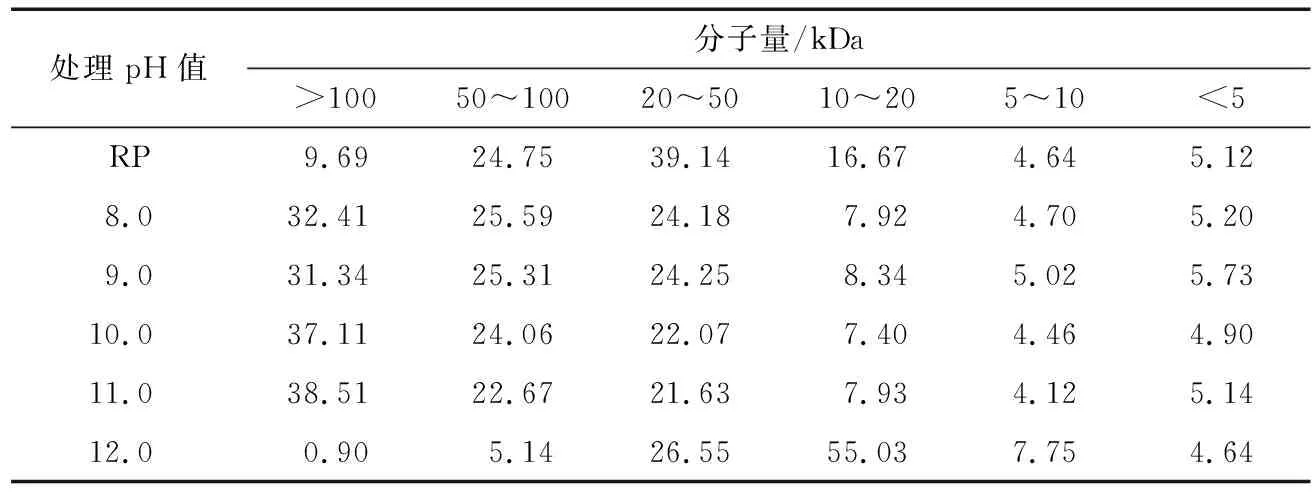
表1 碱处理对大米蛋白质分子量分布的影响Table 1 Molecular weight distribution of alkali treatment rice protein %
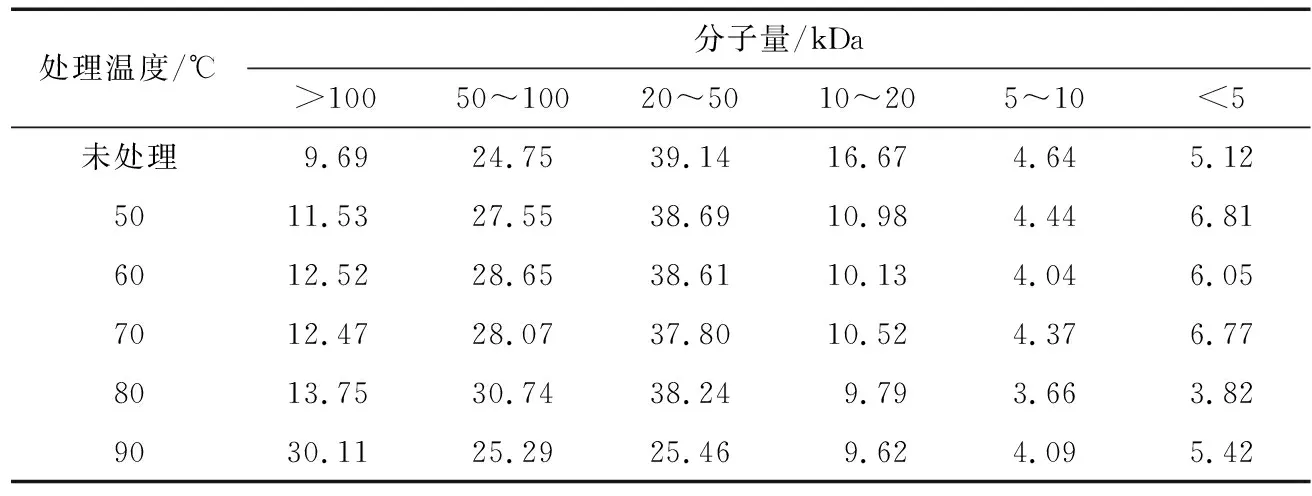
表2 热处理对大米蛋白质分子量分布的影响Table 2 Molecular weight distribution of heat treatment rice protein %

图1 碱处理、热处理大米蛋白质的红外光谱图Figure 1 Infrared spectrum of rice protein of alkali treatment and heat treatment表3 碱处理对大米蛋白质二级结构的影响

处理pH值α-螺旋β-折叠β-转角无规卷曲未处理47.308.7726.3017.488.033.7911.7523.5130.659.033.0211.8424.3330.8110.020.8124.2618.9435.7911.020.3723.6718.7237.2412.020.3123.4218.76 37.51
由表4可知,随着热处理温度的升高,蛋白质聚集程度呈递增趋势,与原RP相比,RP经90 ℃/40 min处理后,α-螺旋、β-转角含量下降了26.59%,7.27%,而β-折叠、无规卷曲增加了15.29%,18.76%,表明热处理使得蛋白质中α-螺旋、β-转角结构向β-折叠、无规卷曲结构进行了转化。在二级结构中,α-螺旋是最为紧密的,一定温度的热处理可以降低α-螺旋的含量,使得蛋白质分子有序结构向无序结构转化,结构变得松散。
2.1.4 对大米蛋白质表面疏水性的影响 蛋白质表面疏水性的变化可以直接反映蛋白质分子结构的改变,由图2(a)可知:与原RP相比,当碱处理pH值在8.0~10.0时,经碱处理后的RP其疏水性值有轻微提高,但变化幅度不明显;当处理pH值高于10.0时,随着处理pH值提高,RP的疏水性值显著增大,分别为758.21,995.72。这是因为一定程度的碱处理不会改变蛋白质结构,因此表面疏水性变化较小;当处理pH值超过一定范围后,蛋白质二硫键遭到破坏、亚基发生解离,使得包埋在分子内部的疏水基团暴露在分子表面,导致疏水性值增加[13]。

表4 热处理对大米蛋白质二级结构的影响Table 4 Effect of heat treatment on secondary structure of rice protein %
由图2(b)可见,热处理对RP表面疏水性的影响没有碱处理的效果明显,随着热处理温度升高,RP的疏水性值先减小后增加,且变化程度较小,原因是RP在较温和的热处理条件下结构不会发生改变,但当热处理温度为90 ℃时,蛋白质内部的二硫键被氧化,分子大幅度展开,包埋在分子内部的疏水基团暴露[14]。

图2 碱处理、热处理对大米蛋白质表面疏水性的影响
图2 Effect of alkali treatment and heat treatment on surface hydrophobicity of rice protein
2.2 碱处理、热处理对大米蛋白质功能性质的影响
2.2.1 对大米蛋白质溶解度的影响 由图3(a)可知,碱处理pH值为8.0~11.0时,RP溶解度无明显变化;当碱处理pH值为12.0时,溶解度由原RP的2.09%提高至5.16%,可能是蛋白质在强碱性条件下发生水解所致。蛋白质分子间作用力被水溶液破坏的因素通常包括静电引力和氢键作用力,但是当蛋白质处于强酸或强碱环境中,其构象发生改变,氢键发生断裂,某些极性基团解离,会使蛋白质分子表面基团带有相同电荷,从而增大了大米蛋白质的溶解性[15]。
由图3(b)可知,热处理温度为50~80 ℃时,溶解度随着热处理温度升高而增大,80 ℃时溶解度为3.04%;当处理温度高于80 ℃时,溶解度变化程度较小,可认为单独的热处理对大米蛋白质溶解度的改善效果并不明显。
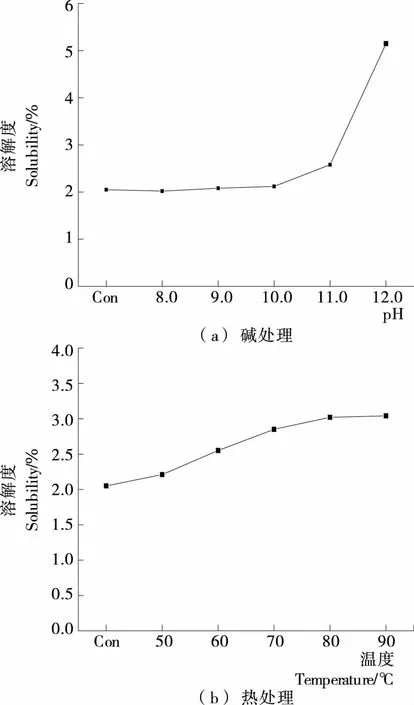
图3 碱处理、热处理对大米蛋白质溶解度的影响Figure 3 Effect of alkali treatment and heat treatment on rice protein solubility
2.2.2 对大米蛋白质乳化性(EA)与乳化稳定性(ES)的影响
由图4(a)可知,随着碱处理pH值提高,EA呈现先增加后下降趋势;处理pH值为10.0时,EA取得最大值(0.660),是原RP的2.42倍,这是因为溶解度的增加使得大米蛋白质易于吸附在油-水界面,而过高pH值的碱处理使其亲水性增强,乳化性能因而降低。ES随着处理pH值提高呈现递增趋势,在处理pH 12.0取得最大值(12.64%),是RP的1.12倍,表明碱处理对RP的ES影响较小。
由图4(b)可知,热处理温度为50~80 ℃时,随着处理温度升高,RP的EA逐渐增大;当热处理温度高于80 ℃后,随着温度升高,EA无明显变化;与原RP相比,热处理后RP的ES无明显变化。Mellema等[16]研究发现85 ℃/20 min热处理可使预酸化乳清蛋白质产生广泛聚集而改善其乳化性质。
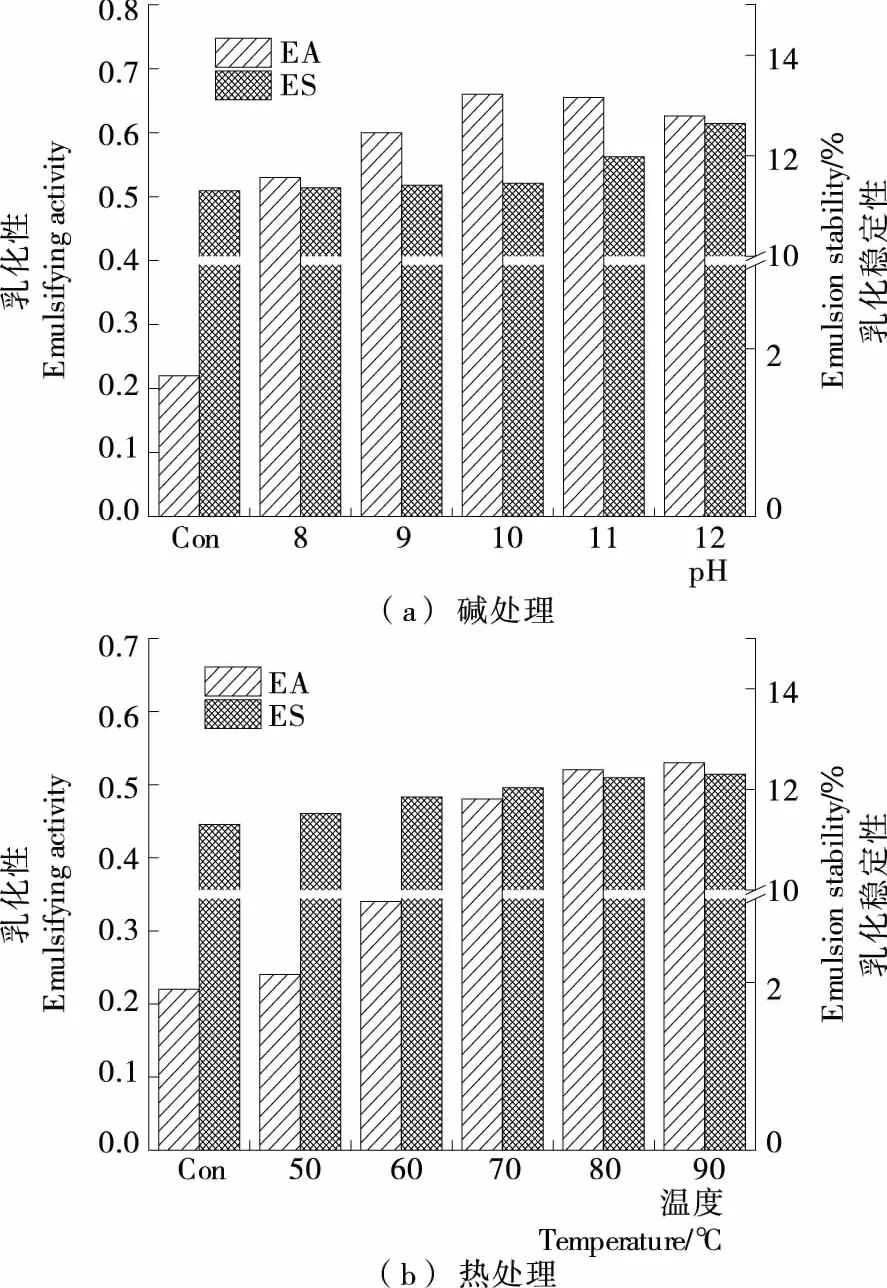
图4 碱处理、热处理对大米蛋白质乳化性及乳化稳定性的影响
图4 Effect of alkali treatment and heat treatment on the emulsifying and emulsifying stability of rice protein
2.2.3 对大米蛋白质起泡性(FA)与起泡稳定性(FS)的影响
蛋白质具有良好起泡性和起泡稳定性的关键条件是蛋白质的溶解性好且可以形成黏性膜[17]。由图5(a)可知,随着碱处理pH值提高FA呈递增趋势;当处理pH值为12.0时,FA取得最大值(135%),是原RP的2.51倍。随着处理pH值提高FS呈先增加后减小的趋势;当处理pH值为11.0时,取得最大值(72.81%),是原RP的1.42倍。FA变化趋势与溶解性变化趋势一致,这是因为随着蛋白质溶解性增大,蛋白质的内聚层迅速展开至气-液界面,从而提高了大米蛋白质的起泡性质[18]。
由图5(b)可知,当热处理温度在50~70 ℃时,FA和FS随温度升高显著增加;当温度高于70 ℃时,FA继续增加,但变化幅度较小,此时FS随着温度升高反而降低。热处理过程中引起FA和FS变化的主要原因可能是热处理影响了蛋白质的聚集和解离程度,从而导致分子机械强度以及柔韧性发生变化。
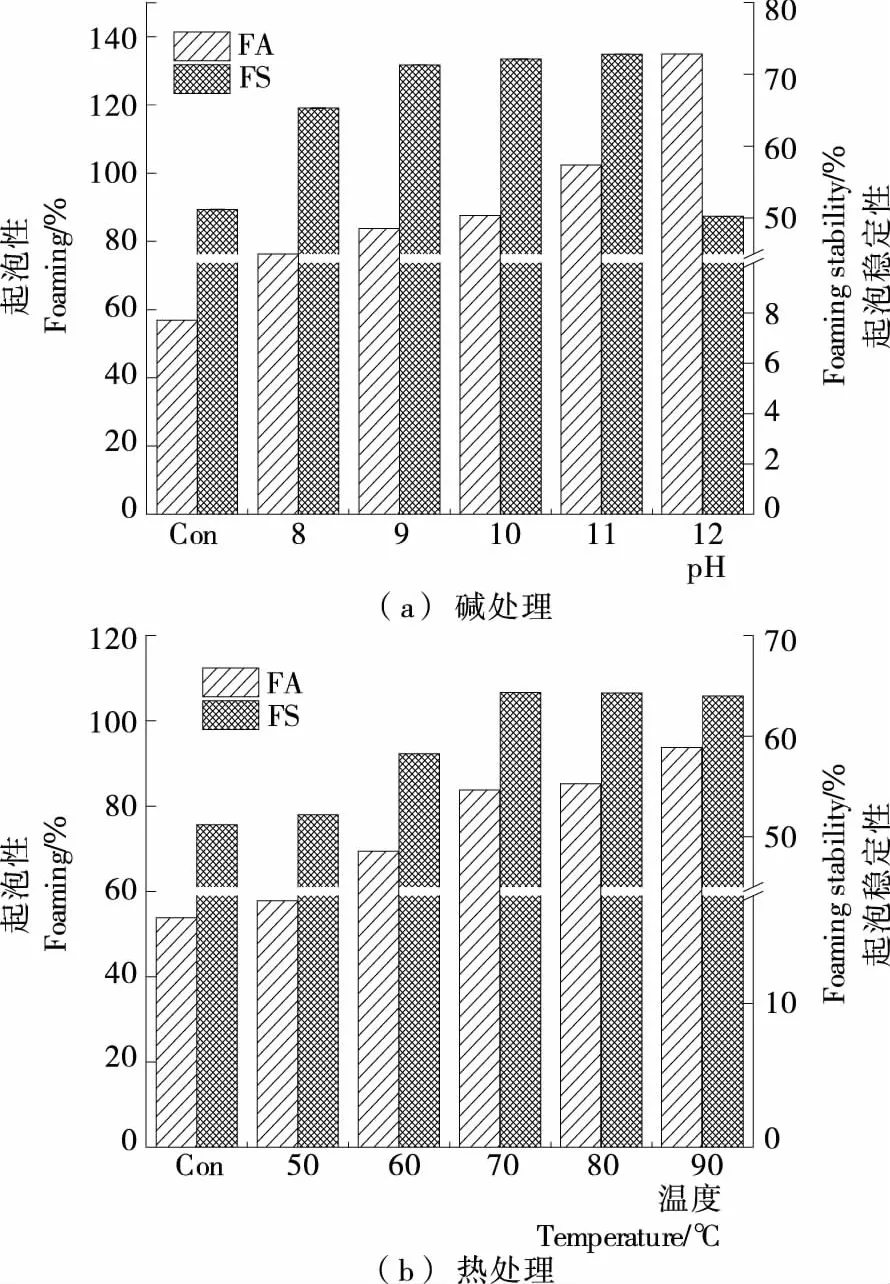
图5 碱处理、热处理对大米蛋白质乳化性与乳化稳定性的影响
图5 Effect of alkali treatment and heat treatment on the foaming and foaming stability of rice protein
3 结论
本研究考察了碱处理和热处理对大米蛋白质结构与功能性质的影响,采用pH 8.0,9.0,10.0,11.0,12.0的条件处理大米蛋白质40 min时,其功能性质都有不同程度提高;当处理pH值为8.0~11.0时,大米蛋白质二级结构展开,分子之间产生交联聚集,>100 kDa的组分含量增加;而当处理pH值为12.0时,大米蛋白质中的肽键被水解,<20 kDa的组分含量增加,此时蛋白质结构展开,结构由有序向无序状态转变。采用50~90 ℃/40 min的条件进行热处理,大米蛋白质结构和功能性质的变化与处理温度相关,只有处理温度达到90 ℃时,>100 kDa的组分含量才有增加,且大米蛋白质的机械强度和分子柔韧性也得到了一定程度的改善。结果表明经单独碱处理、热处理后,大米蛋白质的结构发生了改变,但溶解度改善效果不明显。后续研究将进一步考察pH协同热处理对大米蛋白质功能性质的影响,以探索碱处理、热处理和pH协同温度处理对大米蛋白质溶解度改善的贡献度。
