miR-126促进脊髓损伤模型神经干细胞的生长增殖和分化
2018-10-09张永涛高渊涛付明阳李鹏飞王春芳
张永涛 高渊涛 李 宵 付明阳 田 峰 李鹏飞 刘 芳 王春芳△
(1 山西医科大学实验动物中心, 实验动物与人类疾病动物模型山西省重点实验室, 太原 030001; 2 南昌大学玛丽女王学院, 南昌 330031)
脊髓损伤(spinal cord injury, SCI)是常见的一种创伤性疾病,有多种原因引起[1],近20年来发病率明显增高[2]。由其引起的严重残疾和医疗费用已成为患者及其家庭和社会的沉重负担[3-4]。目前,治疗脊髓损伤的措施主要有手术、药物以及细胞移植治疗等,神经干细胞治疗是最有前景的治疗方案[5],其可在损伤部位存活增殖并分化为神经元、星形胶质细胞和少突胶质细胞,且诱导宿主5-羟色胺能纤维的轴突再生,从而促进运动功能修复[6-8]。但神经干细胞的来源、免疫排斥以及伦理问题等一直制约着其临床应用[9-10]。如何诱导内源性神经干细胞活化、增殖及定向分化,已成为今后研究的趋势。神经干细胞能否很好地促进脊髓损伤功能修复,主要取决于神经干细胞在损伤部位的生长、增殖以及向神经元的分化。microRNA是一种小分子非编码RNA,近期研究报道其广泛表达于中枢神经系统[11],与靶基因的mRNA特异性相结合,在转录后水平调控着神经干细胞的生长、增殖、分化和凋亡等多种生物学功能。其中miR-126对神经干细胞的生长增殖、分化的调节作用尤其重要[12-13],但其具体作用机制尚不清楚。有报道miR-126可以通过绑定到同源框来调控HOXA9,而HOXA9又是脊髓运动神经元的发育过程中的关键基因[15]。因此,本研究探讨miR-126通过调节HOXA9的表达发挥对神经干细胞的调控作用。
1 材料和方法
1.1 实验动物
SPF级成年FVB小鼠42只,体质量25~30g,由山西医科大学实验动物中心提供,恒温恒湿,昼夜各半,自由饮食。
1.2 主要试剂
H-E染色试剂盒(Solarbio,中国);尼氏染色试剂盒(Beyotime,中国);microRNA Isolation Kit (Life Technologies,美国); Prime-Script RT试剂盒(TaKaRa,Tokyo,日本);SYBR®Select Master Mix(Applied Biosystems,美国);增强型RIPA裂解液(Boster,中国);nestin、HOXA9兔抗鼠多克隆抗体、GAPDH兔抗鼠多克隆抗体、羊抗兔抗体(HRP)(Abcam,美国)。
1.3 模型制作
将小鼠随机分为实验组(36只)和对照组(6只)。实验组吸入麻醉成功后固定于手术台,应用Impactor M-Ⅲ spinal cord contusion system(W. M Keck Center for Collaborative Neuroscience Rutgers, the State Univesity of New Jersey, USA),采用Allen法制作第10胸椎(T10)脊髓损伤模型(质量5g,垂直高度25mm)。术后常规逐层缝合。术后3d,肌注青霉素G(4000u),预防感染。每天辅助排尿,直至完全恢复自主排尿。
1.4 运动功能评分
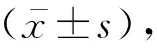
1.5 H-E染色,尼氏染色
BMS评分后,0.9%生理盐水心灌注,然后4%多聚甲醛灌注小鼠。随后,解剖出脊髓损伤部位,置于4%多聚甲醛内固定24h,常规梯度乙醇脱水,二甲苯透明,石蜡固定包埋备用;Leica切片机(RM2245 USA)每张5μm连续切片,60℃烘箱2h烘干备用。常规脱蜡至水,按H-E染色、尼氏染色试剂盒说明书进行染色后,梯度乙醇脱水、二甲苯透明,中性树脂封片后镜下观察并拍片记录。
1.6 RT-PCR
提取同一节段的脊髓,应用microRNA Isolation Kit提取microRNA和总RNA。Taqman microRNA Assays试剂盒进行miR-126实时定量PCR(RT-PCR)检测。miR-U6作为内参。为了测定mRNA的表达,使用Prime-Script RT试剂盒在PCR仪(Eppendorf, USA)上42℃ 60min,70℃ 15min进行逆转录(RT)反应,合成第一链。然后使用SYBR®Select Master Mix,在7300 Real Time PCR System (Applied Biosystems, USA)进行95℃ 10min预变性。95℃ 15s和60℃ 1min,40个循环。最后采用delta-delta CT方法定量基因表达变化,以GAPDH作内参,引物由华大基因(Beijing Genomics Institute, 中国)设计和合成。
1.7 免疫印迹检测
取脊髓组织样本加入增强型RIPA裂解液和1%PMSF,冰上研碎,4℃孵育4h后,12.0×103r/min,4℃ 下离心20min,取上清,经BCA蛋白浓度测定后-80℃保存备用。应用等质量样本30μg进行凝胶电泳,依照marker条带切下目的条带,转膜15min,5%脱脂牛奶(伊利,中国)室温下封闭非特异性条带2h,一抗(1∶1000)4℃孵育过夜,TBS-T清洗后,二抗(1∶2000)室温下避光孵育2h,TBS-T清洗后拍片保存,然后使用Quantity One 4.6.2 software (Bio-Rad, USA)进行量化分析。
1.8 统计学处理
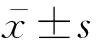
2 结果
2.1 脊髓损伤不同时期运动功能评分
为了检测小鼠脊髓损伤后运动功能的修复,应用BMS评分评估了小鼠后肢运动功能,术前实验组与对照组BMS评分均为9分,实验组术后在1、3、7、14、21、28d BMS评分(表1)显示,1、3d时运动功能完全丧失,7d时运动功能出现恢复迹象,与第1、3天相比,14、21d恢复较为显著,第28天时趋于平稳,与21d时相比差异无统计学意义。

表1 对照组与实验组不同时期的BMS评分
**P<0.01vs1d
2.2 脊髓损伤后不同时期损伤情况及尼氏体的数量变化
为了检测脊髓损伤后不同时期脊髓损伤部位病理学的变化,分别在不同时期取相同部位组织,石蜡包埋切片后进行H-E染色、尼氏染色。与对照组(图1A1、A2)相比,损伤后第1天时(图1B1、B2)可见局部正常组织结构形态完全丧失,细胞排列次序紊乱,出现大量的核碎裂,核浓缩,尼氏体大量减少,其间大量血细胞及炎性细胞积聚。3d时(图1C1、C2)进一步加剧,尼氏体基本消失,第7天(图1D1、D2)血细胞及渗出的炎性细胞被吸收,疏松紊乱的组织间隙被大量的组织间质充填。在不规则的组织中可见少量尼氏体出现。第14天(图1E1、E2)水肿消退,并可见纤维疤痕及空洞形成。21d后(图1F1、G1、F2、G2)纤维组织进一步增多,其间可见散在的尼氏体。
2.3 脊髓损伤后不同时期nestin的表达
为观察神经干细胞在脊髓损伤后不同时期的变化,在不同时期对脊髓损伤部位神经干细胞的标记物nestin mRNA及其相应蛋白进行检测。结果显示,在脊髓损伤后早期Nestin mRNA的表达量(图2A)明显下降,而后逐渐升高,在21d(图2A)时达到高峰后再次下降。Nestin蛋白(图2B)的表达量具有相同趋势。

图2 Nestin mRNA (A)及其相应蛋白(B)表达的变化
2.4 脊髓损伤后miR-126的表达
为观察脊髓损伤后不同时期miR-126的表达变化情况,在不同时期脊髓损伤部位进行RT-PCR检测,所得数据显示,脊髓损伤后miR-126总体表达量下降。早期(1~7d)下降最为明显,而后逐渐升高,在21d时达到高峰,表达量高于对照组,而后再次下降(图3)。
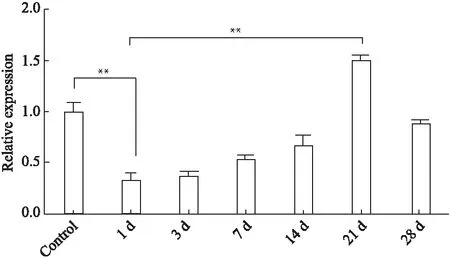
图3 对照组与实验组不同时期miR-126的相对表达量
2.5 脊髓损伤后HOXA9的表达
为了探讨脊髓损伤后miR-126是通过何种机制来调节神经干细胞的分化,从而促进脊髓功能修复。在不同时期对脊髓损伤部位miR-126的下游靶基因HOXA9进行RT-PCR、免疫印迹检测,所得数据显示,脊髓损伤后HOXA9表达量早期与对照组相比明显升高,而后逐渐下降,在21d下降最为明显(图4)。

图4 对照组与实验组不同时期HOXA9 mRNA (A)及蛋白质(B)的相对表达量
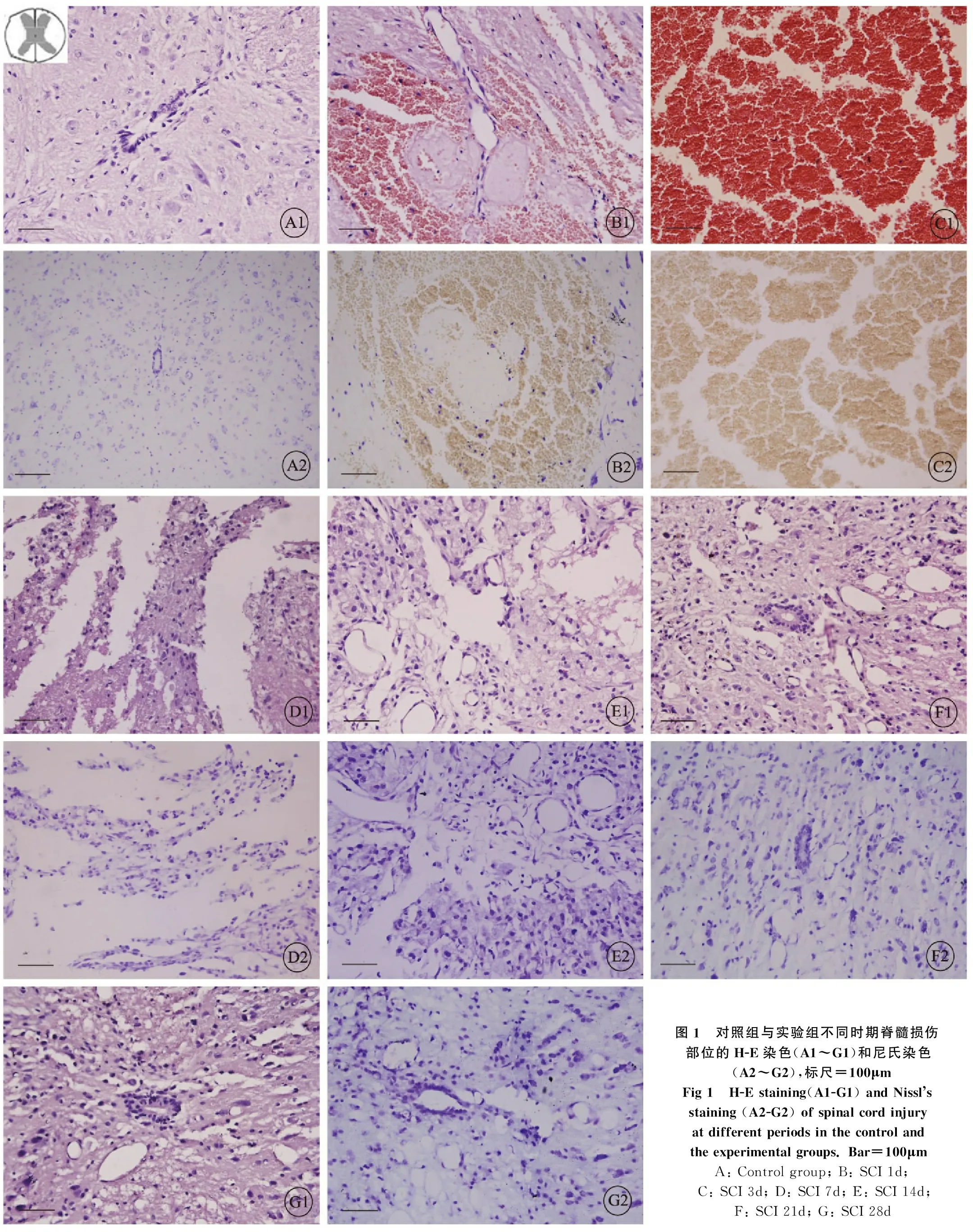
图1 对照组与实验组不同时期脊髓损伤部位的H-E染色(A1~G1)和尼氏染色(A2~G2),标尺=100μmFig 1 H-E staining(A1-G1) and Nissl s staining (A2-G2) of spinal cord injury at different periods in the control and the experimental groups. Bar=100μmA: Control group; B: SCI 1d; C: SCI 3d; D: SCI 7d; E: SCI 14d; F: SCI 21d; G: SCI 28d
2.6 miR-126、HOXA9、nestin、尼氏体的相关性分析
结果(表2)显示miR-126与nestin、尼氏体呈正相关,与HOXA9呈负相关。HOXA9与miR-126、nestin、尼氏体呈负相关。

表2 miR-126、HOXA9、nestin、尼氏体相关性分析(r)
*P<0.05,**P<0.01
3 讨论
脊髓损伤是一种严重的创伤性疾病,多因创伤导致局部神经组织、细胞变性坏死以及脊髓神经连续中断,从而引起损伤平面以下感觉、运动及自主神经功能障碍。神经元的受损部位是引起脊髓功能障碍的主要因素,如何促进受损部位神经元的再生,已成为近期研究的热点。目前,在治疗脊髓损伤的众多方案中,神经干细胞治疗是最有前途的治疗方案之一[5]。神经干细胞具有自我更新、增殖、迁移、定向分化的潜能,其分化的神经元可替代坏死丢失的神经元并与周围正常神经元形成新的突触,重建传导通路[8]。神经干细胞治疗主要有2种方式: (1) 应用外源性神经干细胞进行移植;(2) 诱导内源性神经干细胞增殖、分化。由于外源性神经干细胞的来源、免疫排斥以及伦理等问题制约其临床应用[9-10],因此,如何诱导内源性神经干细胞增殖、分化成为近期研究的热点。
miR-126是众多microRNAs中的一种类型,其在血管内皮细胞中高度富聚[17],能与靶基因的mRNA特异性结合,在转录后发挥调控作用;作为一种调控基因,参与细胞的生长增殖、分化、凋亡等多种生物进程的调控[18]。以往的研究表明miR-126在维持血管的完整性方面发挥着重要的作用,并且在胚胎发育过程中及损伤后促进血管生成[19-21]。近期Hu等[22]报道在脊髓损伤后上调miR-126表达,其通过调控SPRED1、PIK3R2和VCAM1 3个靶基因的mRNA和蛋白质的表达,促进血管新生和减弱炎症损伤,促进脊髓功能修复。Zhang等[13]在体外神经干细胞培养过程中显示miR-126能够促进神经干细胞生长增殖并抑制其凋亡。易松敏等[23]报道将脊髓源性神经干细胞诱导分化为胆碱能神经元后,定量检测分化前、后miR-126的表达变化,结果显示在分化后的胆碱能神经元中miR-126的表达明显高于未分化的神经干细胞。Wei等[24]在神经干细胞与运动神经元miRNA差异表达分析中也证实miR-126在运动性神经元中的表达水平显著高于神经干细胞。这表明miR-126在神经干细胞生长增殖及分化过程中发挥着重要调控作用。而在体内miR-126是否也同样具有促进神经干细胞生长增殖和分化的作用,尚未见报道。本实验结果显示,脊髓损伤急性期miR-126表达量和神经干细胞数量明显下降,同时尼氏体也大幅度减少甚至消失;进入亚急性期后,随着miR-126 表达量升高,神经干细胞及尼氏体也逐渐增多。因此,推测在体内miR-126对神经干细胞的生长增殖和分化也具有一定的调节作用。
虽然miR-126在神经干细胞向神经元生长增殖、分化过程中具有重要调控作用,但其具体作用机制尚未见详细报道。Wei等[24]在3种靶基因预测程序中检测到HOXA9是miR-126的下游靶基因,miR-126对其有负向调控作用。因此,本次实验又对HOXA9进行了检测,结果显示在miR-126表达量较低时HOXA9的表达量显著升高,而尼氏体数量减少;随着miR-126的逐渐升高,HOXA9出现下降趋势,同时尼氏体数量也逐渐增加,运动功能也得到一定的恢复。经统计学分析显示,HOXA9表达与miR-126表达及尼氏体数量呈负相关,miR-126与神经干细胞和尼氏体数量呈正相关。据报道,人类的HOX基因共有39个,分布在4个染色体组。通过HOX基因同源盒序列的比较显示,只有HOXA9包含miR-126的结合位点[25]。Shen等[26]报道miR-126在HOXA9同源盒上的靶点高度保守,miR-126可以通过降解HOXA mRNA来下调HOXA9蛋白水平。而Hox蛋白又是脊髓运动神经元定性和组成的重要决定因素[27],因此,推测miR-126可能在促进神经干细胞生长增殖的同时也可通过负向调控HOXA9表达,提高神经干细胞向神经元分化的比例,进而促进受损脊髓神经功能的修复。一种基因可以调控多种细胞的生长增殖、分化,同时一种细胞也受多种基因调控。在本次实验中仅观察到miR-126在治疗脊髓损伤过程中,可能在促进神经干细胞生长增殖的同时,通过负向调节HOXA9来提高其向神经元的分化,但这只是其中的一小部分,在此过程中也可能有其他因素的共同参与。
