内质网应激PERK-ATF4-CHOP信号通路参与慢性应激大鼠下丘脑神经细胞损伤
2018-10-09史为博易善勇牛世霸王松军李英敏
史为博 易善勇 王 贺 牛世霸 王松军 李英敏 丛 斌
(河北医科大学法医学系, 河北省法医学重点实验室, 河北省法医分子鉴定协同创新中心, 石家庄 050017)
应激是机体通过神经、内分泌以及其他系统共同参与和调节来应对危险而做出的综合反应[1]。机体通过适当地调节各系统代谢水平,增加其内稳态的能力,从而有效的减少危险因素对机体造成的影响[2]。但是过度应激可造成机体的损伤,影响机体的正常心理和生理功能[3]。普遍认为下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis, HPA轴)在机体应激反应中起着核心作用。目前研究表明,长时间应激可以导致机体出现不同程度的病理性损伤[4]。但是在应激过程中下丘脑神经细胞是否发生病理性改变,目前未见详细报道。外界刺激可使内质网稳态紊乱,导致未折叠或者错误折叠蛋白聚集以及病理过程,即内质网应激(endoplasmic reticulum stress, ERS)[5]。当ERS持续时间过长或者过强时,可通过激活下游信号通路诱导细胞死亡[6]。但是机体在应激过程中,下丘脑神经细胞是否发生了损伤从而影响HPA轴的功能以及内质网应激活化的双链RNA依赖的蛋白激酶样内质网激酶(PKR-like endoplasmic reticulum kinase, PERK)信号通路是否参与了这一损伤过程,目前的研究不够详尽。因此本研究在成功建立不同时程应激大鼠模型的基础上,系统观察糖皮质激素水平变化、下丘脑组织病理学改变以及内质网应激PERK信号通路相关蛋白的表达变化。
1 材料和方法
1.1 实验动物
采用健康成年雄性SD大鼠,体质量250g±20g,由河北医科大学实验动物中心提供。在标准实验条件下,12h昼夜循环,恒温25℃,自由进食水。本研究遵循河北医科大学实验动物委员会指导原则,所有处理尽量减少动物使用量,减轻动物的痛苦。实验大鼠随机分为以下组别: 1、3、7、14、21d束缚加冰水游泳组(RS+IS group)以及相应对照组,每组6只。
1.2 主要试剂和仪器
ELISA试剂盒(上海蓝基化学试剂有限公司);硫堇粉末(Alfa Aesar(天津)化学有限公司);兔来源糖调节蛋白78(glucose-regulated protein 78, GRP78)多克隆抗体、兔来源CHOP(生长抑制和DNA损伤诱导基因153,growth arrest and DNA-damage-inducible gene 153, GADD153)多克隆抗体、兔来源激活作用转录因子4(artificial transcription factor 4, ATF4)多克隆抗体;全景细胞组织定量分析系统(MMTC)(Tissue Gnostics中国)。
1.3 建立应激模型
模型是参照前期研究[7]改良而来,采用将大鼠仰卧位固定每天8h(8:00~16:00)的束缚处理,同时禁食水,束缚结束后进行5min冰水游泳。应激各组进行束缚处理时,正常对照组大鼠于饲养笼中,同样禁食水8h,其余时间各组大鼠自由进食、饮水。
1.4 酶联免疫吸附试验方法
经腹主动脉取血保留血清。向准备好的反应孔中加样,37℃孵育1h,洗涤;加入酶标抗体,37℃孵育0.5h,洗涤;加入底物显色液,37℃孵育20min;终止反应,处理结果。
1.5 组织处理
根据George Paxinos大鼠脑立体定位图谱[8],在大鼠头颅冠状位距前囟-1.80mm处准确切取下丘脑位置,梯度乙醇脱水、二甲苯透明、石蜡包埋。多聚赖氨酸处理玻片,连续石蜡切片(5μm)。
1.6 硫堇染色方法
石蜡切片置于60℃烤箱1h,常规脱蜡、水化,浸入0.5%硫堇溶液25s,水洗,梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.7 免疫组织化学显色
石蜡切片60℃烘干1h,常规脱蜡、水化组织切片,微波抗原修复97℃,冷却至室温;甲醇H2O2(5% H2O2)处理20min以抑制内源性过氧化物酶,山羊血清封闭30min,滴加一抗(GRP78多克隆抗体,1∶200,ATF4多克隆抗体,1∶100,CHOP多克隆抗体,1∶200),湿盒内4℃过夜;加入二抗(生物素标记山羊抗鼠IgG);加入碱性磷酸酶标记链霉卵白素;DAB显色;水溶性封片剂封片,普通光学显微镜下观察。
1.8 细胞计数及统计学处理
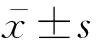
2 结果
2.1 糖皮质激素水平变化
与正常对照组相比,应激组大鼠血清中糖皮质激素水平从第3天开始显著性增高,7d达到高峰,14d维持在较高水平,但21d时糖皮质激素水平显著性降低,但与正常对照组之间无明显差异(图1)。

图1 不同时程应激对血清糖皮质激素浓度的影响
2.2 下丘脑神经细胞病理形态变化
正常对照组神经细胞结构清晰,尼氏体均匀分布于胞质内。应激1d组和3d组,尼氏体无明显变化;随着应激时间的延长,7d组下丘脑部分神经细胞发生水肿,尼氏体结构不清;14d组部分细胞内尼氏体消失,神经细胞固缩浓染,21d组与14d组相比上述病理性改变更为明显(图2)。
2.3 GRP78、ATF4、CHOP的表达变化
GRP78、ATF4、CHOP均表达于细胞质。结合MMTC分析系统,GRP78在1d时(21.15±2.80)开始显著性增高(P<0.05),3d(40.02±3.14)达到高峰(P<0.01),7d(24.10±1.97)维持在较高水平(P<0.01),14d(6.13±0.85)显著性降低,且与正常对照组(6.13±1.35)相比无明显差异(P>0.05),21d(3.51±0.56)时与正常对照组相比明显减少(P<0.05)(图3)。ATF4在1d(11.34±1.85)、3d(22.89±2.18)、7d(28.66±2.42)、14d(26.60±2.29)以及21d(22.69±1.97)时均比正常对照组(6.80±1.64)显著性增高(P<0.05),且7d达到高峰(图4)。CHOP在应激1d时(3.07±1.58)与正常对照组(2.92±1.65)相比无增加(P>0.05),随应激时间的延长,应激3d(13.14±2.48)和7d(21.03±3.31)明显增高(P<0.01),14d(45.55±3.31)达到高峰(P<0.01),21d(28.33±3.56)维持在较高水平(P<0.01)(图5)。

图2 不同时程应激大鼠下丘脑硫堇染色。A’~F’: 分别是对图A~F的矩形区域的放大。A~F: 标尺=100μm, A’~F’: 标尺=50μm.图3 不同时程应激大鼠下丘脑GRP78染色(A)和MMTC分析对照组(n=6)。A’~F’: 分别是对图A~F的矩形区域的放大;MMTC分析所得散点图位于图A~F左上角;A~F: 标尺=100μm, A’~F’: 标尺=50μm.图4 不同时程应激大鼠下丘脑ATF4染色(A)和MMTC分析对照组(n=6)。A’~F’: 分别是对图A~F的矩形区域的放大;MMTC分析所得散点图位于图A~F左上角;A~F: 标尺=100μm,A’~F’: 标尺=50μm.图5 不同时程应激大鼠下丘脑CHOP染色(A)和(B)MMTC分析对照组(n=6)。A’~F’: 分别是对图A~F 的矩形区域的放大;MMTC分析所得散点图位于图A~F左上角;A~F标尺=100μm,A’~F’: 标尺=50μm.
3 讨论
应激是机体不可避免的生活经历,它可引起内稳态紊乱并对机体各脏器和系统造成影响,其中就包括中枢神经系统[10]。急性应激反应对机体有着积极影响,而反复的长时程应激刺激常常是有害的,可对全身各器官造成不同程度的损伤,可对机体的功能、代谢造成不良影响[11]。近年来应激对中枢神经系统的影响,是研究者们关注的问题。HPA轴是应激反应的中枢,以往研究表明慢性应激是引起焦虑、恐惧、重度抑郁以及神经退行性疾病的一个重要原因[12]。本研究采用了大鼠束缚应激加冰水游泳模型,最长时程达21d,旨在模拟机体在慢性心理性挫折和生理性压力下,机体自身调节能力的变化以及对机体造成的影响。
3.1 血清糖皮质激素浓度变化
各种内外因素的刺激均可引起HPA轴的兴奋,最终导致肾上腺皮质释放大量的糖皮质激素来应对外界刺激,因此机体中糖皮质激素水平的变化能够很好的反应机体抵抗外界应激原的能力。本研究结果显现随着应激时间的延长,血清中糖皮质激素水平呈现出明显的增高趋势,表明机体通过调节HPA轴增加了对外界刺激的防御能力,从而使机体维持在正常水平。但是随着应激时间的延长,21d时大鼠血清中糖皮质激素含量显著性的降低,表明长时间的应激已经超过了机体自身的调节能力,使机体抗损伤的能力显著性降低,这可能引发组织细胞的病理性改变。
3.2 下丘脑神经细胞病理学改变
本实验通过能够特异标记尼氏体的硫堇染色观察到随应激时间的延长,14d组及21d组下丘脑部分神经细胞尼氏体消失、细胞固缩浓染。结果提示随应激时间的延长,下丘脑神经细胞的形态发生了改变,出现了明显的损伤,可能会使HPA轴的调节功能降低,机体抗应激的能力减弱。
3.3 内质网应激PERK信号通路相关蛋白的表达变化
目前的研究表明,内质网应激参与多种神经退行性疾病的病变过程[13]。内质网应激是细胞发挥自我保护的一种机制,但过度的内质网应激可造成机体的损伤。GRP78仅表达在内质网上,作为内质网应激反应活化的标志性因子,它不仅决定着未折叠蛋白反应的启动与否,而且在促进未折叠蛋白加工成熟以及维持内质网内稳态方面起着关键作用,因此它对细胞具有保护作用[14]。本研究中GRP78的表达量呈现出一种先增高后降低的趋势,应激21d时其表达量较正常对照组显著性降低,提示随着应激时间的延长,GRP78对下丘脑神经细胞的保护作用明显减弱,使细胞不能恢复稳态,将激活下游一系列信号通路,启动并诱导细胞发生损伤及死亡。
CHOP是内质网应激诱导细胞死亡的重要因子[15]。正常情况下CHOP的表达量很低。但当过强或者持续时间过长的内质网应激发生时,CHOP的表达量显著性增加,其持续的高表达可以阻滞细胞周期并诱导细胞死亡[16]。PERK信号通路是导致CHOP表达增高的最主要的途径[17]。过强的内质网应激可以激活下游信号通路中的ATF4,ATF4通过增加其基因转录水平进而诱导CHOP的持续表达[19]。本研究结果表明应激可导致内质网PERK-ATF4-CHOP通路被激活,ATF4和CHOP呈现出持续性的高表达。正是由于CHOP蛋白的持续性表达可诱导细胞发生损伤及死亡,与本实验结果显示的14d开始神经细胞的病理性改变相一致。因此,提示较长时程的应激导致的下丘脑神经细胞的损伤与内质网应激PERK-ATF4-CHOP通路的激活及高表达存在因果关系。
