苦水玫瑰快繁技术体系研究
2018-10-09吴雁斌高彦萍梁宏杰吕和平
张 武 ,吴雁斌 ,高彦萍 ,梁宏杰 ,吕和平
[1.甘肃省农业科学院马铃薯研究所,甘肃 兰州 730070;2.甘肃省马铃薯脱毒种薯(种苗)病毒检测及安全性评价工程中心,甘肃 兰州 730070]
食用玫瑰花(Edible roses)为蔷薇科蔷薇属植物,属常绿落叶灌木,花季为每年的5—6月,色彩丰富,芳香馥郁[1],原产中国,具有理气解郁、柔肝醒脾、活血化瘀等功效,是食品、食用香精等产品的重要原料[2]。苦水玫瑰(R.sertata×R.rugosa)已有近200年的栽培历史,盛产于甘肃省永登县苦水镇,由于当地特殊的土质、水和气候等自然因素,苦水玫瑰香型独特、含油量高达0.039%[3]。其花蕾小,干制后为深紫色,花瓣可入药、酿酒及用作食品添加剂,具有较高的经济价值和广阔的开发前景。传统栽培技术的繁殖方法多采用先扦插生根、后嫁接培养的分步嫁接繁殖法,苗木繁育周期长、工序繁杂[4],难以满足市场对苗木的需求。组织培养大量快繁技术是目前最先进的植物快繁技术。玫瑰组织培养快繁技术的关键是丛生芽的诱导、增殖与生根、组培苗的炼苗与移栽。据相关研究报道,食用玫瑰试管苗生根较为困难,且生根率低、发根周期长[5],是制约优良品种扩大栽培形成产业化的关键因素。为了建立玫瑰无毒试管苗高效快速繁殖技术体系,满足生产中的苗木需求,我们对苦水玫瑰的组培苗诱导、增殖、继代与生根和炼苗移栽等技术进行了研究,以期为甘肃苦水玫瑰脱毒苗工厂化生产提供基础。
1 材料与方法
1.1 试验材料
甘肃苦水玫瑰植株采自甘肃永登县苦水镇苦水街村玫瑰生态园。
1.2 试验方法
1.2.1 外植体筛选 6月份从永登县苦水镇露地栽培的苦水玫瑰植株上选取半木质化带芽枝段,剪切整理成带1~2个叶芽的茎段,用流水冲洗材料2 h,然后在超净工作台上用70%CH2(OH)5清洗0.5~1.0 min,无菌水清洗3次,10 g/kg的HgCl2溶液清洗4~5 min,最后用无菌水清洗6次。在MS培养基上进行初代培养,依据发芽率大小确定适宜的外植体。
1.2.2 增殖诱导 增殖诱导培养基设置7个处理,即 WPM+6-BA(0.6、0.9、1.2、1.5、1.8、2.1、2.4 mg/L)+IAA 0.2 mg/L。以MS培养基上的茎段发的芽为外植体,转接于增殖培养基上,附加蔗糖20 g/L、琼脂12 g/L,pH为5.8,培养条件为温度(25±2)℃,光照强度2 000~2 500 lx,光照时间12 h/d,30 d后观察生长增殖情况。每个处理接种10瓶,每瓶接种5个外植体,3次重复。同时考察外植体继代的次数(1、2、3、4、5、6次)对增殖诱导的影响,继代30 d后统计其增殖倍数,培养条件同上,每个处理接种10瓶,每瓶接种5个外植体,3次重复。
1.2.3 组培苗瓶内生根 瓶内生根培养基共9个处理,即 WPM+IBA(0.1、0.2、0.5 mg/L)+NAA(0.1、0.3、0.5 mg/L)。经诱导增殖获得的试管芽长到高3 cm左右时,将其转移至瓶内生根培养基上,暗培养7 d,再进行光照培养,培养出完整的小植株,统计根长,生根系数,生根率(用游标卡尺测量每条根长,然后取平均数,生根系数=总根数/总外植体数,生根率=已生根外植体数/总外植体数),其他培养条件同上。每个处理接种10瓶,每瓶接种5个外植体,3次重复。
1.2.4 炼苗与移栽 组培苗对外界环境的适应需要一个渐进的过程。移栽前将玫瑰试管苗在光照培养室中培养14 d,然后打开瓶盖在温室高湿环境遮阴练苗5~7 d,幼苗从瓶内取出后,将根部培养基清洗干净,植入育苗床或育苗盘,尽量减少根部损伤。基质采用60%腐殖质、30%田园土和10%蛭石的混合物,移栽后的小拱棚遮阴保湿15 d,移栽过程中每隔7 d浇水1次。
2 结果与分析
2.1 丛生芽增殖与诱导
从表1知,6-BA在0.6~1.5 mg/L时,随着浓度的增加,苦水玫瑰的丛生芽增殖倍数呈逐步上升趋势。6-BA浓度达到1.5 mg/L时,丛生芽的增殖倍数达到最大值,为3.56。当6-BA浓度超过1.5 mg/L时,其丛生芽的增殖倍数随着浓度的升高呈下降趋势。6-BA浓度达2.4 mg/L时,丛生芽生长速度较缓慢。低浓度的6-BA其增殖倍数虽可达到1.52,但丛生芽的生长状况较差,且有死亡现象。
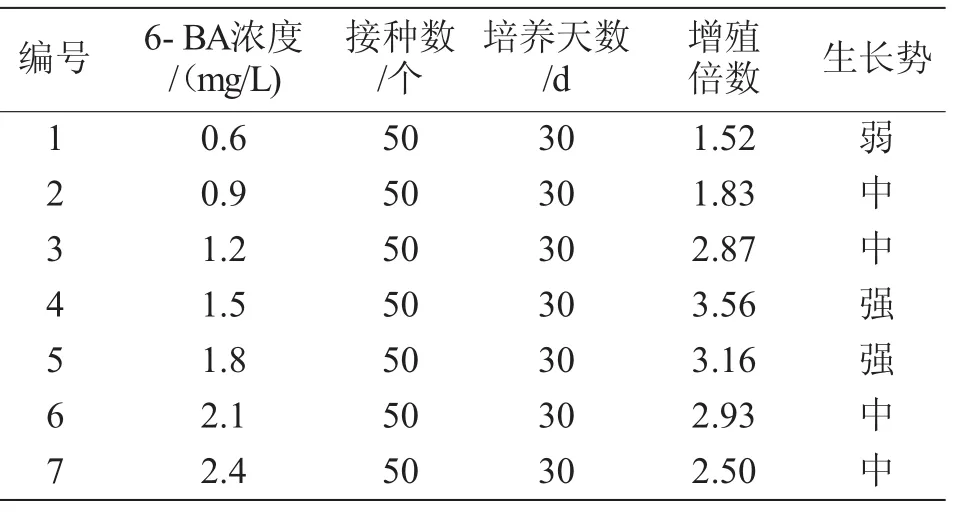
表1 6-BA浓度对苦水玫瑰丛生芽增殖与诱导的影响
2.2 继代次数对丛生芽增殖与诱导的影响
从表2可以看出,随着继代次数的增加,苦水玫瑰丛生芽增殖呈现出较好的增长趋势。继代1次时,增殖倍数最低,为3.82,且生长状况中等,新生芽平均株高为31.78 mm;继代2次,丛生芽增殖倍数急剧增加,为4.30,新生芽平均株高为37.36 mm,生长势强;继代4次后,芽增殖倍数达到5.43,且芽体颜色和芽的质量均较佳,但新生芽较继代3次的平均株高38.90 mm有所下降,为37.42 mm;随后继代5次、6次的丛生芽增殖倍数和继代4次相近,趋于稳定,为5.43 mm和5.37 mm,但是新生芽的平均高呈现下降趋势。
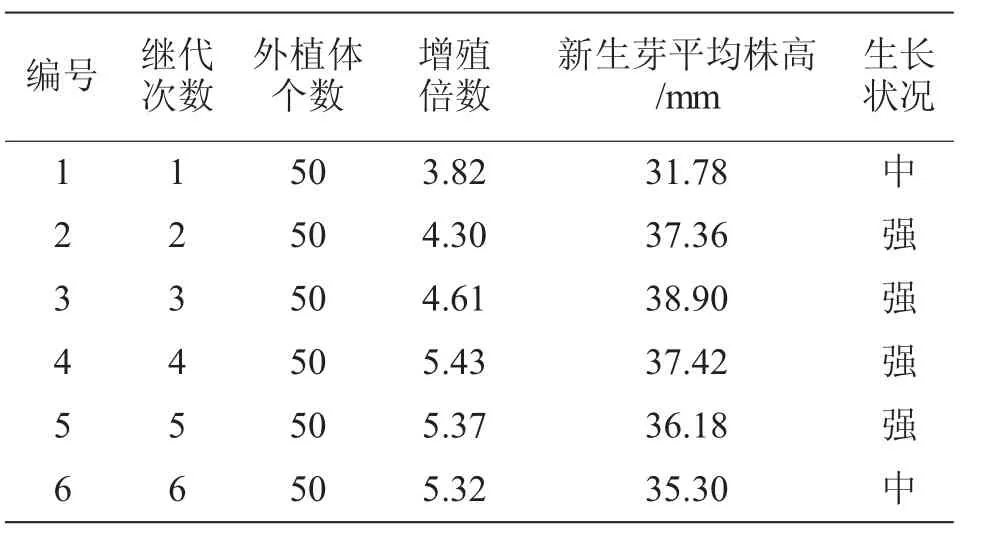
表2 继代次数对苦水玫瑰丛生芽增殖诱导的影响
2.3 试管苗的瓶内生根
试验表明,随着IBA和NAA浓度的增加,生根时间随之减少,为40~60 d。从表3可以看出,以WPM为基本培养时,随着IBA浓度的增加,苦水玫瑰试管苗的根长出现先升高后下降的趋势。当IBA浓度为0.1 mg/L、NAA浓度为0.3 mg/L时生根率最高,为82.68%,根长为31.22 mm。在WPM培养基中,随着IBA浓度的增加,其生根率呈现先增加,而后缓慢降低的趋势,NAA浓度为0.5 mg/L、IBA浓度为0.15 mg/L时生根率可达到69.54%,根长为20.36 mm。
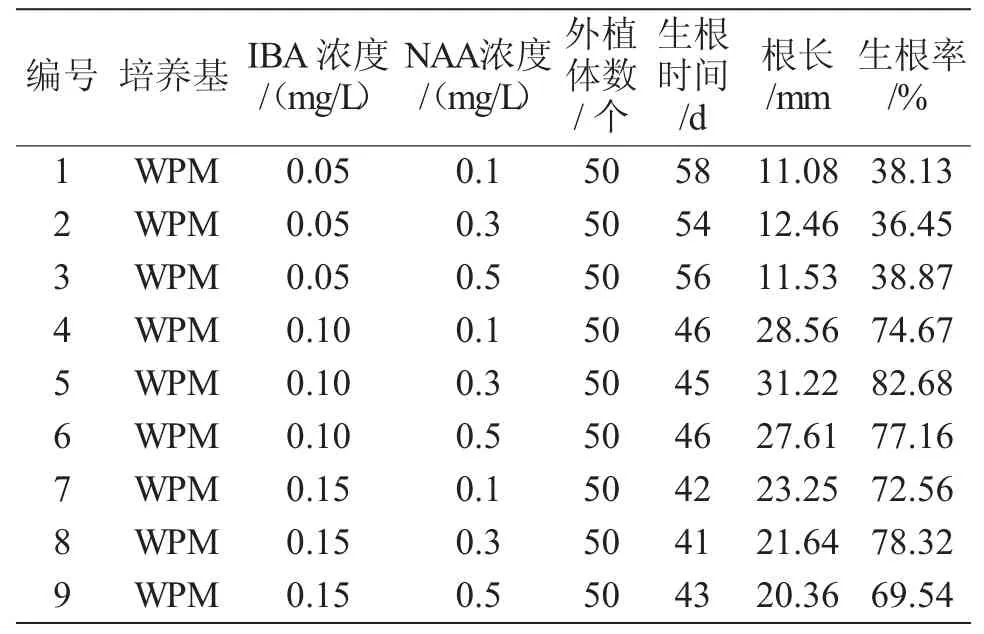
表3 培养基附加不同浓度植物生长调节剂对苦水玫瑰试管芽瓶内生根的影响
2.4 不同栽培方式对移栽成活率的影响
试验用60%腐殖质、30%田园土和10%蛭石做基质,在育苗盘和苗床2种栽培条件下,设置30%遮荫、50%遮荫和70%遮荫3种处理方式。结果发现不同遮荫率对苦水玫瑰组培苗的移栽成活率有显著影响,苗床栽培的成活率优于育苗盘栽培(表4)。在30%遮荫率的情况下,苦水玫瑰组培苗的移栽成活率最低,其中育苗盘栽培为48%,苗床栽培为55%。在遮荫率为50%的环境中,苦水玫瑰组培苗的成活率最高,其中育苗盘栽培为76%,苗床栽培为91%;当遮荫率为70%时,苦水玫瑰组培苗的成活率降低,育苗盘栽培为64%、苗床栽培为78%。不同栽培方式对苦水玫瑰组培苗定植苗幼苗地上部生长的影响较大,其中苗床栽培的幼苗株高的增长指标高于育苗盘栽培12~19 mm。上述结果表明,苗床栽培的永登苦水玫瑰组培苗在50%遮阴率条件下成活率最高,且植株生长量最佳。
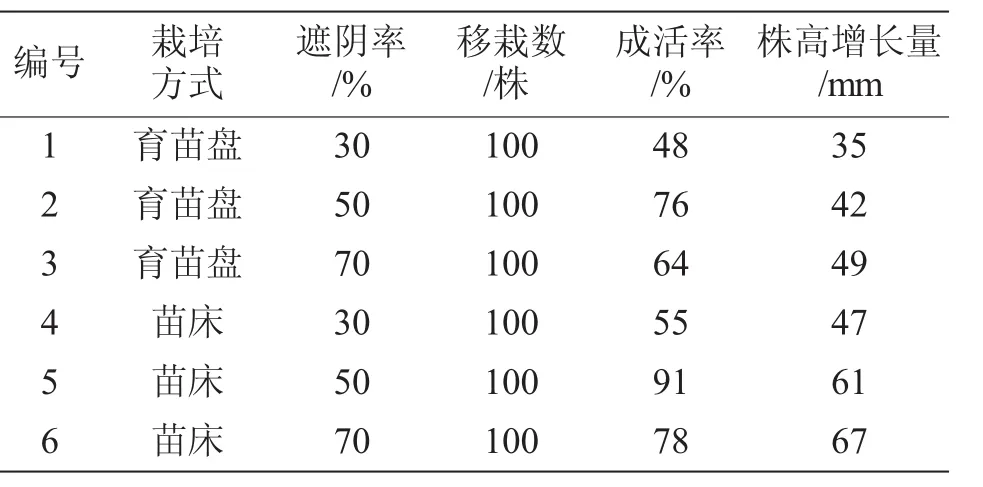
表4 试管苗不同栽培方式对苦水玫瑰移栽成活率的影响
3 小结与讨论
试验表明,WPM+6-BA 1.5 mg/L为苦水玫瑰组培苗诱导增殖培养的最佳培养基,继代3次以上增殖效果良好。WPM+IBA 0.10 mg/L+NAA 0.3 mg/L有利于永登苦水玫瑰组培苗瓶内生根。在复合基质,在50%遮荫、苗床栽培条件下,苦水玫瑰组培苗的移栽成活率达91%。
玫瑰组织培养快繁技术的研究报道较多,但其工厂化育苗生产技术仍然存在许多技术关键亟待解决。玫瑰增殖培养丛生芽的发生源主要为腋芽和不定芽[6-8],目前还没有任何关于食用玫瑰组织培养方面公开发表的文献[9],而有关苦水玫瑰的相关报道更少。主要是因为目前食用玫瑰采用传统的嫁接、扦插繁殖方式[10]。
玫瑰组培苗丛生芽增殖系数低、生根率低、生根周期长、移栽成活率低是制约玫瑰工厂化育苗最主要的因素。试管苗根原基的形成需要外源生长素的诱导,但根原基的伸长和生长则可以在没有外源生长素的情况下实现[11]。关于玫瑰瓶内生根的研究报道较多[12],常用培养基为MS,使用的植物生长调节剂主要是6-BA和NAA。
