基于金纳米颗粒痕量沙丁胺醇的表面增强Raman散射光谱
2018-10-09田艳杰李代林贾翠萍房雪晴
田艳杰, 李代林, 贾翠萍, 房雪晴
(1. 中国石油大学(华东) 理学院 基础物理系, 山东 青岛 266555;2. 中国石油大学(华东) 理学院 光电科学与工程系, 山东 青岛 266555;3. 天津大学 材料科学与工程学院, 天津 300350)
在兴奋剂药品中, 有一种常见的Beta-肾上腺素受体激动剂, 如克伦特罗、 沙丁胺醇和莱克多巴胺等药品, 也称为瘦肉精. 这类药品多用于治疗人类和动物的肺部疾病, 如哮喘等, 但当药物以高剂量作用于人体和动物时, 可极大促进肌肉生长的速度, 并提高蛋白质和脂肪的比例[1]. 直接或间接食用这类药品, 对人体会产生有害的生理副作用, 长期食用更会极大提高染色体变异几率或致癌[2]. 兴奋剂主要通过气相色谱质谱法、 液相色谱质谱法、 免疫法和电化学等技术方法进行检测, 但存在仪器昂贵、 样品处理过程繁琐、 耗时长或可能产生假阳性结果等缺点[3-6]. Raman散射光谱技术具有仪器价格较低, 操作方便, 可实现无损、 原位、 在线、 快速、 定量检测等优点. 表面增强Raman散射(SERS)光谱技术可使吸附在基底上分子的Raman散射信号强度比普通Raman散射信号增强104~107倍, 适用于痕量、 超痕量和单分子检测[7-10].
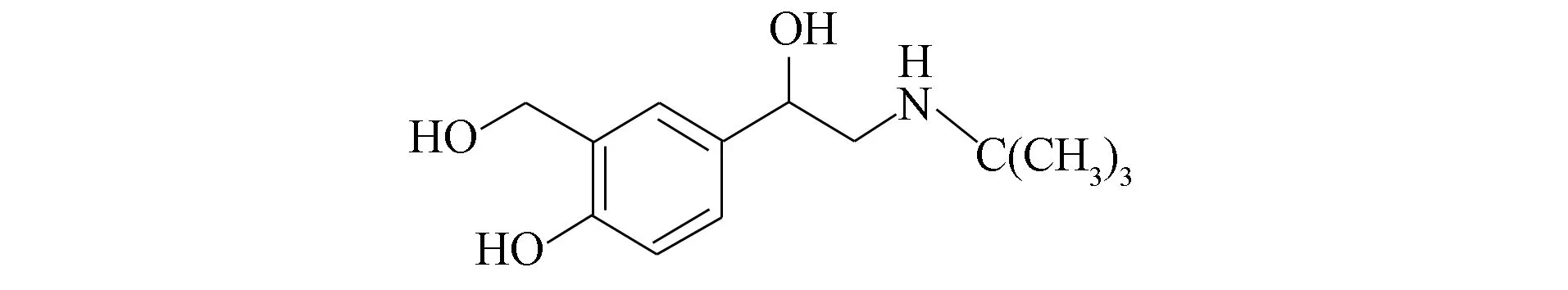
图1 沙丁胺醇的化学结构Fig.1 Chemical structure of salbutamol
本文通过优化Turkevich方法[11]制备增强效果较好的金纳米颗粒, 应用SERS技术检测浓度为10-3~10-5mol/L的痕量沙丁胺醇分子, 其化学结构如图1所示, 并分析其Raman光谱强度, 对其随浓度变化进行线性拟合, 验证SERS技术是否可用于痕量沙丁胺醇分子的定量检测.
1 金纳米颗粒的制备和表征
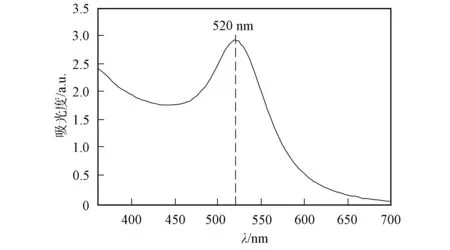
图2 金纳米溶胶的紫外-可见吸收光谱Fig.2 UV-Vis absorption spectrum of gold nanossols
实验所用化学药品均购于美国Sigma-Aldrich公司, 未经进一步处理, 溶剂为去离子水. 根据Turkevich方法制备金纳米颗粒, 取浓度为0.5 mol/L的四氯金酸50 μL溶于100 mL去离子水中, 配制浓度为250 μmol/L的浅黄色四氯金酸水溶液, 搅拌加热至沸腾, 加入0.8 mL体积浓度为1%的柠檬酸三钠水溶液, 溶液颜色立即变黑, 继续加热搅拌, 溶液颜色由黑变紫, 再变成深红色, 持续沸腾30 min后停止加热搅拌, 自然冷却备用. 金纳米溶胶的紫外-可见吸收光谱用德国BMG LABTECH公司生产的多功能荧光发光分析仪(FLUOstar Omega plate reader)测得, 结果如图2所示. 由图2可见, 其最大吸收峰位于520 nm附近. 金纳米粒子的形貌用美国FEI公司生产的透射电子显微镜(TEM, 型号为FEI Tecnai G2Twin, 点分辨率为0.3 nm)测得, 结果如图3所示. 由图3可见, 金纳米颗粒的直径为50~60 nm, 形状规则, 大小均匀.

图3 金纳米颗粒的TEM照片Fig.3 TEM images of gold nanoparticle
2 实验结果与讨论
用Renishaw Invia型共聚焦Raman光谱仪测量Raman光谱, 选用10倍镜头, 采用氦氖激光器作为激发光源, 激发波长为632.8 nm, 功率为6 mW, 光谱分辨率为1 cm-1, 积分时间为20 s, 累积3次. 实验中沙丁胺醇作为溶质, 由于其Raman散射特征峰位于300~1 600 cm-1处, 溶剂水的O—H弯曲振动模特征峰位于1 640 cm-1处, 因此选择300~1 800 cm-1作为光谱检测范围. 量取适量沙丁胺醇, 以去离子水为溶剂, 采用逐级稀释法, 配制浓度为10-3~10-6mol/L的水溶液样品. 金纳米溶胶和沙丁胺醇水溶液样品各取1 mL注入小瓶, 封闭混合并摇匀, 取0.2 mL置于待测样品池进行表面增强Raman光谱检测.
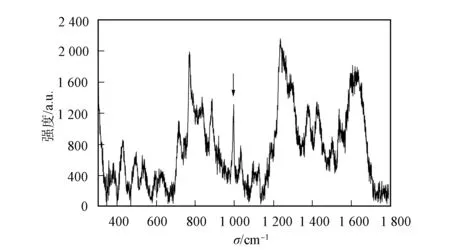
图4 浓度为5×10-5 mol/L的沙丁胺醇 表面增强Raman散射光谱Fig.4 SERS spectrum of salbutamol with concentration of 5×10-5 mol/L
采用表面增强Raman散射光谱方法检测沙丁胺醇的最低检出限为5×10-5mol/L, 其表面增强Raman散射光谱如图4所示, 以996 cm-1处的Raman峰为参考信号, 信噪比(S/N)大于3.
应用该方法测得痕量沙丁胺醇的浓度为10-3~10-5mol/L, 不同浓度下沙丁胺醇的表面增强Raman散射光谱如图5所示, 其中曲线a,b,c,d分别表示浓度为100,250,500,750 μmol/L. 由图5(A)可见, 沙丁胺醇在779 cm-1处的特征Raman峰对应芳族离散平面的C—H弯曲振动, 在996 cm-1处为C—H的振动峰, 在1 236 cm-1处为酚基上C—O的伸缩振动峰, 在1 350~1 450 cm-1处的两个连续峰分别对应脂族上CH的弯曲振动和芳族上CH3的弯曲振动, 与文献[8,12-13]结果相符. 在600 cm-1处以下, 其他较强Raman峰对应分子骨架的振动, 水的O—H弯曲振动模的Raman特征峰位于1 640 cm-1处. 由图5(B)可见, 996 cm-1处Raman带的峰强随浓度的增加而增大. 与其他Raman带相比, 996 cm-1处Raman带的峰型规则, 对称性良好, 因此选其为目标Raman带.
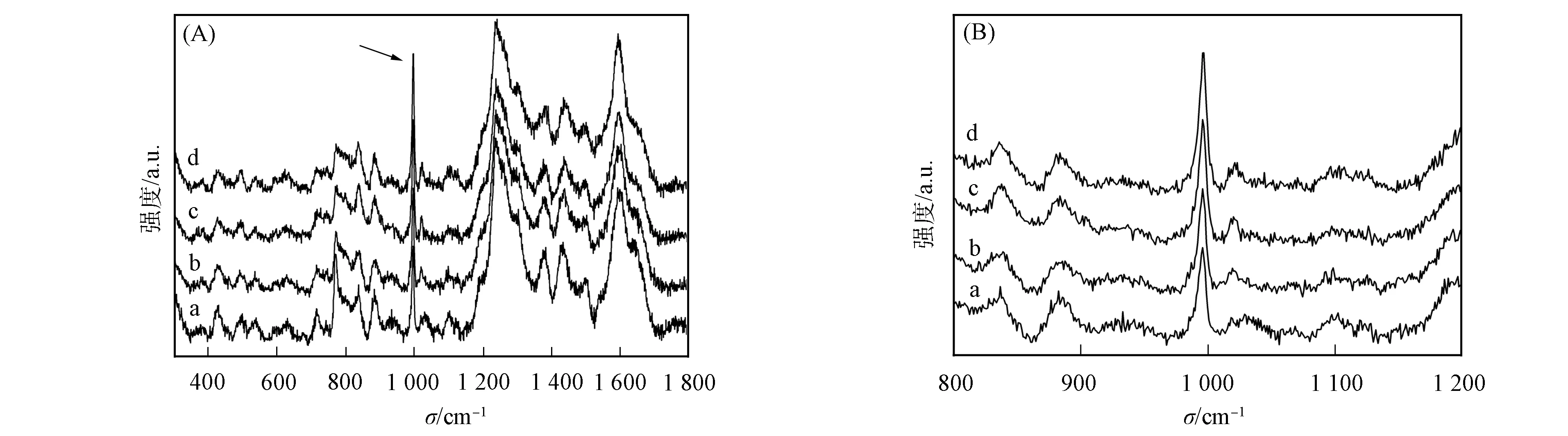
图5 不同浓度下痕量沙丁胺醇的表面增强Raman散射光谱Fig.5 SERS spectra of trace amounts of salbutamol at different concentrations
沙丁胺醇996 cm-1处Raman带表面增强Raman散射强度随浓度的变化关系如图6所示. 由图6可见: 当浓度为100~750 μmol/L时, 特征Raman峰强度随浓度线性变化, 相关系数R2=0.996 57; 当浓度小于100 μmol/L及大于1 000 μmol/L时, 二者不满足线性关系.
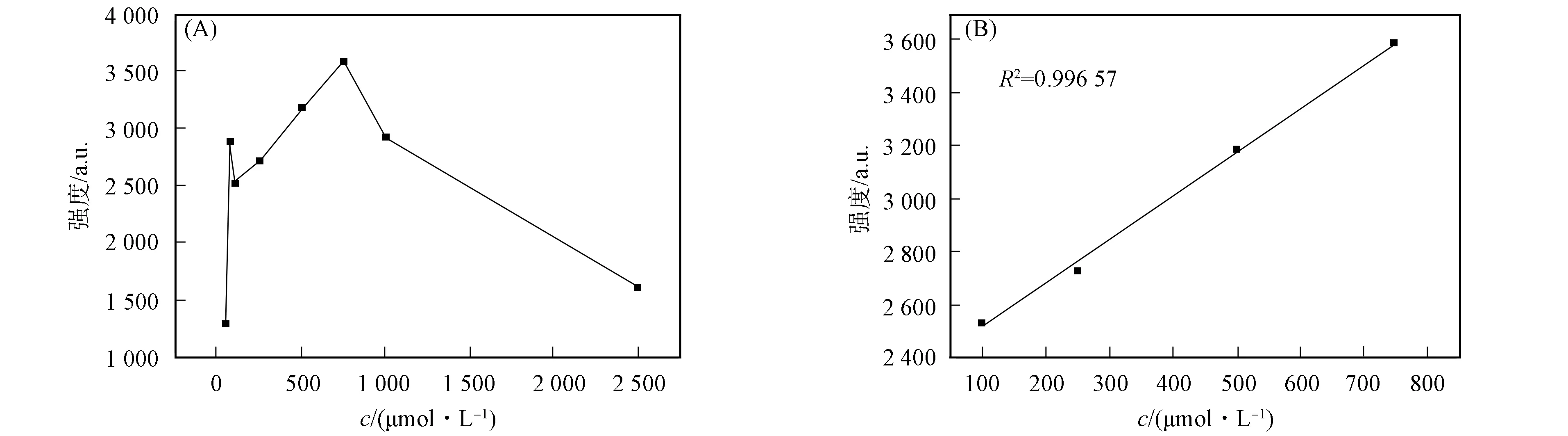
图6 沙丁胺醇996 cm-1处Raman带表面增强Raman散射强度随浓度的变化关系Fig.6 Relationship between SERS intensity and concentration of salbutamol at 996 cm-1
综上所述, 可得如下结论: 本文用优化的Turkevich方法制备了直径为50~60 nm的金纳米颗粒, 并对该金纳米颗粒进行水中痕量沙丁胺醇分子的表面增强Raman散射光谱检测. 结果表明, 其最低检出限为5×10-5mol/L, 在100~750 μmol/L内, Raman光谱强度与浓度具有较好的线性关系, 但在更宽泛的范围内不满足线性关系. 因此, 表面增强Raman散射光谱方法仅能在较小的浓度范围用于定量检测.
