二氢杨梅素-镍配合物的合成及其细胞毒性初探
2018-10-08郭清泉舒绪刚张亚楠
张 慧 郭清泉* 舒绪刚 谢 宇 谭 威 刘 迪 张亚楠
(1.广东工业大学轻工化工学院,广州510006;2.广州天科生物科技有限公司,广州510627; 3.仲恺农业工程学院,广州510225)
随着人类社会的进步,养殖业规模化和集约化迅速发展,为追求高产,防止畜禽疾病发生,提高饲料报酬,饲料添加剂应运而生。它的使用可提高动物的生产性能,增强机体抵抗力,进而提高养殖者的经济效益[1-2]。但饲料添加剂的安全毒理学评价环节尤为重要,它直接关系到人类的健康。二氢杨梅(dihydromyricetin,DMY)是黄酮醇类化合物[3-4],它的化学名称是3,5,7,3′,4′,5′-六羟基2,3双氢黄酮,其结构如图1。它具有较高的超离域度,整个分子形成一个大π键共轭体系,具有强烈的配合作用。因具有抗菌、抗肿瘤、护肝、抗氧化等多方面的生理活性,近年来DMY已作为新型饲料添加剂得到广泛的应用。镍(Ni)是机体所必需的微量元素,主要作用是激活机体的各种酶,它具有独特的协调和催化电子转移特性,缺乏镍可出现生长缓慢、生殖力减弱,但镍的过量可导致心肌、脑、肺脏、肝脏和肾脏退行性变。研究发现DMY金属配合物的生物活性明显强于单一有效成分,并且可以同时补充畜禽生长必需的微量元素[5-7],故二氢杨梅素-镍配合物(DMY-Ni)的研究成为热点,但目前有关DMY-Ni的研究大都停留在其工艺制备、抗氧化性、抑菌性等生物活性方面[8-9],缺少有力的稳定性及安全性方面的数据。20世纪80年代末,Nguyen等[10]首次建立细胞毒性检测的方法,它是在一种离体状态下模拟生物体生长环境,检测药物抑制细胞生长和其他毒性作用的方法,其中噻唑蓝(MTT)法最为常用,此方法简单直观,可分析不同组分及浓度对细胞的毒性。本试验拟以DMY和乙酸镍为原料合成DMY-Ni,并以小鼠肝实质细胞为研究对象,研究DMY及DMY-Ni对体外细胞增殖的影响,旨在为安全合理将DMY-Ni用做饲料添加剂提供指导。

图1 二氢杨梅素分子结构式Fig.1 Molecular structure of DMY
1 材料与方法
1.1 材料与试剂
DMY:西安四季生物科技有限公司,纯度98%;无水乙醇、乙酸镍、无水醋酸钠:国药集团化学试剂有限公司,均为分析纯;蒸馏水:广州屈臣氏蒸馏水公司;小鼠肝实质细胞AML12:上海中乔新舟生物科技有限公司;DMEM(高糖)培养液、胎牛血清:美国Gibco公司;双抗(青霉素-链霉素):美国Fisher Scientific公司;胰蛋白酶:美国BioBasieUnit公司;MTT:美国Sigma公司;二甲基亚砜:上海生工生物工程有限公司。
1.2 仪器
DZF-6050真空干燥箱:上海一恒科学仪器有限公司;UV-2450型紫外可见分光光度计:日本岛津公司;NICOLET-380型傅里叶变换红外光谱仪:德国Bruker公司;CO-150型INNOVA CO2培养箱:美国NBS公司;SpectraMax Paradigm酶标仪:澳大利亚Molecular Devices公司;高速离心机:上海安亭科学仪器厂。
1.3 DMY-Ni的合成
准确称取0.640 g(2 mmol)的DMY装于250 mL带有磁力搅拌子的三口圆底烧瓶中,加100 mL的无水乙醇,待加热、搅拌完全溶解后,向该溶液中加入一定量的无水醋酸钠调节pH约为7.5,继续搅拌0.5 h后,加入相同物质的量的乙酸镍0.498g(2mmol),在70℃的水浴下搅拌冷凝回流6 h,反应结束后放置冷却至室温,减压抽滤,用蒸馏水和无水乙醇交替反复洗涤沉淀3次,然后于40 ℃下真空干燥10 h,得黄褐色固体粉末。
1.4 DMY-Ni的表征
紫外光谱表征:将DMY和所得配合物先分别用少量二甲基亚砜溶解,然后再用大量水稀释至试验所需浓度,以水为参比样,在200~600 nm内扫描紫外-可见吸收光谱。
红外光谱表征:采用溴化钾(KBr)压片法分别对DMY和所得配合物进行红外光谱扫描。
1.5 细胞毒性
取对数生长期的小鼠肝实质细胞AML12,用DMEM(高糖)培养液调整至5×104个/mL,并以100 μL/孔接种到96孔板中,边缘加磷酸盐缓冲液(PBS),置于37 ℃、5% CO2培养箱中培养。待细胞贴壁后,弃去上清,用完全培养基将DMY与DMY-Ni分别按试验设定的浓度梯度配制好,每孔加入含DMY或DMY-Ni的培养液100 μL,并分别孵育12、24、36和48 h。试验设定的DMY或DMY-Ni终浓度分别为10、20、40、80和160 μg/mL,每个浓度设置6个复孔,同时设置空白对照组与调零组。待作用相应时间后,弃去上清,每孔加入100 μL 0.5 mg/mL的MTT溶液,继续培养4 h后弃去上清,每孔加入二甲基亚砜150 μL,放置10 min,用酶标仪测490 nm处的吸光度(OD)值,重复3次,按下列公式计算细胞增殖率:
细胞增殖率(%)=(试验组平均OD值/ 空白对照组平均OD值)×100。
1.6 数据统计分析
试验数据采用GraphPad Prism 7.0软件中的单因素方差分析(one-way ANOVA)程序进行统计分析,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 DMY-Ni的表征
2.1.1 紫外光谱扫描
由图2可以看到,DMY在292 nm处有强吸收峰,与镍离子配合后,吸收峰的位置移到了305 nm处,与DMY相比发生了明显的红移,说明DMY的结构发生了改变,有新的产物生成。
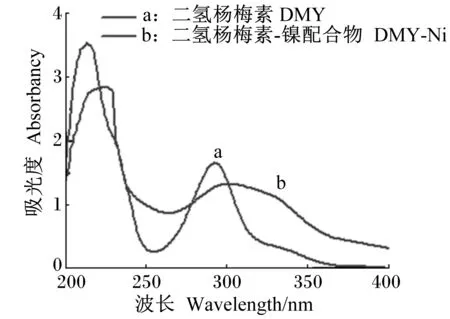
图2 DMY和DMY-Ni的紫外-可见吸收光谱图Fig.2 UV-vis absorption spectra of DMY and DMY-Ni
2.1.2 红外光谱扫描
由图3可知,3 407.78 cm-1是苯环上的羟基伸缩振动,说明生成的配合物仍存在羟基;DMY在1 642.37 cm-1处有强吸收峰,这是4位羰基产生的,在生成配合物时,由于4位羰基与5位羟基偶合作用,导致4位羰基碳氧双键变弱,吸收峰位置移至1 598.43 cm-1处,向低波数移动了43.94 cm-1,说明羰基参与了反应。在1 400~1 500 cm-1处苯环骨架的吸收峰位置变化不大,说明DMY和生成的配合物均存在苯环结构;在1 050~1 150 cm-1处醚键吸收峰位置基本不变,说明在生成配合物时C环醚键未发生开环;但在低频指纹区中,生成的配合物与DMY相比,在651.87 cm-1处出现了新的吸收峰,表明DMY与镍离子发生了作用,形成了以Ni-O键结合的配合物DMY-Ni。

图3 DMY和DMY-Ni的红外光谱图Fig.3 IR-spectra of DMY and DMY-Ni
2.2 DMY与DMY-Ni对AML12细胞增殖的影响
由图4-A可以看到,在分别经过12、24 h的作用后,随着DMY浓度的增加,AML12细胞的存活率基本不变;在分别经过36、48 h的作用后,AML12细胞的存活率随着DMY浓度的增大而减小,抑制作用并不明显。在同一浓度下,随着DMY作用时间的增加,AML12细胞的存活率也有所下降。由图4-B可以看到,在分别经过12、24 h的作用后,随着DMY-Ni浓度的增加,AML12细胞的存活率基本保持不变,这和DMY作用于AML12细胞的情况一致。而当DMY-Ni分别作用于AML12细胞36、48 h时,在低浓度时,AML12细胞的存活率基本不变,在高浓度时,AML12细胞的存活率随DMY-Ni浓度的增加而下降,且下降幅度较相同情况下的DMY明显。在同一浓度不同的作用时间下,AML12细胞的存活率也是呈现时间依赖性。
图5为DMY和DMY-Ni在作用48 h后对AML12细胞增殖的影响,可以看出当DMY浓度在160 μg/mL时,其对AML12细胞增殖表现出明显的抑制作用,该组AML12细胞的存活率与空白对照组相比显著降低(P<0.01);DMY浓度低于160 μg/mL时,AML12细胞的存活率基本不变,与空白对照组的差异不显著(P>0.05)。DMY-Ni浓度为80~160 μg/mL时,其对AML12细胞表现出了一定的毒性作用,这2组AML12细胞的存活率与空白对照组相比差异显著(P<0.01或P<0.001);DMY-Ni低于80 μg/mL时,AML12细胞的存活率基本不变,与空白对照组的差异不显著(P>0.05)。通过GraphPad Prism 7.0软件计算半数抑制浓度(IC50),得出DMY对AML12细胞的IC50为285.10 μg/mL,DMY-Ni对AML12细胞的IC50为222.84 μg/mL,稍低于DMY的IC50,说明配合物DMY-Ni对AML12细胞的毒性较DMY有所增大。
3 讨 论
DMY与镍离子配合后,其紫外-可见吸收光谱发生了明显的红移现象,红外吸收光谱在指纹区有新的特征吸收峰出现,是Ni—O键,从而证明了DMY-Ni配合物的生成。
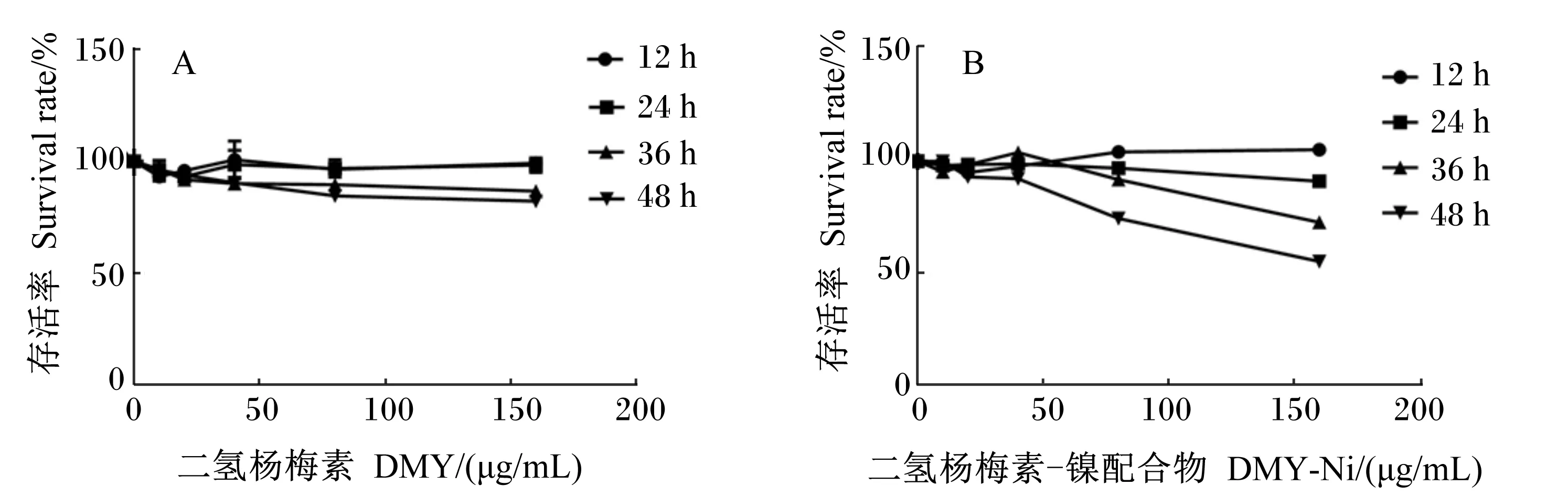
图4 DMY和DMY-Ni对AML12细胞增殖的影响Fig.4 Effects of DMY and DMY-Ni on proliferation of AML12 cells

与空白对照组相比,差异性显著表示为:*,P<0.05;**,P<0.01;***,P<0.001。
Compared with the blank control group, the differences are significantly expressed as: *,P<0.05; **,P<0.01; ***,P<0.001.
图5DMY和DMY-Ni作用48h后对AML12细胞增殖影响
Fig.5 Effects of DMY and DMY-Ni on proliferation of AML12 cells after treatment for 48 h
剂量是毒理学研究中最重要的概念。DMY-Ni作为饲料添加剂使用,研究其量效关系非常重要。有研究显示化学物质体外细胞毒性与其引起的动物死亡率及人体死亡的血药浓度之间都存在良好的相关性。化学物质产生的损伤和死亡,最终可表现为细胞水平上的改变,由此研究体外细胞毒性可以预测体内急性毒性。
周防震等[11]从细胞水平证明了DMY的低毒性,作用48 h时,DMY对L-02细胞的IC50为324.8 μg/mL;舒洋[12]通过MTT法检测了DMY对2种正常人永生化肝细胞增殖的影响,结果显示DMY对正常人肝细胞没有明显的抑制作用;苏东林等[13]以受试样品最大使用浓度、受试动物最大灌胃容量为试验用量,即Wistar大鼠口服灌胃DMY 5.0 g/kg BW,结果没有动物死亡,解剖也未发现有组织器官出现体积、颜色、质地的改变,从而证明了DMY的低毒性。但对于DMY的使用,目前并没有明确规定其安全剂量。
DMY与镍离子结合后其抗氧化、抑菌性等生物活性方面均有加强,对于其安全性方面,本试验采用MTT法,研究得出DMY对AML12细胞的IC50为285.10 μg/mL。由于同一种药物,作用于不同的细胞株,其耐受性也会有差异[14-15]。故本试验结果仍可看作与上述文献报道相一致,即DMY具有低毒性。本试验中得出DMY-Ni对AML12细胞的IC50为222.84 μg/mL,虽然DMY-Ni的IC50较DMY减小,但相差并不大,从这些结果对比来看,DMY和DMY-Ni对正常细胞确实具有低毒性。
由于DMY-Ni的IC50比DMY减小了,证明其毒性有所增加。有研究表明,DMY金属配合物与其配体DMY相比,金属离子与配体DMY产生了协同作用,其抗肿瘤活性提高[16],这也可能是DMY-Ni对正常小鼠肝实质细胞AML12毒性相较于其配体DMY增加的原因。
4 结 论
① 以DMY和乙酸镍为原料,本试验成功合成了配合物DMY-Ni。
② DMY与DMY-Ni对AML12细胞的抑制作用与药物浓度呈现一定的剂量依赖性,且随作用时间的延长,毒性逐渐增大。
③ DMY对AML12细胞具有低毒性,DMY-Ni对AML12细胞的毒性较DMY有所增加,但也是低毒性。
