剪切波弹性成像对2型糖尿病患者胫神经病变的初步研究
2018-10-08陈雅丽徐振宏陈娇虹
陈雅丽,徐振宏,陈娇虹
目前,对糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)的诊断主要依靠临床症状、体征及结合神经电生理检查综合判断,然而,神经电生理检查耗时较长、可重复性差,不适合作为DPN的常规筛查方法。作为一种新的超声测量方法,剪切波弹性成像(shear wave elastography,SWE)可提供神经硬度改变的信息。本研究应用SWE对2型糖尿病(diabetes mellitus,DM)及合并DPN患者的胫神经进行超声检查,探讨其对DPN的诊断价值。
1 资料与方法
1.1 一般资料
选取2017年1月至2017年5月于我院门诊就诊的2型DM患者60例,均符合2015年美国糖尿病协会有关DM的最新诊断标准[1]:糖化血红蛋白(hemoglobin A1c,HbA1c)≥6.5%,或空腹血糖(fasting plasma glucose,FPG)≥7.0 mmol/L,或口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)2 h 血糖≥11.1 mmol/L。根据是否存在DPN将患者分为两组:①DPN组30例,男18例,女12例;年龄36~78岁,平均(60.7±10.9)岁;DM病程10~20年;身高(165.0±7.0)cm,体质量(68.75±13.67)kg;②非DPN组30例,男16例,女14例;年龄27~75岁,平均(55.9±9.2)岁;DM病程3~15年;身高(167.0±6.8)cm,体质量(66.34±11.37)kg。另选取同期健康者30例为对照组,男13例,女17例;年龄28~78岁,平均(52.7±12.7)岁;均无DM和DPN病史及症状;身高(168.0±6.5)cm,体质量(65.52±12.35)kg。3组一般资料差异无统计学意义(P>0.05)。
1.2 方法
所有受检者均采取仰卧位,踝关节轻微跖屈并外旋。采用法国Supersonic Imagine Aixplorer型彩色超声诊断仪,L4-15线阵探头,频率4~15 MHz,具有SWE成像功能。首先进行常规二维超声检查,探头轻触皮肤,并涂上足量的耦合剂。于内踝水平上4 cm处附近通过胫骨后肌腱(tendon of tibialis posterior muscle,TPM)定位追踪检查胫神经[2],显示其横断面,并以描记法测量横截面积(cross-sectional area,CSA),再将探头旋转90º获取胫神经长轴切面,在保持探头稳定的状态下切换至SWE模式,待SWE取样框图像稳定后冻结图像,SWE图像为彩色编码,根据弹性模量值由小到大颜色蓝-绿-黄-红表示,启动Q-BOX功能测量感兴趣区(region of interests,ROI)内神经组织的杨氏模量最大值。彩色图弹性模量范围为0~180 kPa,测量区域统一设置为直径2 mm的圆形ROI。在SWE取样框里放5个ROI,分别测量并记录胫神经的弹性模量最大值,并取其平均值,采用双盲法进行测量,参数均测量3次取平均值。图像中红色代表病变质地较硬,蓝色代表病变质地较软,SWE数值越大则提示组织越硬。
1.3 统计学处理
采用SPSS 17.0统计软件处理数据,计量资料以(均数±标准差)表示。同一受检者双侧参数比较采用配对t检验,3组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组间胫神经CSA比较
与对照组比较,DPN组的胫神经CSA明显增粗,有显著性差异(P<0.001);非DPN组的胫神经CSA与对照组比较差异无统计学意义(P>0.05)(表1)。
2.2 3组间胫神经弹性测量参数比较
DPN组的胫神经硬度(图1A)明显高于非DPN组(图1B)及对照组(P<0.001),非DPN组的胫神经硬度明显高于对照组(P<0.001)(表1)。3组双侧胫神经的参数比较,均无统计学意义(均P>0.05)(表1)。
3 讨论
表1 3组间胫神经CSA与弹性参数比较(±s)
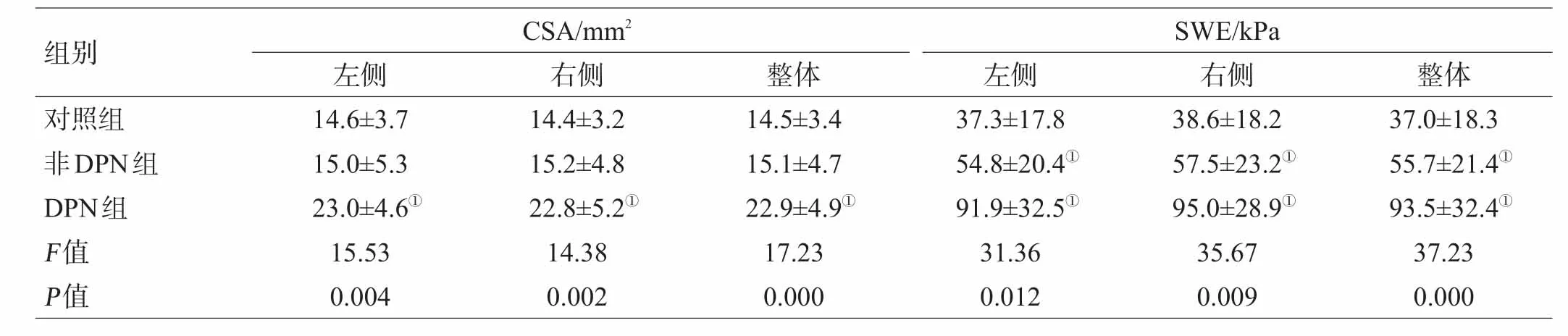
表1 3组间胫神经CSA与弹性参数比较(±s)
注:与对照组比较,①P<0.001
组别对照组非DPN组DPN组F值P值CSA/mm2 SWE/kPa左侧14.6±3.7 15.0±5.3 23.0±4.6①15.53 0.004右侧14.4±3.2 15.2±4.8 22.8±5.2①14.38 0.002整体14.5±3.4 15.1±4.7 22.9±4.9①17.23 0.000左侧37.3±17.8 54.8±20.4①91.9±32.5①31.36 0.012右侧38.6±18.2 57.5±23.2①95.0±28.9①35.67 0.009整体37.0±18.3 55.7±21.4①93.5±32.4①37.23 0.000
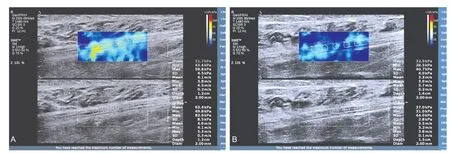
图1
DPN是2型DM患者最常见的慢性并发症之一,其起病隐匿,病理严重程度往往与临床症状不成正比,许多患者可以长期处于无症状期。当DPN出现临床症状时,周围神经纤维多已出现不可逆的节段性脱髓鞘等病理改变[3]。同时DPN又是糖尿病足发生的最常见诱因和发病基础。因此,早期筛查和诊断DPN对治疗DM及其并发症具有重要意义。目前,对DPN的诊断主要依靠临床症状、体征及结合神经电生理检查综合判断,其中神经电生理检查被认为是“金标准”,但其耗时较长,可重复性差,不适合作为DPN的常规筛查方法。
近年来,随着高频超声的发展,周围神经成像越来越清晰直观,为临床提供了更多的形态学信息[4]。有部分学说认为DPN的病理机制是葡萄糖过多代谢转化为山梨醇,神经细胞内渗透压增高,细胞肿胀、变性,导致神经纤维体积增大,神经横截面积增大[5]。有研究证实高频超声下测得的外周神经CSA可为DM患者周围神经病变程度的评估提供较可靠的形态学依据[6]。本研究通过测量胫神经的CSA,结果表明DPN组胫神经的CSA较非DPN组大,非DPN组与对照组的胫神经CSA差异无统计学意义。这和Dikici研究结果一致,但该研究也指出CSA并非最优指标,其敏感性及特异性均较低,无法准确诊断早期DPN,其临床应用受到限制[3]。
SWE是这几年发展起来的新技术,其通过组织内部的剪切波进行检测,不需要人为向组织施压,能提供定量的弹性信息,具有较高的准确性及重复性。目前SWE已成熟应用于肝脏、甲状腺及乳腺等脏器,但在周围神经系统疾病中的应用较少见。仅有应用剪切波弹性成像检测腕管综合征患者正中神经硬度变硬的相关报道[7]。SWE测得的弹性指标包括平均值、最小值、最大值、标准差等,其中最大值(Emax)的诊断效能被认为优于其他指标[8]。因此本研究选用Emax参数来评价胫神经的硬度。然而DPN胫神经硬度的病理变化过程应该不均匀,所以本研究将研究区域内放置5个ROI并取其最大值的平均值,尽可能消除因ROI放置位置不同而造成的误差。本研究的结果显示DPN组的胫神经杨氏模量值明显高于非DPN组及对照组。笔者认为这有两方面原因,一是由于DPN患者神经细胞发生水肿或者纤维化以及结缔组织的增厚;二是DPN患者踝管处的胫神经内部压力增加,缺血加重,导致脱髓鞘病变恶化。
目前DPN的诊断主要依靠临床症状、体征及结合神经电生理检查综合判断,然而常出现临床症状与神经电生理检查结果不一致的情况[3]。在DPN的早期阶段往往以细纤维神经损伤为主[9],此时神经电生理检查的诊断敏感性差,导致部分有临床末梢神经病变症状的患者漏诊。而本研究显示非DPN组的胫神经硬度明显高于正常人,笔者认为非DPN组因长期糖代谢障碍以及微血管病变,早期就已发生周围神经缓慢变性,同时神经组织也出现不同程度的代偿作用,虽然此时临床症状及体征不明显,神经电生理的“功能学”检查也是阴性,但实际上神经“形态学”已发生改变。所以SWE有助于发现糖尿病周围神经亚临床病变。
本研究存在一定局限性:由于病例数有限,未能提供弹性模量Emax参数评价胫神经硬度的最佳截断值,这也是笔者接下来的研究方向。SWE作为一种定量测量方法,能更客观地提供胫神经硬度改变的信息,能为临床早期诊断DPN提供参考,具有较大临床实用性。
