虾青素联合人羊膜间充质干细胞移植治疗去卵巢大鼠骨质疏松
2018-10-08刘春颖刘晓峰臧卫东曹广民杨照宇郑文奎
雷 鸣 刘春颖 刘晓峰 孙 琳 臧卫东 曹广民 杨照宇 郑文奎
(河北大学附属医院骨科,河北 保定 071000)
骨质疏松发病率较高〔1,2〕,其主要特点为骨组织微观结构不完整,骨密度降低〔3〕,骨组织生成和代谢的平衡被打破〔4〕,临床上多表现为身体骨骼部位疼痛、长骨易骨折、身高变低〔5〕等。其机制可能与雌激素调节相关〔6,7〕。对实验雌性动物摘除卵巢,成功模拟了由绝经后低雌激素水平引起的骨质疏松〔8〕。人羊膜间充质干细胞(hAMSCs)来源广泛,对产妇及新生儿几乎没有影响,且其分化、增殖能力具有独特的优势〔9,10〕,未出现传代后衰老的现象,并有特有的胎盘屏障,羟酮结构的虾青素,是从深海藻体、海洋动物中提取的胡萝卜素〔11〕,也存在于少数的陆生植物体内。虾青素具有很高的医学价值,研究者已发现其在心血管、抗氧化、抗癌及增强免疫力方面效果显著〔12〕。本研究探讨虾青素联合hAMSCs对雌激素下降引起的骨质疏松的影响。
1 材料与方法
1.1实验动物 雌性未孕Wistar大鼠60只,鼠龄6~8个月,体重200~280 g,由河北医科大学动物实验室提供。所有大鼠饲养条件为:23~27℃,恒温,湿度50%~70%,喂养饲料:颗粒型普通大鼠饲料及消毒无菌水,让其自由饮水和进食,实验前1 d禁食不禁水。
1.2主要材料及来源 hAMSCs购自河北生命科学研究院,由本实验室冷冻保存。L-DMEM培养基、胎牛血清和混合抗生素(青霉素、链霉素)购自Gibcos公司,胰蛋白酶购于Sigma公司,Ⅰ型前胶原氨基末端肽(PINP )、骨碱性磷酸酶(BAP)和尿脱氧吡啶啉(DPD)酶联免疫吸附试验(ELISA)试剂盒购于上海船夫生物科技有限公司,RT-PCR试剂盒购于TaKaRa公司,骨形成蛋白(BMP)4、护骨素(OPG)抗体购于Proteintech公司,GAPDH抗体购于Bioworld公司,二抗(辣根过氧化物酶标记的羊抗鼠抗体)购自优维宁生物技术公司,RIPA 裂解液购于碧云天公司。紫外分光光度计购于上海奥析原,二氧化碳培养箱购于上海人和科技有限公司,细胞培养皿、细胞培养瓶购于上海百研生物科技有限公司。
1.3方法
1.3.1体外培养hAMSCs 小心取出已冻存的hAMSCs(防止冷冻管爆裂),放入37℃水浴,不间歇、轻轻摇动冷冻管,迫使其充分融化时间1 min,融解后,放置于无菌操作台中,吸取解冻完成的细胞悬浮液,加至预先配置好的1∶10倍稀释的L-DMEM培养基。并将细胞接种于培养瓶中,静置于37℃、5%CO2的饱和湿度培养箱中培养。每2天更换新鲜培养液,除去未贴壁细胞,至细胞融合85%时,去除培养基,吸取贴壁细胞,加至培养皿中,3 g/L胰酶消化5 min,用已配置的等体积的10%胎牛血清低糖培养基终止消化,细胞吹打到成悬液,1 500 r/min,离心5 min,弃去上清非贴壁细胞,在新配置的无菌培养基中调节浓度,依照上述方法进行培养。2~3 d更换新鲜培养基,第5代(P5)供于该研究,并进行油红O染色。
1.3.2大鼠双侧卵巢切除术及实验分组 无菌条件下,将需切除双侧卵巢的大鼠取俯卧位,捆绑固定大鼠四肢,将大鼠置于手术台上,消毒,切开皮肤,分离脊柱旁1 cm、肋弓下缘1 cm的肌肉和组织,腹膜切开,见腹腔中乳白色组织,剥离后,切除双侧黄豆大小粉红色卵巢。空白组大鼠依上述方法去腹腔卵巢大小脂肪。手术组和空白组大鼠撒青霉素粉,皮肤缝合,外切口涂抹庆大霉素消毒。
将60只Wistar大鼠平均分为四组,分别是假手术组、模型组、hAMSCs移植组及联合组(虾青素+hAMSCs移植)。对假手术组大鼠不切除卵巢,对模型组、hAMSCs移植组及联合组大鼠行双侧卵巢切除术。术后1 w,hAMSCs移植组大鼠尾静脉注射浓度为2×106L-1的hAMSCs细胞悬液20 μl,联合组尾静脉注射等量hAMSCs细胞悬液并同时灌胃20 mg/kg的虾青素,假手术组、模型组大鼠尾静脉注射0.9%氯化钠注射液20 μl,连续干预12 w。
1.3.3检测体重 分别于造模后的1 w、3 w、6 w、12 w对假手术组、模型组、hAMSCs移植组及联合组大鼠进行体质量检测。即将每组大鼠排便后且喂食前,放置天平上,进行称量,记录大鼠体重。
1.3.4ELISA测定 PINP、BAP、DPD的含量 ELSIA固相抗体为待测样品抗体,固相抗体与待测样品发生特异性反应,反应产物与酶标抗体结合形成复合物,加入底物,显色后进行检测。造模12 w后,随机从假手术组、模型组、hAMSCs移植组及联合组选3只大鼠,腹腔注射10%水合氯醛麻醉,断头取血,将血浆离心20 min,速度1 000 r/min。移液枪吸取上清液,加入酶标包被板上,1∶10比例稀释后,加至酶标板孔底部,不间歇轻摇,混匀。用封板膜覆盖后,37℃,恒温箱,放置30 min。此时,稀释洗涤液30倍。摘除封板膜,自然烘干,每孔各滴入洗涤液,静止1 min后,甩干,多次重复洗涤。每孔加酶标试剂50 μl,排除空白孔,37℃,恒温箱,放置30 min,多次洗涤,每孔分别加入显色剂A和B 50 μl,混匀,37℃,暗室,放置15 min后,加入终止液50 μl。快速,在分光光度计下测定450 nm波长下的OD值。
1.3.5RT-PCR检测BMP-4及OPG基因表达水平 总RNA从移植12 w后的骨细胞中提取,对假手术组、模型组、hAMSCs移植组及联合组已处死的3只大鼠骨组织中,剥离股骨肌肉组织,取少量股骨粉碎后,加入含1 mg/ml亚铁离子的PBS多次反复冲洗,用匀浆器打匀,并过100 mm滤膜,备用。按Gibco公司Trizol Total Isolation Reagent 说明书进行提取总RNA并以总RNA mRNA为模板,参照说明书的逆转录酶法反转录合成cDNA,在扩增仪上进行RT-PCR。吸取2 μl的悬浮细胞液,正反向引物各加入1 μl悬浮细胞液。BMP-4的上游引物为:5′-TGAGCCTTTCCAGCAAGTTT-3′,下游引物为:5′-AGATCCCGCATGTAATCAGG-3′,扩增目的基因片段长度为341 bp。OPG的上游序列为:5′-AGTGGGAGCAGAAGACAT-3′,下游序列为:5′-TGGA CCTGGTTACCTATC-3′,扩增目的基因片段长度为264 bp。内参物GAPDH的上游序列为:5′-CAATGACCCCTTCATTGACC-3′,下有序列为:5′-TGGACTCCACGACGTACTCA-3′,扩增目的基因片段长度为306 bp。BMP4反应循环条件如下:94℃变性60 s,94℃退火30 s,59℃30 s,72℃ 60 s,35WH 循环,最终72℃延伸10 min〔20〕。OPG反应循环条件如下:95℃变性1 min,57℃ 60 s,72℃ 60 s,35循环,最终70℃延伸1 min。GAPDH反应循环条件为:94℃变性15 s,94℃ 15 s,59℃退火30 s,72℃30 s,40循环〔22〕,最终72℃延伸10 min。将PCR产物10 μl于1.2%琼脂糖凝胶电泳30 min,采用凝胶自动成像及分析系统,电泳结果用凝胶图像分析系统分析电泳条带光密度值,计算光密度与GAPDH的光比值。
1.3.6Western印迹检测BMP-4及OPG蛋白表达水平 术后12 w,剥离假手术组、模型组、hAMSCs移植组及联合组已处死的3只大鼠骨组织,用PBS溶液洗涤3次,加入100 μl 含有蛋白抑制剂苯甲基磺酰氟(PMSF)的RIPA细胞裂解液(预先冰浴10 min),测定蛋白含量。4%聚丙烯酰胺凝胶(SDS-PAGE)电泳,15 mA电泳1 h后,取下凝胶,蛋白条带电转膜至聚偏氟乙稀(PVDF)膜,将转移完成的PVDF膜放入培养皿,加入5%脱脂奶粉,浸过PVDF膜即可,封闭1 h。分别与多克隆兔抗体BMP-4和抗体OPG(1∶250)反应,阴性对照组与GAPDH(1∶1 000)抗体反应。一抗稀释后放入培养皿中,加入PVDF膜,4℃恒温过夜,过夜振荡孵育后,取出PVDF膜,用TBST液冲洗多次,每次浸润5 min。与二抗反应,常温下振荡孵育2 h,取出PVDF膜,用TBS液冲洗多次,每次浸润5 min。按照电化学发光(ECL)说明书操作步骤,对PVDF膜进行荧光染色,液体A和液体B等量混合后,将其加入PVDF膜正面,反应1 min,置于暗室10 min,曝光、显影、定影,通过Alpha2200图像分析仪对各组条带扫描拍照,进行半定量分析。
1.4统计学方法 采用SPSS13.0软件行t检验及采用方差分析
2 结 果
2.1hAMSCs的形态观察 原代hAMSCs形态各异,显微镜可见菱形、圆形、不规则形,体积偏小,且可见少量杂质细胞。当细胞融合达到85%左右时,反复培养和传代,本研究细胞传至第3代时,形态较规则,多为长窄梭形,体积增大,生长速度增快,出现细胞伪足,未能观察到杂细胞,见图1。
2.2各组大鼠体重变化 假手术组大鼠体重增长符合动物自然生长规律,术后1 w,模型组、hAMSCs移植组及联合组体重均低于较假手术组。术后3 w,hAMSCs移植组及联合组体重渐增,其中hAMSCs移植组增大幅度较小,大幅度增大的联合组体质量与假手术组较为接近,而模型组的增长趋势不明显,见表1。

图1 hAMSCs形态观察(×200)

表1 各组不同时期体重变化
与模型组比较:1)P<0.05;与hAMSCs移植组比较:2)P<0.05,下表同
2.3各组PINP、BAP、DPD的含量变化 模型组DPD明显高于假手术组,hAMSCs移植组则明显低于模型组,联合组又明显低于hAMSCs移植组差异有统计学意义(P<0.05)。与假手术组差异无统计学意义(P>0.05)。hAMSCs移植组及联合组BAP明显高于模型组(P<0.05),假手术组BAP最高,联合组接近假手术组(P>0.05)。与假手术组比较模型组PINP明显降低,hAMSCs移植组和联合组PINP明显升高(P<0.05),联合组明显高于hAMSCs移植组(P<0.05),联合组与假手术组接近(P>0.05),见表2。

表2 各组DPD、BAP和PINP比较
2.4BMP-4及OPG mRNA表达水平 假手术组BMP-4mRNA(1.89±0.10)和OPG mRNA(1.95±0.13)表达水平最高,联合组BMP-4mRNA(1.89±0.10)、OPG mRNA(1.79±0.14)表达水平略低于假手术组且明显高于hAMSCs移植组(0.94±0.09,1.02±0.09),而模型组BMP-4mRNA(0.48±0.09)和OPG mRNA(0.56±0.10)表达水平最低,各组间差异有统计学意义(P<0.05)。见图2。

图2 各组BMP-4和OPG mRNA表达
2.5BMP-4及OPG蛋白表达水平 BMP-4和OPG蛋白表达在假手术组(1.68±0.11、1.74±0.12)、模型组(0.24±0.08、0.33±0.09)、hAMSCs移植组(0.88±0.10,0.94±0.11)及联合组(1.57±0.12,1.68±0.14)与其相对应的mRNA表达水平呈相关性,即假手术组BMP-4和OPG蛋白表达水平最高,联合组和hAMSCs移植组二者表达水平依次降低,模型组最低,各组间差异有统计学意义(P<0.05),见图3。
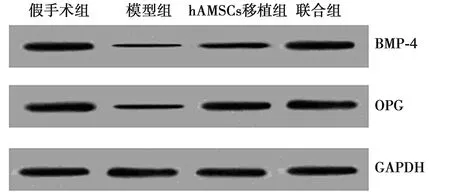
图3 各组BMP-4和OPG蛋白表达
3 讨 论
Ⅰ型原发性骨质疏松是由雌激素水平低下引起的〔1〕,骨吸收的增量大于骨形成的增量,引起的微观骨结构发生改变,骨小梁变细、数目降低、出现断裂现象〔12〕,甚至骨表面出现孔隙、骨表层变薄,脆性增加〔13〕,严重可导致全身骨病〔14〕。目前,研究者公认雌激素可以调节分布于骨细胞的雌激素受体,改善成骨细胞能力,提高骨形成。hAMSCs是一种极具分化潜能的干细胞〔15,16〕,在细胞分化增生方面起到非常重要的作用〔17,18〕。PINP和BAP调节着成骨细胞中胞质的合成和储存,可灵敏地反映骨吸收情况,DPD则起到Ⅰ型胶原纤维分子间的连接作用〔19〕,与破骨细胞含量有关。Ⅰ型胶原纤维降解后,DPD作为产物释放,故检测血清中的DPD可反映机体骨吸收情况。BMP-4和OPG均有骨保护作用〔20,21〕,BMP-4分子量较小,可诱发骨形成,可促进成骨细胞分泌骨形成因子〔22,23〕。OPG是对破骨细胞起调节作用的糖蛋白,可有效减弱破骨细胞的生成并阻碍其发挥作用〔24〕。本研究显示拆除双侧卵巢的大鼠骨密度下降,而同时联用hAMSCs和虾青素可扭转大鼠去卵巢情况,可能对破骨细胞的活性起到制约作用,其原因可能与促进了BMP-4和OPG的分泌,进而保护成骨细胞,并抑制了破骨细胞的释放有关。
