南海台风引发藻华的生物机制
2018-09-28张亚锋王旭涛殷克东
张亚锋,王旭涛,殷克东,*
1 中山大学海洋科学学院,广州 510006 2 珠江水资源保护科学研究所,广州 510000
海洋浮游植物的生长与光照、营养盐和浮游动物的摄食等因素密切相关。海洋水体中光照和营养盐在垂向上的反向分布使得浮游植物的浓度和粒级结构在不同水层显著不同[1]。热带和亚热带的寡营养海洋中,在营养盐跃层和光补偿深度附近形成了次表层叶绿素最大层(Deep chlorophyll maximum, DCM)[2- 4]。DCM层在大洋水体中广泛存在,研究表明,DCM层贡献了超过了70%的水体初级生产力[5- 7],其在海洋生态系统功能和生物地球化学循环过程中发挥重要的作用[8- 9]。DCM层的形成与维持的主要影响因素包括:较高的浮游植物生长速率,沉降细胞或游泳浮游植物的富集,以及较低浮游动物摄食等[2]。
海洋表层的浮游植物长期处在高光照和低营养的环境中,而DCM层的浮游植物则生活在低光照和营养盐相对丰富的环境中。由于不同粒级的浮游植物细胞对光照和营养利用效率的不同[10- 14],浮游植物的粒级结构在表层和DCM层水体也显著不同[1]。小型浮游动物(<200 μm)是海洋浮游植物的主要摄食者,可以消耗60%—80%日初级生产力[15- 16]。虽然稀释法被广泛用来评估小型浮游动物的摄食速率[17],然而目前关于小型浮游动物摄食活动的研究仍然不足以阐释小型浮游动物在表层和DCM层的作用。首先,在稀释实验中为了促进浮游植物持续生长,不同实验者加入营养盐的种类和浓度不同,而营养盐的加富,特别是在寡营养水体,可能会对浮游生物的生长造成不利影响[18- 19];其次,常用来作为培养容器的聚碳酸酯瓶会屏蔽自然光中的紫外光(UVR, 280—400 nm),改变浮游生物的原生光照环境。总体而言紫外线不利于浮游植物的生长,但其对不同粒级的浮游植物的影响又不尽相同[20- 21]。另外,紫外线对小型浮游动物的摄食的影响同样存在争议,研究发现短时间的紫外线能增加桡足类浮游动物的摄食[22],而长时间过量的紫外线会明显增加浮游动物的死亡[23]。因此在探究表层和DCM层浮游植物生长时,除了营养盐、光照等自然因素外,也需要考虑小型浮游动物摄食的差异,以及小型浮游动物对不同粒级浮游植物摄食的选择[24- 27]。
在寡营养的大洋水域,台风能打破水体的层化结构,把深层富营养水体带到表层。中国南海是热带-亚热带寡营养海域,光照充足,水体层化结构稳定[28]。真光层水体中较低的营养盐不足以支撑浮游植物的大量生长,然而每年台风过后都有大量的藻华爆发的报道[29- 30]。之前的研究表明,这可能是诸如台风、内波等物理过程引发的海水混合将富营养的深层水体带到表层,为表层水体补充大量的营养盐,进而促进了表层浮游植物的爆发生长[30- 33]。然而,海水垂向混合不仅改变了表层水体的营养条件,同时改变了表层水体浮游植物和浮游动物的组成。之前的研究大都集中在台风等物理过程如何提高真光层内营养盐,而真光层内营养盐的提高如何影响浮游植物、浮游动物及其相互关系的研究相对匮乏。
台风等物理过程会打破海洋水体层化结构、改变真光层的营养状态,其引发的浮游植物藻华对海洋生物泵效率及碳的生物地球化学产生重要影响。台风过后,寡营养水体中寡营养藻类显著减少,粒级更大的硅藻成为优势种,这种浮游植物种群变化会增强生物泵的固碳效率,使得更多的碳沉降的深层水体[29]。然而这种生物种群的变化是如何完成的,以及台风引发藻华过程中营养盐、浮游植物生长和小型浮游动物摄食活动各自发挥的作用,相关研究目前还不充分。本研究通过对比南海航次中表层和DCM层的水样在不同光照和营养条件下的生长,来探究获得营养盐的表层浮游植物还是获得光照的深层浮游植物是藻华爆发的优势种。这对台风引发藻华过程中浮游植物种群演变的认识具有重要帮助,这也是本研究的主要目的。另外,由于寡营养水体中小型浮游动物的摄食活动严格控制浮游植物的生长,小型浮游动物的摄食活动对浮游植物种群的演变同样发挥着重要作用。因此,本研究同时对比了小型浮游动物摄食活动在表层和DCM层的不同,以及它们对浮游植物群落结构的调控作用。
图1 2005年5月(S站位)和9月(E和B站位)南海航次采样站位图
1 材料与方法
1.1 样品的采集及实验
在2005年5月和9月的南海航次中,在采样站点,利用CTD读取不同水层的温度、盐度和叶绿素数据,根据叶绿素的垂向分布趋势,确定DCM层深度(图1)。利用CTD采水器采集水样进行实验。采集到的水样均用200 μm筛绢过滤以除去较大的浮游动物。将1 L水样分别通过5 μm和0.7 μm的滤膜过滤,滤膜用锡纸包好,以测定分级叶绿素;取50 mL用0.7 μm过滤的水样于营养盐瓶中,以测定无机营养盐。收集到的样品迅速置于-20℃冰箱中冷冻保存。所有容器都提前用10%的盐酸浸泡(24 h),超纯水清洗,并在培养实验时用采集到的水样润洗3次。
1.2 营养加富实验
为了对比表层和深层浮游植物对光照和营养盐的响应,本研究选取水深超过1000 m的S9站点作为实验站位。S9站点位于南海中央海盆,水体层化结构稳定。在S9站位分别采集表层(1 m)和DCM层(70 m)水样进行培养实验。向采集到的水样中添加终浓度为1/10的F/2培养液。将加富后水样分装到5.5 L的石英瓶(自然光)和聚碳酸酯培养瓶(仅可见光)中,每瓶装5 L水样,每组设3个平行样。部分聚碳酸酯培养瓶利用遮光网屏蔽95%的可见光,模拟DCM层的光照强度。所有培养瓶放在用表层海水流动的培养箱中,以保证培养温度和海洋表层水温一致。培养于早上7:00开始,在培养开始时、及培养12、24、30、36、48、54 h和60 h后分别采样。每次采集300 mL水样,用孔径为5 μm和0.7 μm的滤膜过滤以收集叶绿素样品。
1.3 稀释实验
为了探究表层和DCM层小型浮游动物的摄食活动,本研究在南海两个航次共12个站点进行稀释实验[17]。实验站点涵盖珠江口近岸、南海深水海盆区,在水体层化结构明显的深水区,采集表层和DCM层水样进行实验;而在珠江口等水深较浅的水域,只采集表层水体进行实验。采集的初始海水(initial seawater, ISW)通过0.2 μm的滤膜过滤制成无浮游植物水(phytoplankton free water, PFW)。利用PFW稀释ISW,稀释为ISW的0.2, 0.4, 0.6, 0.8, 1.0共5个梯度,每个浓度梯度共有3个平行样。培养瓶放在用表层海水控温的培养箱内培养24 h;结束后,用孔径为5 μm和0.7 μm的滤膜过滤收集叶绿素样品。在培养开始前,收集3份叶绿素样品作为初始叶绿素浓度。在S10、S16和S18站点,将水样分装到石英培养瓶和聚碳酸酯培养瓶内进行稀释实验,以测定UVR对小型浮游动物摄食的影响。在S10、E407和S16站点利用表层和DCM的水样在聚碳酸酯培养瓶内进行稀释实验,对比表层和DCM层小型浮游动物的摄食速率。在E101、E206、E709和B1站位分别做营养盐加富组(添加终浓度为1/50的F/2培养液)和自然水体组进行实验,对比营养盐加富对小型浮游动物摄食速率的影响。在其余的E406、B2、E504站点利用表层水样进行稀释实验。
浮游植物的净生长速率k= [ln(Pt/Po)]/t, 其中t是培养时间,P0和Pt分别是培养前后叶绿素的浓度。利用k在不同稀释梯度上进行线性回归,其中回归方程斜率的相反数为浮游动物的摄食速率m。
1.4 样品测定
叶绿素浓度用丙酮萃取法测定[34]。将滤膜置于含有10 mL 90%丙酮溶液的离心管中,在4°C黑暗条件下萃取14—16 h。离心后取上清液用荧光光度计(10-AU Turner Designsfluorometer)测定吸光值,计算叶绿素浓度。本研究将粒级直径在0.75—5 μm的浮游植物称为小粒级浮游植物,大于5 μm的浮游植物称为大粒级浮游植物。无机营养盐浓度(硝酸盐、亚硝酸盐、铵盐和磷酸盐)用营养盐自动分析仪(Skalar San Plus Auto-analyzer)测定[34]。
2 结果
2.1 S9站位的水体结构和营养状况
S9站位的水体温盐和营养盐分布如图2和表1。和其他站位类似,温度和盐度的垂向分布证明了温跃层和盐跃层的存在。从表层到水深120 m,温度从28.55下降到18.10,盐度从34.46增加到34.69。混合层的深度为20 m,温跃层出现在90 m水深。DCM层出现在水深70 m,叶绿素的浓度为0.44 μg/L,远高于表层的0.08 μg/L。DCM以上水体中小粒级的浮游植物占比大于80%,DCM层营养盐浓度均高于表层(表1)。
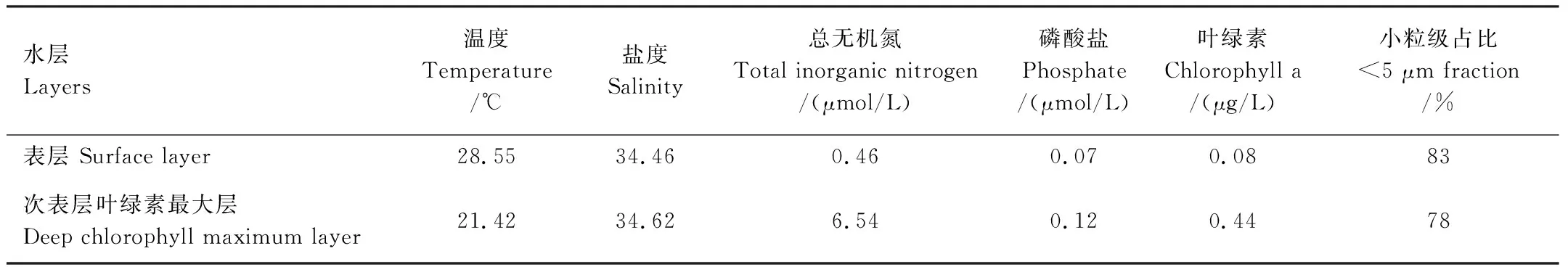
表1 S9站点的环境因子和叶绿素在表层和次表层叶绿素最大层的对比
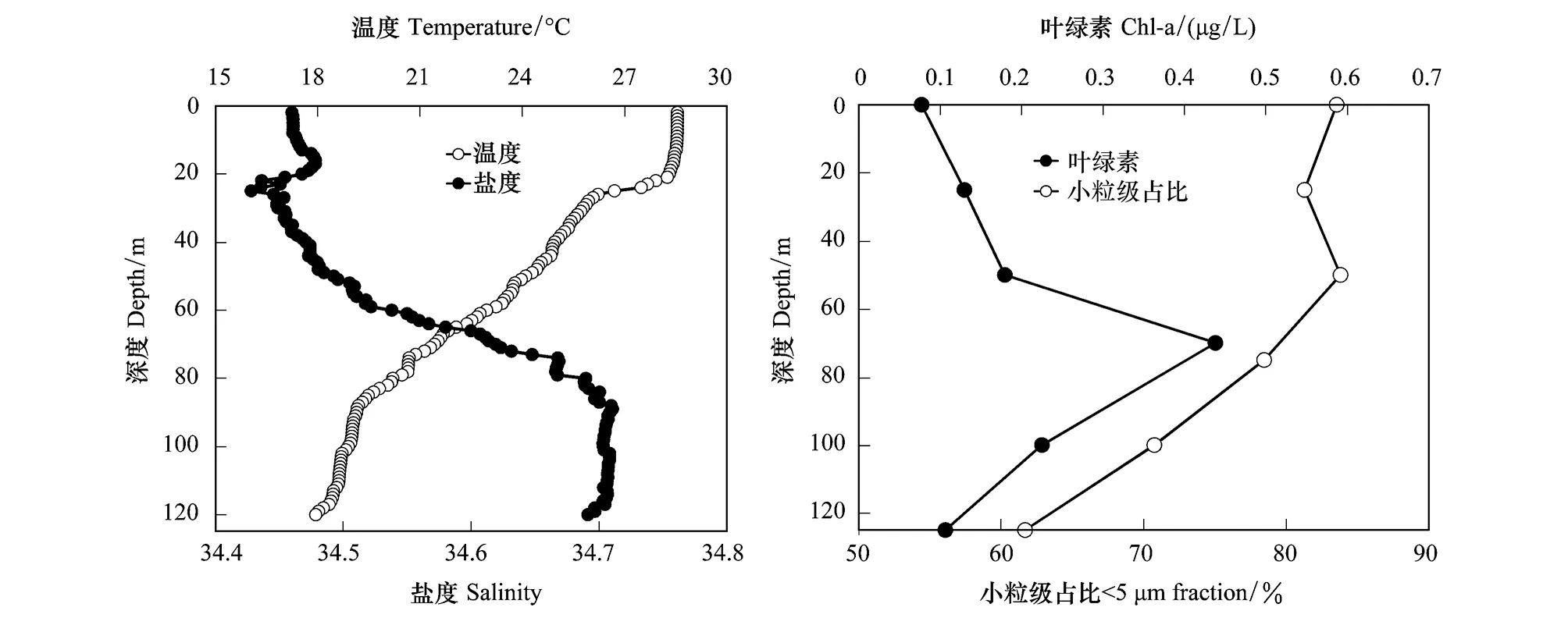
图2 S9站位温度、盐度、叶绿素浓度及小粒级在总叶绿素中比例的垂向分布
2.2 浮游植物对营养和光照的响应
在自然光和5%可见光下,表层浮游植物经过约50 h的适应期后,均快速增长(图3),60 h后其叶绿素浓度分别为3.5 μg/L和2.6 μg/L。在自然光下,小粒级浮游植物保持着群体优势,占比一直大于80%,营养加富没有明显改变浮游植物群落的粒级结构;在5%可见光下,大粒级的浮游植物的占比增大到73%。
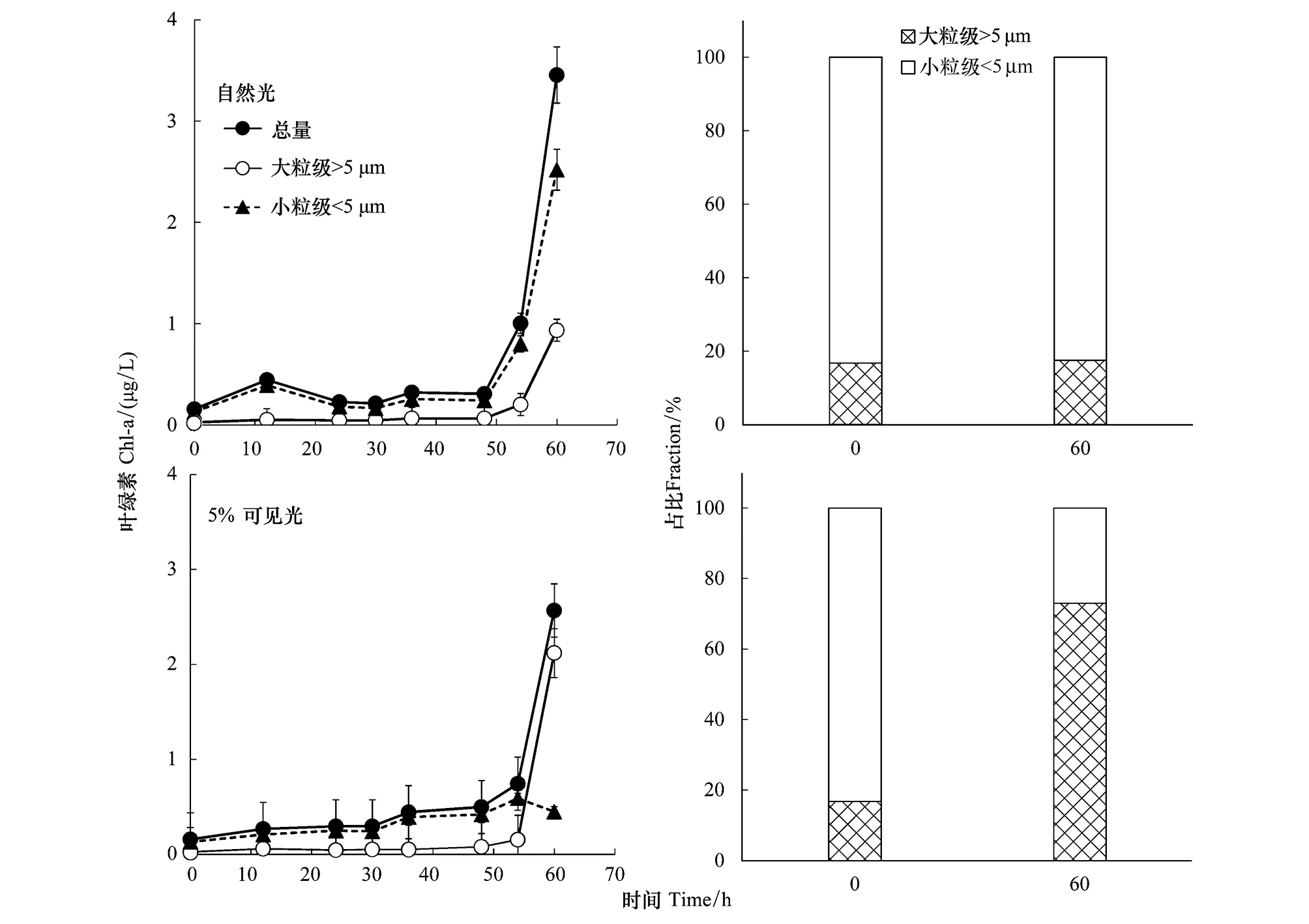
图3 S9站位表层水体样品叶绿素浓度及浮游植物粒级占比在培养前后的变化
DCM层浮游植物在自然光、100%和5%可见光下经过约35 h的适应期后,均出现指数增长(图4)。DCM水体中小粒级浮游植物的初始占比为86%,培养结束后,占比依次降为76%、53%和79%。在100%和5%可见光条件下,小粒级叶绿素的浓度并没有显著区别,分别为28.4 μg/L和27.2 μg/L,而大粒级叶绿素的浓度分别为23.8 μg/L和7.7 μg/L,说明光照增强对小粒级浮游植物的影响不大,而对大粒级浮游植物有显著的促进作用。和100%可见光相比,在含有紫外线的自然光条件下,大粒级叶绿素的最终浓度略有下降,从23.8 μg/L降到17.6 μg/L,而小粒级叶绿素的浓度显著上升,从23.8 μg/L升到56.8 μg/L。总体而言,加富后的DCM层水体从原生光照强度(5%可见光)增加到表层自然光后,生物量浓度明显增加,群落粒级结构从小粒级变为大粒级。另外,相比表层,DCM层浮游植物的调整期明显更短。
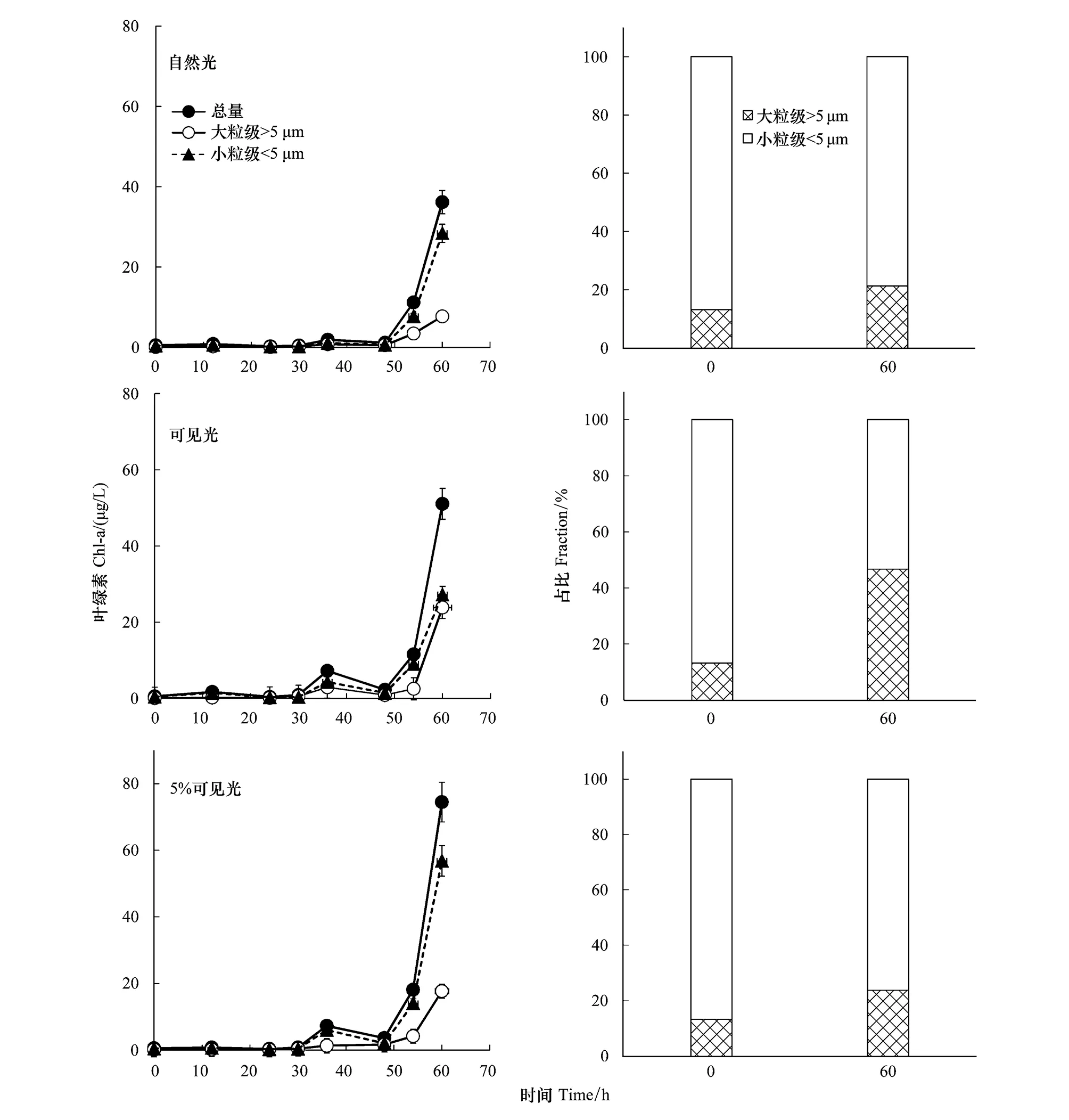
图4 S9站位次表层叶绿素最大层水体叶绿素浓度及浮游植物粒级占比在培养前后的变化
2.3 小型浮游动物摄食速率
不同光照和营养条件下,实验站位表层和DCM层水体中小型浮游动物的摄食速率(m)如图5和表2所示,在可见光条件下,表层水体的平均m((1.14 ± 0.36)d-1)高于DCM层((0.76 ± 0.12)d-1);表层小型浮游动物对大粒级浮游植物的摄食((1.22 ± 0.38)d-1)显著高于小粒级((0.87 ± 0.21)d-1)(配对t-检验,n=11,P<0.01),而DCM层小型浮游动物对大粒级浮游植物的摄食((0.64 ± 0.15)d-1)低于小粒级((0.89 ± 0.22)d-1),但差异性并不显著。在自然光条件下,小型浮游动物的总体摄食率、对大粒级和小粒级浮游植物的摄食,分别增加33%、 64%和18%。营养盐添加总体降低小型浮游动物的摄食活动,但降低效果不明显;这种降低主要是减少对大粒级浮游植物的摄食,而轻微增加对小粒级浮游植物的摄食。
3 讨论
3.1 表层和DCM层小型浮游动物的摄食
在海洋表层和DCM层水体中,除了温度、营养盐、光照等环境因素不同外,浮游植物和小型浮游动物的浓度和组成也不同,这些因素都会对小型浮游动物的摄食活动产生影响。本研究发现南海北部夏季m在DCM层小于表层,这与Chen等[35]在南海相似水域的发现一致。小型浮游动物的摄食活动在表层大于DCM层的原因可能有:第一,在寡营养水域,表层水体由于营养盐的限制,浮游植物以小粒级为主,它们更容易被小型浮游动物摄食[12];第二,表层水体的摄食者主要是粒级小于20 μm的异养鞭毛虫和原生动物等群体[25- 27],而在DCM层由于纤毛虫等较大粒级摄食者存在,较大粒级摄食者对小粒级摄食者的捕食缓解了小粒级对浮游动物的摄食[36- 37];第三,较低的温度也可能限制小型浮游动物在DCM层摄食活动[16, 38- 39];第四,表层水体接收较高的紫外线,而紫外线对小型浮游动物的摄食同样有影响[22]。
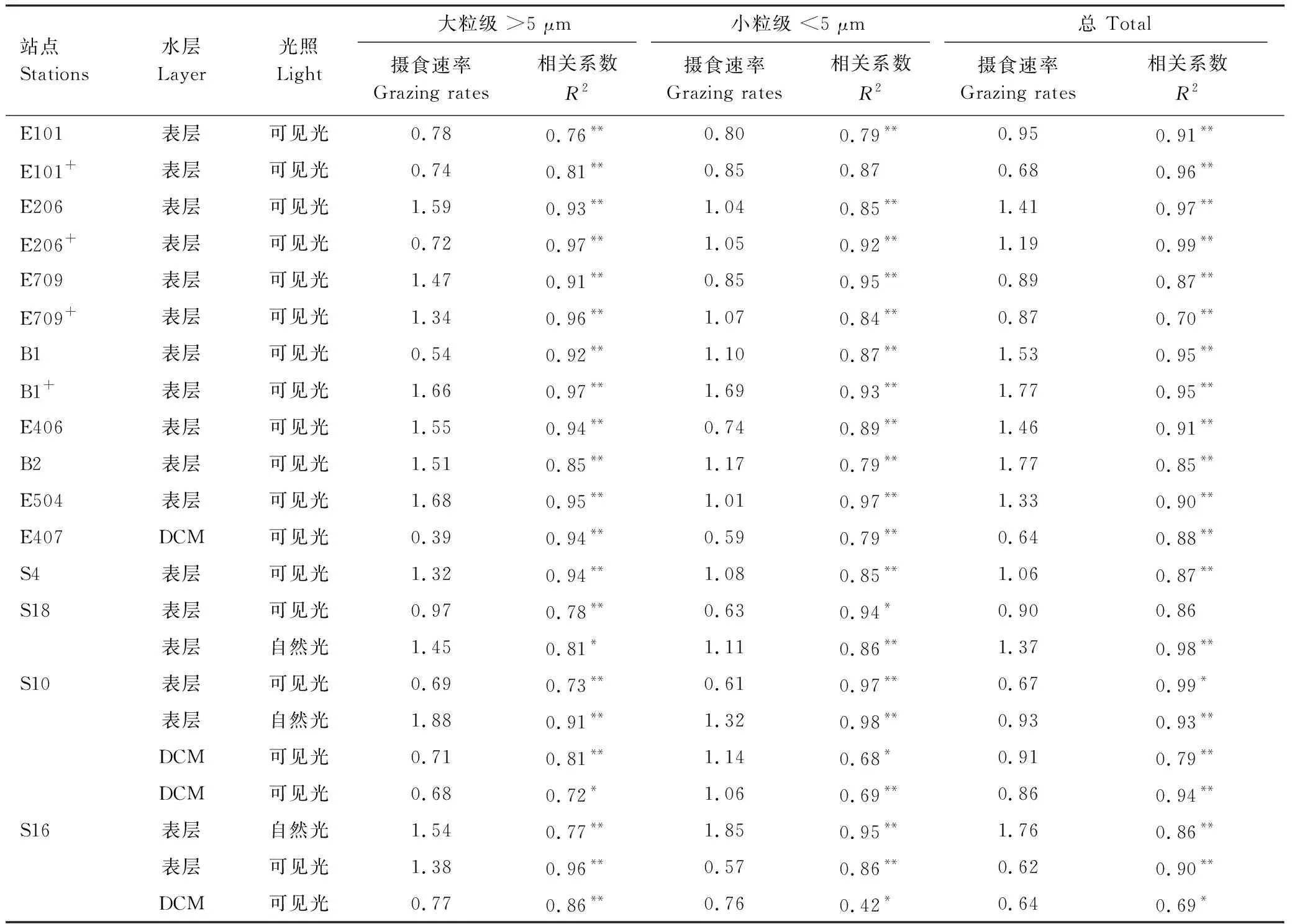
表2 不同光照条件下小型浮游动物的摄食速率
DCM:次表层叶绿素最大层,Deep chlorophyll maximum;“+”代表营养加富;“*”和“**”分别代表显著性在P<0.05和P<0.01
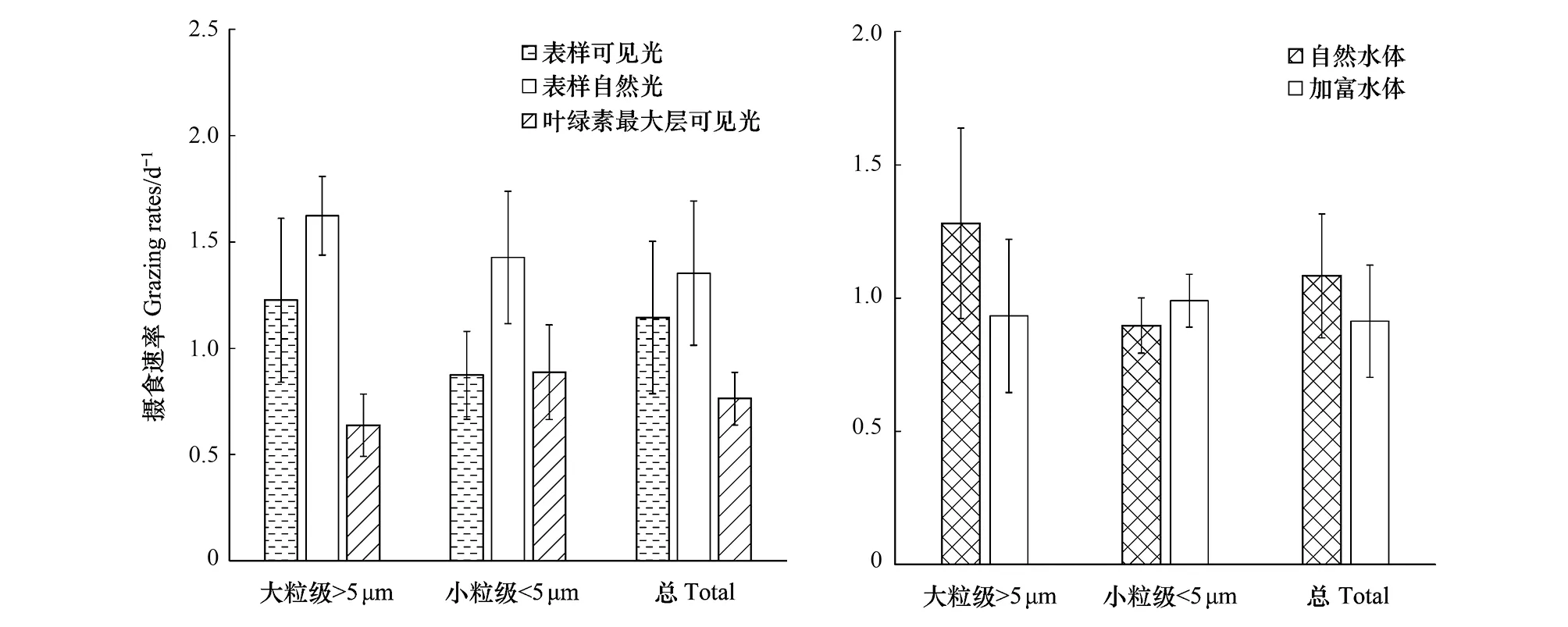
图5 不同光照和营养条件下,表层和次表层叶绿素最大层小型浮游动物的摄食速率
影响小型浮游动物摄食活动的环境因素包括温度、上升流、台风等环境因子[16, 40- 41]。目前,南海小型浮游动物摄食活动的研究主要集中在表层水体,对于DCM层小型浮游动物摄食活动的研究相对较少[16, 35, 40- 42](表3)。如Chen等[35]发现南海北部表层的m在夏季平均为((0.49±0.47) d-1),冬季为((0.35±0.21)d-1),且冬季m和温度密切相关[16]。在台湾海峡附近m在上升流区((0.85±0.37)d-1)大于非上升流区((0.5±0.17) d-1)[40]。台风风神过后,m为((1.17±0.56)d-1)高于其他时间((0.83±0.54)d-1)[42- 43]。虽然这些研究阐明了环境因素对m的影响,但这是复合因素共同作用的结果。比如相比非上升流区,上升流区的温度、营养盐和小型浮游动物种群均有变化,这些因素共同造成了上升流区和非上升流区m的不同。为了探究单一因素对小型浮游动物摄食活动的影响,本研究通过设置不同的营养和光照条件进行稀释实验。利用营养盐加富和不加富组,发现营养加富轻微降低m;利用不同的培养瓶,发现紫外线能增加m。这些过程获得了单一因素对小型浮游动物摄食活动的影响,为进一步分析表层和DCM层小型浮游动物摄食活动的不同提供了依据。
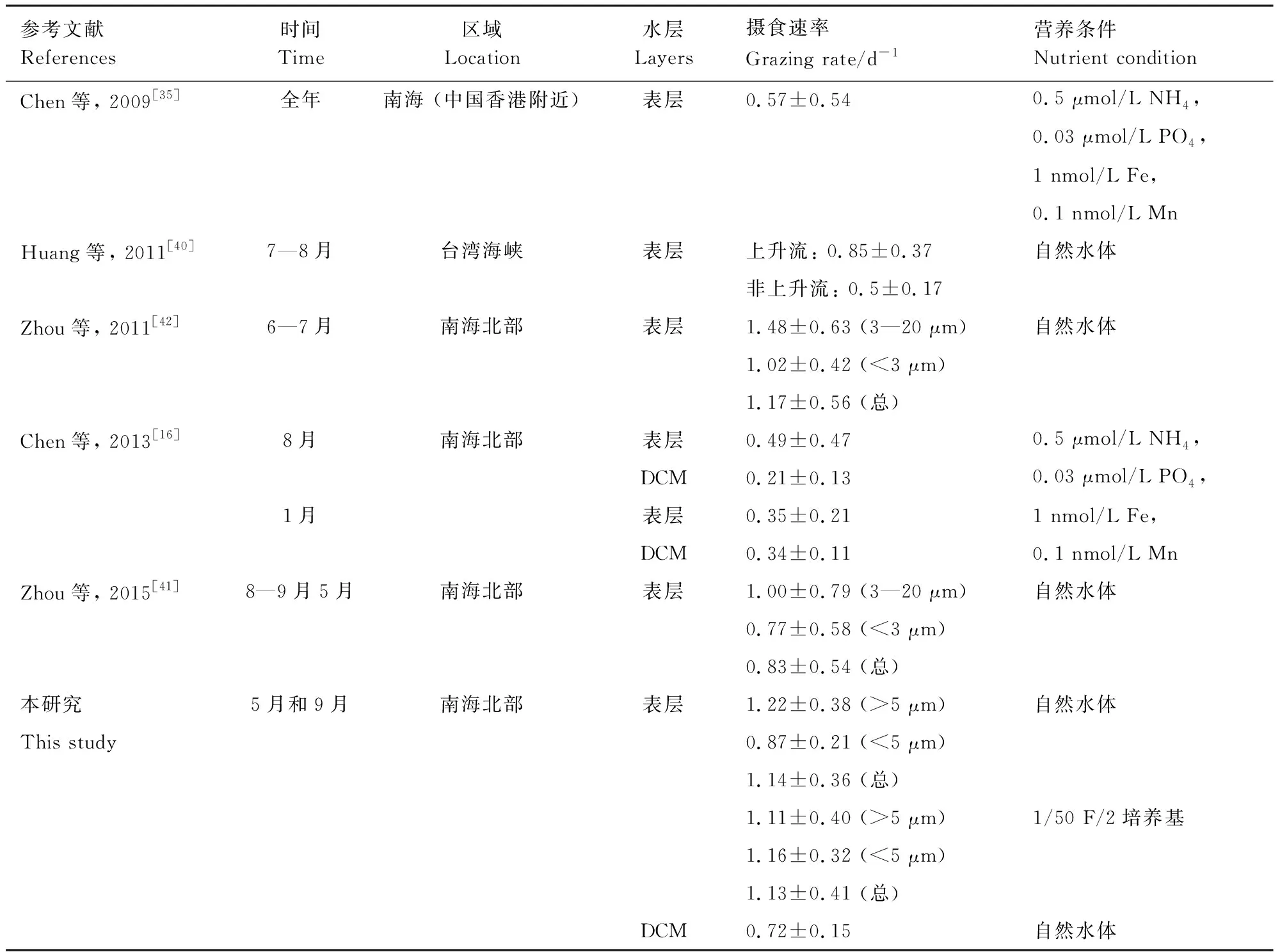
表3 在南海用稀释法评估的小型浮游动物摄食速率的对比
DCM:次表层叶绿素最大层,Deep chlorophyll maximum
相比DCM层,表层水体中较高的小型浮游动物摄食活动具有重要的生态学意义。在寡营养水域,浮游植物的生长整体处于营养限制状态,特别是在表层水体,浮游植物的生长主要依靠浮游动物摄食释放出的营养盐[35, 44],即表层水体中浮游植物的生长和浮游动物的摄食密切相关[15, 41, 45- 46]。这说明表层水体的营养盐循环更快,是由微食物环调控的群落,几乎没有有机物能进入更高的营养级[47- 48];而在DCM层,随着营养盐的增加,浮游植物的生长不受较弱的摄食活动的限制,浮游植物生长和浮游动物摄食的相关性会降低[49- 50]。由于小粒级浮游植物能更有效的利用营养盐,这也是之前的研究发现小粒级浮游植物在寡营养水域起主导作用的原因[51- 52]。然而本研究发现浮游植物粒级结构除了和营养盐水平相关,还和小型浮游动物摄食的粒级选择有关。本研究发现表层水体中小型浮游动物对大粒级浮游植物摄食高于小粒级,这与高被摄食率浮游植物在浮游植物群落中的存量最少的原则相符[53- 55],也与Zhou等[41]在南海相似水域发现的小型浮游动物摄食的粒级选择一致。而在DCM层,大粒级浮游植物可能摆脱小型浮游动物摄食的控制[49, 56],进而增大在浮游植物群落中的比例。
3.2 浮游植物对营养盐和光照的响应
虽然DCM层相对稳定,但光照和营养盐的波动可能对其生物群落结构产生重要的影响[8, 57- 58]。本研究中,营养盐加富促进了浮游植物的生长,而大粒级浮游植物在营养盐利用上的优势,使其在与小粒级竞争中获得较大优势[59];同时,大粒级浮游植物拥有更高的光照利用效率[12, 14],光照强度的提高进一步促进了大粒级浮游植物的生长[60]。此外,DCM层的小型浮游动物对浮游植物的摄食没有显著粒级差异。因此,光照和营养的提高促使大粒级浮游植物成为DCM的优势种群。另外,与100%可见光组相比,自然光组中大粒级浮游植物的生物量稍有降低。这可能是紫外线不利于大粒级浮游植物的生长[61],也可能是因为紫外线对小型浮游动物摄食活动的刺激引起的。与DCM层不同,营养盐加富对表层水体的浮游植物群落结构没有产生很大的影响。这可能因为大粒级浮游植物的初始浓度较低,而且其还面临较大的摄食压力,营养盐加富的促进作用被前两个因素抵消了。另外,在寡营养水体中,浮游植物的生长和小型浮游动物的摄食密切相关[62],摄食活动释放的营养盐基本满足小粒级浮游植物的生长[63],这可能是表层叶绿素浓度在营养盐加富后经过了较长的调整期才开始增长的原因。因此,营养加富短时间内对表层水体浮游植物生长的促进作用不明显,对浮游植物群落结构影响不大。
在寡营养的南海,浮游植物群落粒级在表层小于DCM层,而且表层浮游植物面临更大的摄食压力。因此,浮游植物、细菌和小型浮游动物组成的微食物环是表层水体中营养和能量流通的主要通道,而较大的浮游植物和浮游动物组成的传统食物链在DCM层起主导作用。虽然表层水体营养匮乏,摄食活动释放的营养盐基本满足了小粒级浮游植物的生长需求;而营养相对丰富的DCM层中,较大粒级的浮游植物却处于营养和光照的限制状态。这与Fujiki等[11]在亚热带北大西洋的浮游植物的生理反应与光照关系的研究中的发现相一致[11]。所以,当营养和光照发生改变时,DCM层浮游植物能迅速生长,而表层浮游植物却需要较长的响应时间。
因此,除温度外[64],台风引发的水体混合同时改变表层水体的营养和浮游生物组成,光照的提高以及较低的小型浮游动物摄食压力能使来自深层的较大粒级浮游植物迅速生长,成为藻华爆发的优势种,这是台风引发浮游植物藻华形成的主要机制。藻华爆发过程中,浮游植物群落粒级的增大,改变表层水体的物质和能量流通途径,对碳的生物地球化学循环具有重要的作用,不仅促进了海洋生物固碳作用,而且增大了海洋生物泵的固碳效率。
4 结论
寡营养的南海,台风引发的藻华是物理和生物活动共同作用的结果。水体的垂向混合把深层富营养水体带到表层,虽然表层水体在混合过程中获得了营养盐,但较大的小型浮游动物摄食压力抑制了表层浮游植物生物量的增加;而深层水体中浮游动物摄食活动相对较弱,较大粒级的浮游植物获得充足光照后,迅速生长成为优势种,形成藻华。在台风引发的藻华爆发过程中,浮游植物群落粒级的变大能提高海洋生物泵的效率,促进寡营养海域的固碳作用。
